Mortalin在肝癌中的表达及其与血管生成和上皮间质转化的关系
2014-05-18李建生刘文斌荚卫东许戈良马金良余继海葛勇胜
陈 静,李建生,刘文斌,荚卫东,许戈良,马金良,余继海,葛勇胜
热休克蛋白75(Mortalin)是在小鼠胚胎成纤维细胞中克隆出来的一种蛋白,属于热休克蛋白70家族成员之一[1]。研究[2-6]显示,Mortalin 参与细胞生长周期调控、外界应激和肿瘤发生等多种生物学过程,且在多种恶性肿瘤中高表达,与肿瘤的转移关系密切。该研究选取100例原发性肝癌(hepatocellular carcinoma,HCC)患者的癌组织和癌旁组织及10例正常肝组织,采用免疫组织化学染色技术,检测Mortain、波形蛋白 (Vimentin)和微血管密度 (microvessel density,MVD)的表达情况。同时,选取13例HCC患者冻存的癌组织和癌旁组织,行qPCR和Western blot分析,探讨Mortalin在HCC转移中的临床意义。
1 材料与方法
1.1 病例资料 收集2007年6月~2010年6月在安徽医科大学附属省立医院100例HCC患者,男76例,女24例;年龄21~80(56.4±11.4)岁。患者术前未行化疗、介入等辅助治疗,且组织经病理学确诊。选取10例因外伤行肝部分切除患者的正常肝组织作为对照;选取13例来源于我院肝胆胰外科安徽省重点实验室标本库的冷冻肝癌患者的癌组织和相应的癌旁组织。
1.2 主要试剂和仪器 兔抗人Mortain多克隆抗体和兔抗人β-actin抗体购于美国Abcam公司;鼠抗人CD34多克隆抗体、鼠抗人Vimentin多克隆抗体、辣根过氧化物酶标记的通用型二抗和DAB试剂盒均购于北京中杉金桥生物技术有限公司;蛋白提取试剂盒购于中国KeyGEN公司;TRIzol购于美国Invitrogen公司;ECL显影试剂盒购于美国Pierce公司;PVDF膜购于美国Millipore公司;逆转录试剂盒购于美国Thermo公司;实时定量PCR试剂盒购于日本TaKaRa公司。
1.3 免疫组织化学染色检测 常规行石蜡切片,厚2 μm。首先,每张片子行HE染色;然后,免疫组化染色按试剂说明书行SP二步法染色。光镜下计数和拍照。细胞质中出现黄色颗粒为Mortalin阳性表达;Vimentin蛋白主要表达在肝癌细胞周围的间质细胞中,发生EMT后部分肝癌细胞胞质中出现黄色为Vimentin阳性表达。染色评估使用半定量计数法[7]:光镜100倍下检查组织染色强度 (0:无;1:弱;2:中;3:强),然后400倍下检查肿瘤细胞阳性染色比例 (0:<5%;1:5% ~25%;2:26% ~50%;3:51% ~75%;4:>75%)。把这两项得分相乘得出最后的评分。≥4分为高表达;<4分为低表达。通过抗CD34抗体染色血管上皮细胞,低倍镜下找到血管最密集的地方,然后200倍下计数MVD[8]。
1.4 Western blot检测 按照蛋白提取试剂盒的说明书,制备蛋白标本,BCA法测蛋白浓度。取20 μl样品上样,使用SDS-PAGE胶电泳分离蛋白,半干式电转膜仪转移蛋白至PVDF膜上,脱脂奶粉封闭,Mortalin一抗孵育过夜,β-actin二抗室温孵育2 h。ECL显影和定影。Mortalin蛋白大小为74 ku;βactin蛋白大小为43 ku。Mortalin相对含量=Mortalin灰度值/β-actin灰度值。
1.5 qPCR检测 根据 TRIzol使用说明书,提取RNA。采用吸光度比值OD260/OD280测RNA纯度和浓度。使用逆转录试剂盒合成cDNA。Mortalin的引物序列:正向5'-GAGAGACAGGGGTTGATTTGAC-3',反向 5'-GCACAGATGAGGAGAGTTCACA-3';内参(GAPDH)引物序列:正向5'-AAGGTCATCCCTGAGCTGAAC-3',反向 5'-ACGCCTGCTTCACCACCTTCT-3'。PCR反应条件为95℃ 5 s;60℃ 30 s,40个循环。Mortalin基因扩增产物大小为96 bp;GAPDH基因扩增产物大小为142 bp。基因扩增产物的相对表达量以 2-ΔΔCt法计算。
1.6 统计学处理 采用SPSS 13.0统计软件进行分析,率的比较采用χ2检验和Fisher确切概率法,组间均数比较采用t检验。
2 结果
2.1 Mortalin在肝癌、癌旁和正常组织中的的相对表达量 qPCR法检测结果显示,Mortalin mRNA在肝癌、癌旁和正常组织中相对表达量为2.18±0.31、0.35±0.14和 0.13±0.05。肝癌组织中的Mortalin相对表达量明显高于癌旁和正常组织(t=15.72,P < 0.05;t=20.75,P <0.05)。Western blot法分析显示,Mortalin蛋白在肝癌、癌旁和正常组织中相对表达量为2.58±0.21、0.22±0.09和0.05±0.02。肝癌组织中的Mortalin相对表达量明显高于癌旁和正常组织 (t=39.35,P<0.05;t=61.73,P <0.05)。见图1。
2.2 不同肝脏组织中各蛋白表达情况 在100例标本中,有77例肝癌组织和19例癌旁组织Mortalin蛋白呈高表达;10例正常肝组织中仅1例Mortalin蛋白呈高表达;肝癌组织中有52例Vimentin蛋白呈高表达;CD34主要在血管上皮细胞表达。统计结果显示,肝癌组织中高表达Mortalin的比率为77%(77/100)显著高于癌旁组织19%(19/100)和正常组织10%(1/10)(χ2=67.388,P <0.01;χ2=16.669,P<0.01)。见图2。
2.3 肝癌组织中Mortalin的表达与患者临床病理特征的关系 Mortalin的高表达与肝癌的Edmondson分级、TNM分期和肿瘤转移相关,而与性别、年龄、肿瘤大小和甲胎蛋白 (AFP)水平等无关。Mortalin在低分化的肝癌(Ⅲ+Ⅳ)中的表达明显高于中高分化的肝癌 (Ⅰ +Ⅱ)(χ2=4.272,P=0.039);Mortalin在TNMⅠ+Ⅱ期中的表达显著低于在Ⅲ+Ⅳ期中的表达 (χ2=8.188,P=0.004)。见图3。Mortalin在有淋巴结转移和血管侵犯中的表达显著高于无侵袭转移中的表达 (P<0.05)。见表1。

图1 癌和癌旁及正常肝组织中Mortalin的表达情况1:癌组织;2:癌旁组织;3:正常肝组织;A:Western blot法检测Mortalin蛋白的表达;B:Mortalin蛋白的相对表达量;C:qPCR法检测Mortalin mRNA的表达;D:Mortalin mRNA的相对表达量;与癌组织比较:*P<0.05
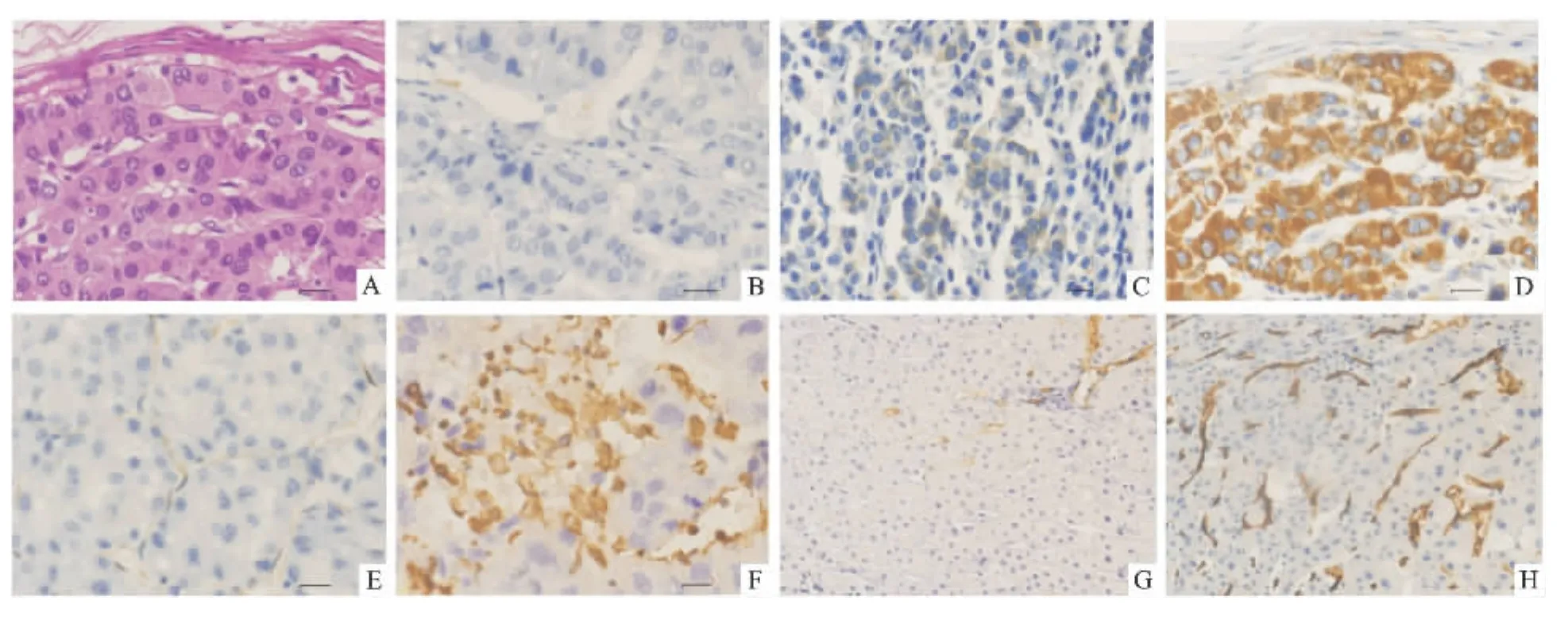
图2 癌组织HE染色和免疫组织化学染色
2.4 肝癌组织中Mortalin、Vimentin和MVD的表达 免疫组织化学染色检查显示,肝癌组织中高表达Vimentin的比率为52%(52/100)。相关性分析显示,肝癌组织中Mortalin的表达与Vimentin的表达存在正相关 (r=0.235,P=0.018)。通过使用CD34抗体染色血管发现,高表达Mortalin的肝癌组织有更高的MVD的趋势,但差异无统计学意义(39.4±42.5 vs 29.7±16.9,t=1.630,P=0.106)。
3 讨论

图3 Mortalin蛋白在正常肝组织和不同临床分期的癌组织中的表达
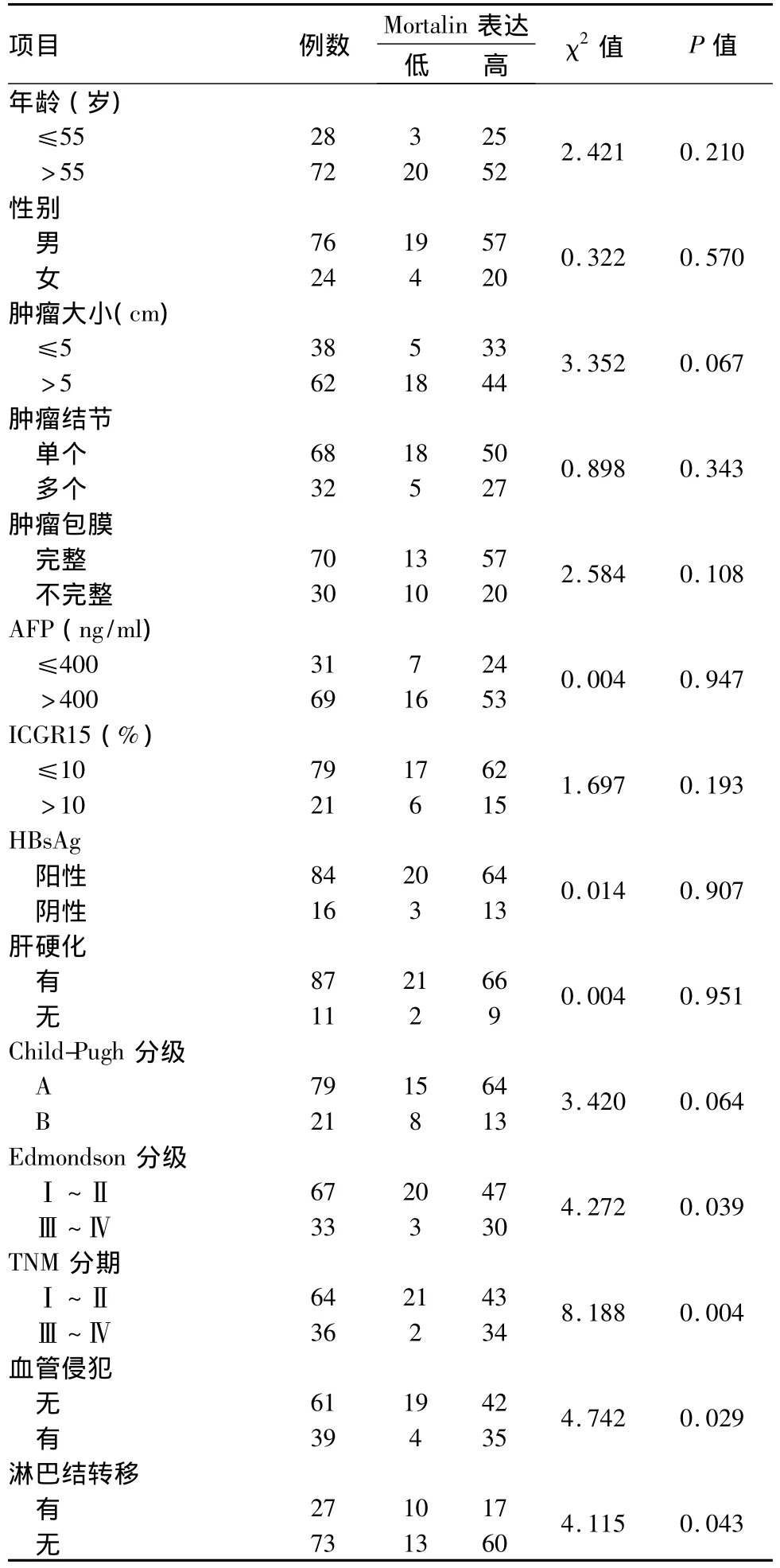
表1 癌组织中Mortalin的表达与临床病理因素之间的关系
肝癌是我国较常见的恶性肿瘤之一,肝癌根治术后患者5年生存率为35%,10年生存率仅为7.2%,肿瘤侵袭和转移是影响其生存率的主要因素[9]。在肿瘤侵袭和转移的过程中,血管形成和EMT扮演着重要的作用。肝癌是富血管性肿瘤,且微血管生长增加,肿瘤细胞得以不断的增殖和转移,通过抗CD34抗体使血管上皮着色,计算MVD[10];在EMT过程中,上皮细胞极性的丧失和间质特征的获得为主要特点。上皮细胞标志物E-cadherin的表达降低,使得细胞之间的连接减弱而间质细胞标志物Vimentin的表达升高,导致肿瘤细胞更容易发生转移[11-12]。
Xie et al[13]发现,在髓细胞性白血病中高表达的Mortalin被看作是一个潜在的治疗靶点。Dundas et al[14]研究结直肠癌发现Mortalin的高表达与患者预后不良关系密切。Yi et al[15]发现肝癌术后早期复发较无复发患者Mortalin的表达是增高的。由临床病理资料分析得出,肝癌中Mortalin的高表达与肿瘤的TNM分期及静脉侵润密切相关,但是Mortalin是否参与肝癌及其EMT的发生、发展,国内外鲜有报道。
为研究Mortalin的表达和肿瘤转移之间的关系,首先,通过免疫组织化学染色研究10例正常组织及100例肝癌和癌旁组织发现较其他组织,肝癌组织中Mortalin显著高表达,且Mortalin的表达水平与肿瘤Edmondson分级、TNM分期和肿瘤转移关系紧密。然后,对100例肝癌组织进行Mortalin、Vimentin和MVD相关性分析,发现肝癌组织中Mortalin的表达与Vimentin的表达有相关性,而高表达Mortalin的肝癌组织有更高的MVD的趋势,由此说明Mortalin不能促进肝癌血管形成,而在肝癌EMT的过程中起到促进作用和对肝癌的侵袭和转移有十分重要的意义。
[1]Wadhwa R,Kaul S C,Ikawa Y,et al.Identification of a novel member of mouse hsp70 family.Its association with cellular mortal phenotype[J].J Biol Chem,1993,268(9):6615-21.
[2]Wadhwa R,Takano S,Robert M,et al.Inactivation of tumor suppressor p53 by mot-2,a hsp70 family member[J].J Biol Chem,1998,273(45):29586-91.
[3]Kaula S C,Reddelb R R,Sugiharac T,et al.Inactivation of p53 and life span extension of human diploid fibroblasts by mot-2 [J].FEBS Lett,2000,474(2 -3):159 -64.
[4]Liu Y,Liu W,Song X D,et al.Effect of GRP75/mthsp70/PBP74/mortalin overexpression on intracellular ATP level,mitochondrial membrane potential and ROS accumulation following glucose deprivation in PC12 cells[J].Mol Cell Biochem,2005,268(1-2):45-51.
[5]Ma Z,Izumi H,Kanai M,et al.Mortalin controls centrosome duplication via modulating centrosomal localization of p53[J].Oncogene,2006,25(39):5377-90.
[6]Lu W J,Lee N P,Kaul S C,et al.Mortalin-p53 interaction in cancer cells is stress dependent and constitutes a selective target for cancer therapy[J].Cell Death Differ,2011,18(6):1046 -56.
[7]Chen M H,Yip G W,Tse G M,et al.Expression of basal keratins and vimentin in breast cancers of young women correlates with adverse pathologic parameters[J].Mod Pathol,2008,21(10):1183-91.
[8]Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1):1-8.
[9]陈 静,李建生,许戈良,等.蛋白质组学与肝细胞癌转移复发预测的研究进展[J].国际外科学杂志,2013,40(5):322-7.
[10]Kimura H,Nakajima T,Kagawa K,et al.Angiogenesis in hepatocellular carcinoma as evaluated by CD34 immunohistochemistry[J].Liver,1998,18(1):14 -9.
[11]Thiery J P.Epithelial-mesenchymal transitions in tumour progression[J].Nat Rev Cancer,2002,2(6):442 -54.
[12]Christiansen J J,Rajasekaran A K.Reassessing epithelial to mesenchymal transition as a prerequisite for carcinoma invasion and metastasis[J].Cancer Res,2006,66(17):8319 -26.
[13]Xie H,Hu Z,Chyna B,et al.Human mortalin(HSPA9):a candidate for the myeloid leukemia tumor suppressor gene on 5q31[J].Leukemia,2000,14(12):2128 -34.
[14]Dundas S R,Lawrie L C,Rooney P H,et al.Mortalin is over-expressed by colorectal adenocarcinomas and correlates with poor survival[J].J Pathol,2005,205(1):74 -81.
[15]Yi X,Luk J M,Lee N P,et al.Association of mortalin(HSPA9)with liver cancer metastasis and prediction for early tumor recurrence[J].Mol Cell Proteomics,2008,7(2):315 -25.
