猪流行性腹泻病毒TaqMan荧光定量RT—PCR检测方法的建立
2014-05-18刘自立董雅琴于美芳吴发兴邵卫星李晓成王树双
张 志,刘自立,董雅琴,于美芳,刘 爽,吴发兴,邵卫星,李晓成,王树双
(1.中国动物卫生与流行病学中心,山东 青岛 266032;2.云南农业大学,云南 昆明 650201)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是一种以猪腹泻、呕吐和脱水为主要特征的急性高度接触性肠道传染病[1],此病多发于冬季12月至来年2月寒冬季节,在夏季也可发生,尤其哺乳仔猪受害最严重。新生仔猪PED潜伏期为24~36小时。病猪表现呕吐、腹泻和脱水,年龄越小,症状越重,其病原是猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)。该病毒最早分离于比利时表现腹泻的猪群,并命名为类冠状病毒CV777株,而后英国、匈牙利、德国、加拿大、日本、韩国等相继报道本病的发生[2]。我国自上世纪80年代初开始陆续发生PED,特别是最近3年以来,PED已成为最重要的猪群疫病,不仅感染面广,而且发病率和死亡率都居高不下,给养猪业带来了巨大的经济损失[3-5]。鉴于PED和猪传染性胃肠炎在临床上很难区别,而且PEDV又难以在细胞上增殖和培养,所以,早期诊断对本病的防治具有极其重要的意义,因此建立一种快速,高灵敏度的诊断方法势在必行。PEDV属于冠状病毒科冠状病毒属,病毒粒子核酸为线性正股单链RNA,整个基因组长约28.6kb,含有4种结构蛋白:S蛋白(spike protein)、sM蛋白(small membrane protein)、M蛋白(membrane protein)和N蛋白(nucleoprotein)。其中N基因为核蛋白,特性比较保守和稳定,因此常作为检测PEDV的候选基因区域。本文利用荧光定量PCR具有准确定量、高敏感性和高特异性等优点,针对PEDV比较保守的N基因区域设计了一个TaqMan探针,建立了一套快速检测PEDV的荧光定量RT—PCR检测方法,并在实际应用中得以验证。
1 材料与方法
1.1 病毒
猪流行性腹泻病毒(DR13)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征(PRRSV)、猪圆环病毒2型(PCV2)、猪传染性胃肠炎(TGEV)均由本实验室保存。
1.2 仪器与试剂
质粒提取试剂盒购自Qiagen公司,Trizol购自invitrogen公司,pMD-18-T载体、One-step反转录试剂盒购自法连宝生物工程有限公司。检测用仪器主要有Bio-Rad荧光定量PCR仪和eppendorf核酸蛋白分析仪。
1.3 引物与探针
根据PEDV参考毒株JX088695的 N基因设计引物和TaqMan探针,目的片段 122bp。荧光探针序列为 PEDVP:5’-GTTGCCATTACCACGACTCCTGCTAC -3’(26846-26821),探针的5’端标记的荧光报告基团是FAM,3’端标记的荧光淬灭基团为TAMRA,上游和下游引物分别为PEDV-F:5’-CTTCCCAGCGTAGTTGAGATTGT-3’(26760-26782) 和 PEDV-R:5’-TTGCCTCTGTTGTTACTTGGAGAT - 3’(26881-26858),引物和探针均由大连宝生物工程有限公司合成。
1.4 病毒RNA提取
按照Trizol说明书从PEDV等病毒接种的细胞培养物或组织提取总RNA,于-70℃保存。
1.5 反应体系
荧光RT—PCR的反应采用一步法进行,用矩阵法对荧光定量PCR的引物浓度、探针浓度进行筛选优化,以得到最佳的荧光定量PCR反应条件。
1.6 标准品制备
将PEDV目的片段克隆到pMD18-T载体转化到DH5α中,摇菌提取质粒,经鉴定正确后,测定质粒OD260值,并换算质粒浓度(copies/μL),并放于-20℃备用。
1.7 标准曲线的建立
将质粒标准品10倍梯度稀释,从10-1到10-9,以此作为模板在荧光定量PCR仪上检测,得出各自的荧光曲线,仪器软件自动生成标准曲线。
1.8 敏感性试验
将阳性质粒10倍梯度稀释,从10-1到10-9,以此为模板进行荧光定量PCR和常规RT—PCR检测,比较二者将所能检测出的最低拷贝数以确定荧光定量PCR的灵敏度。
1.9 特异性试验
分别提取CSFV、PRRSV、PCV2和TGEV的病毒核酸,在荧光定量PCR仪上进行检测,观察PEDV荧光PCR是否可以同时检测到其他病毒,以确定其特异性。
1.10 重复性试验
对来自贵州、四川的表现腹泻症状的肠道组织样和猪流行性腹泻病毒细胞培养物分别用荧光定量RT—PCR方法进行批内重复性试验和批间重复性试验,批内试验时每个样品设置3个重复,批间试验在第1,2和3天对样品进行检测,检测结果用SPSS19.0软件进行统计学分析。
1.11 样品检测
对河北、广西、贵州、四川等地猪场送检的粪便和肠道病料进行处理,提取RNA,用建立的荧光定量RT—PCR进行检测,同时与常规PEDV 的RT—PCR方法进行比较。
2 结果
2.1 荧光定量RT—PCR反应条件的优化
综合考虑反应体积、反应成本和反应效率,最终将反应体系定位25μL,其中含有2×1 step Buffer 12.5μL,引物各1μL,探针0.5μL,RNA模板 3μL,酶混合物(含反转录酶和DNA聚合酶)1μL,RNase-Free H2O 6μL。引物、探针终浓度为0.4μmol/L、0.2μmol/L。扩增条件为:42℃反转录5 min;95℃预变性3 min;40个扩增循环(95℃15s、60℃ 30s)。
2.2 标准曲线建立
如图1A所示,模板浓度为2.61×108、2.61×107、2.61×106、2.61×105、2.61×104、2.61×103、2.61×102、2.61×101拷贝 /μL 的质粒标准品的荧光RT—PCR曲线。它们的循环阈值分别 为 14.65,16.31,19.17,22.14,26.56,30.17,33.23,35.27。将这些数据分析后生成标准曲线,详见图1B,其中,y轴为循环阈值,x轴为质粒样品的拷贝数。标准曲线的斜率为-3.171,截距为43.450,R2为0.990,E=106.7%。
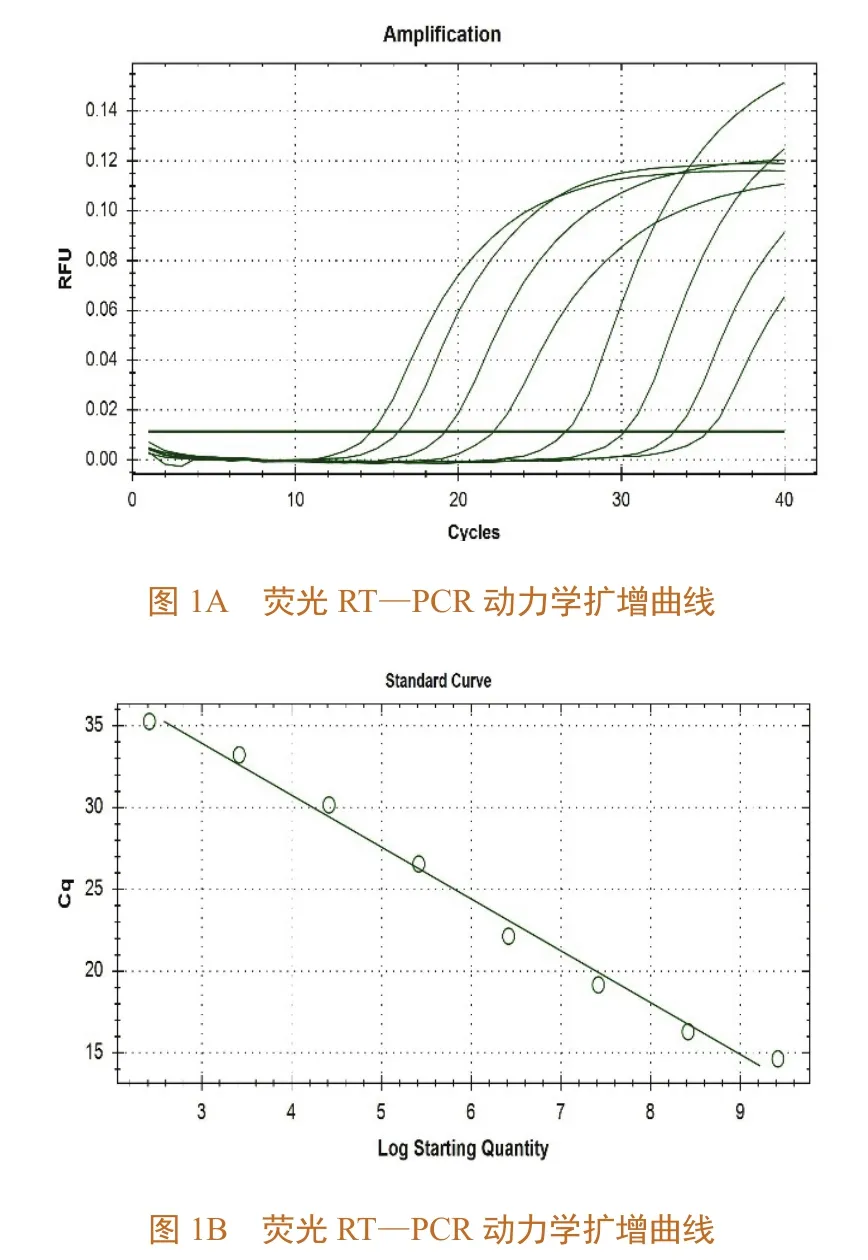
图1 标准品的荧光RT—PCR动力学扩增和斜率曲线
2.3 敏感性试验
如表2所示,荧光定量RT—PCR能检测出的模板最低浓度为2.61×101拷贝/μL,而常规RT—PCR(表1)的检测极限是2.61×104拷贝/μL,这说明荧光定量RT—PCR 的敏感性比常规RT—PCR 的敏感性高1000倍。

表1 荧光定量RT—PCR和普通RT—PCR的敏感性试验
2.4 特异性试验
分别用PEDV、CSFV、PRRSV、PCV2和TGEV等四种不同病毒分别提取核酸,并进行荧光定量RT—PCR,结果只有PEDV呈现明显的“S”形阳性扩增曲线,其余病毒均未扩增出(详见图2),表明建立的荧光定量RT—PCR试验方法具有良好的特异性。

图2 PEDV荧光定量RT—PCR方法的特异性试验
2.5 重复性试验
为证实PEDV的稳定性,对部分病料和疫苗分别进行了3批批内和批间的重复性试验,结果表明(表2),批内变异系数平均为0.84%±0.35,批间变异系数平均为1.55%±0.74,表明本检测方法的重复性良好。
2.6 现地样品检测
对地方猪场送检的43份粪便病料进行了荧光定量RT—PCR检测,同时与常规RT—PCR方法相比较,结果如表3。在43份待检病料中,荧光定量RT—PCR方法检出28份为阳性,常规RT—PCR 方法检出12份为阳性,这表明荧光定量RT—PCR检测的敏感性明显高于常规RT—PCR方法。其中,河北、贵州等多省份送检的病料中均可以检测到PEDV,也进一步说明PEDV的感染面已经非常广泛。
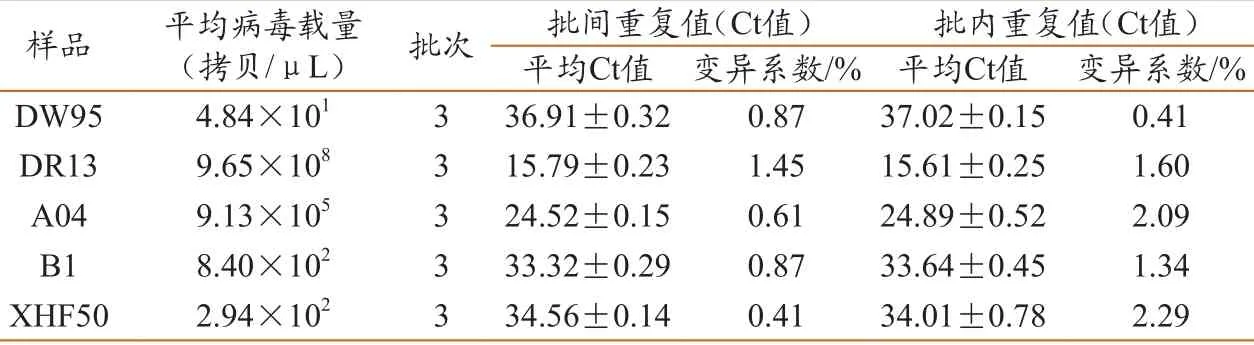
表2 荧光定量RT—PCR方法的批内重复性试验
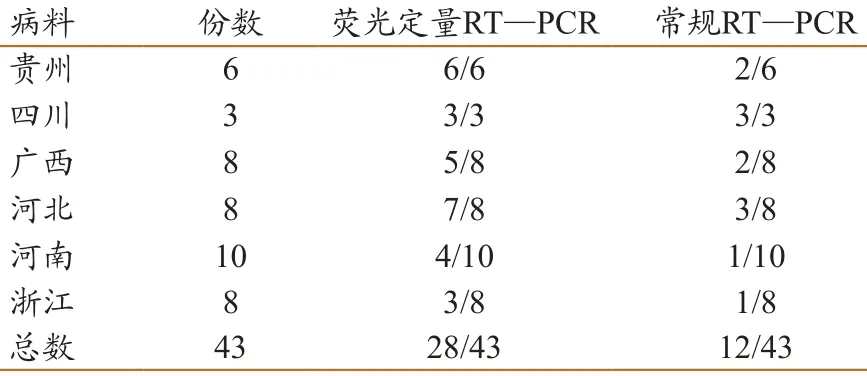
表3 现地样品的荧光定量RT—PCR 和常规 RT—PCR检测
3 讨论
荧光定量PCR是在PCR反应过程中不断连续监测荧光信号来测定特异性产物的量,并以此来推断目的基因的初始量,它综合了PCR技术、激光技术、荧光标记技术、数码显像技术等于一体,所以具有很高的灵敏度,逐渐成为动物疫病检测的必备方法。根据采用的荧光材料不同可以分为SYBR Green I染料法、TaqMan探针法、分子信标法等。SYBR Green I染料与任何双链DNA都能结合,易产生非特异性荧光,而TaqMan探针法对目的序列有较高特异性且与分子信标法相比设计简单,重复性好,因此被普遍使用。
PEDV的多种检测方法中,分子生物学方法已经成为最常用的方法,陆续建立了一些PEDV的RT—PCR、套式RT—PCR、与TGEV和A型轮状病毒等鉴别的多重RT—PCR等[6]。如Ishikawa[7]等根据S 基因序列设计了1对引物,成功地建立了诊断PEDV的RT—PCR方法。如Kubota 等[8]以M基因和N基因为靶基因建立了RT—PCR 方法来检测PEDV。韩国人Kim O等[9]建立了TGEV和PEDV的二联RT—PCR 诊断方法,可同时检测出100 TCID50/mL的TGEV和PEDV。我国Zhao等[10]建立了可以同时鉴别PEDV、TGEV、PCV2和A型轮状病毒的多重RT—PCR方法。但国内外鲜有PEDV荧光定量RT—PCR检测技术的报道。
本研究以N基因为靶基因成功建立了PEDV的TaqMan探针荧光定量RT—PCR 检测技术及时填补了这一病毒检测技术的空白,本方法可应用于细胞毒和现地病料中PEDV的检测,在病毒隐性感染、发病猪早期快速确诊和实时检测等方面发挥重要作用,为PEDV 感染、增殖规律的研究及病毒复制转录过程的研究奠定了重要基础。与常规RT—PCR相比,本方法的灵敏度更高,假阳性率低,不易污染,且扩增与检测同步完成,不需要对产物进行电泳,使得操作更加简便。
[1]Pensaert M B, de Bouck P.A new coronavirus-like particle associated with diarrhea in swine [J].Arch Virology, 1978, 58(3): 243-247.
[2]Park S J, Kim H K, Song D S, et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) fi eld isolates in Korea [J].Archives of virology, 2011, 156(4): 577-585.
[3]Li Zhili, Zhu Ling, Ma Jingyun, et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China [J].Virus genes, 2012, 45(1): 181-185.
[4]Zhang Qian, Hu Ruiming, Tang Xibiao, et al.Occurrence and investigation of enteric viral infections in pigs with diarrhea in China[J].Archives of virology, 2013, 158(8):1631-1636.
[5]Ge FF, Yang DQ, Ju HB, et al.Epidemiological survey of porcine epidemic diarrhea virus in swine farms in Shanghai,China [J].Archives of virology, 2013, 158(11):2227-2231.
[6]Ren X, Li P.Development of reverse transcription loopmediated isothermal amplif i cation for rapid detection of porcine epidemic diarrhea virus [J].Virus genes, 2011, 42(2):229-235.
[7]Ishikawa K, Sekiguchi H, Ogino T, et al.Direct and rapid detection of porcine epidemic diarrhea virus by RT—PCR[J].Journal of virological methods, 1997, 69(1/2): 191-195.
[8]Kubota S, Sasaki O, Amimoto K, et al.Detection of porcine epidemic diarrhea virus using polymerase chain reaction and comparison of the nucleocapsid protein genes among strains of the nucleocapsid genes among strains of the virus[J].Journal of Veterinary Medical Science, 1999, 61(7):827-830.
[9]Kim O, Choi C, Kim B, et al.Detection and differentiation of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus in clinical samples by multiplex RT—PCR[J].The Veterinary Record, 2000,146(22):637-640.
[10]Zhao J, Shi B J, Huang X G, et al.A multiplex RT—PCR assay for rapid and differential diagnosis of four porcine diarrhea associated viruses in field samples from pig farms in East China from 2010 to 2012[J]. Journal of virological methods, 2013, 194(1/2):107-112.
