禽副黏病毒4型荧光RT-PCR检测方法的建立
2014-05-18王静静刘华雷王英丽郑东霞赵云玲左媛媛于松梅王志亮
王静静,刘华雷,王英丽,郑东霞,赵云玲,吕 艳,左媛媛,于松梅,王志亮
(中国动物卫生与流行病学中心,山东 青岛 266032 )
禽副黏病毒(APMVs)在分类地位上属于副黏病毒科副黏病毒亚科禽腮腺炎病毒属(Avulavirus),其基因组为单股负链RNA,可感染多种禽类。目前的研究表明禽副黏病毒至少包括11个血清型,即APMV-1~APMV-11[1-2]。禽副黏病毒1型(APMV-1)也称为新城疫病毒(NDV),在所有禽副黏病毒中危害最为严重。禽副黏病毒4型(APMV-4)于1975年出现于香港地区的鸭群中[3-4],此后美国、韩国、比利时、新西兰等国家也监测到该病毒[4-7]。我国大陆地区于2012年首次报道发现APMV-4[8]。APMV-4主要感染雁形目鸟类[5]、家鸭、鸡和鹅[3,9-10]。蛋鸡感染APMV-4后白壳蛋产量增加,但产蛋量不受影响[11]。APMV-4基因组大小约为15054 nt,共编码6种蛋白:核衣壳蛋白(N)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶蛋白(HN)和大聚合酶蛋白(L)。鉴于我国在2012年首次出现APMV-4,因此建立一种APMV-4的快速、灵敏和高效检测技术在该病毒的早期发现和快速诊断中意义重大。本研究根据APMV-4的基因组序列,分别设计了针对APMV-4的特异性引物和探针,建立了APMV-4荧光RT-PCR检测方法,初步应用表明本方法特异性强、敏感性高,可用于APMV-4的快速检测。
1 材料与方法
1.1 病毒
Ⅰ类、Ⅱ类新城疫病毒(NDV)、H5、H9亚型禽流感病毒(AIV)、传染性支气管炎病毒(IBV)、减蛋综合征病毒(EDSV)和APMV-4分离株APMV4/Duck/China/G302/2012均为本实验室保存。
1.2 主要分子生物学试剂
High Pure Viral RNA Kit购 自 Roche公 司;One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)、PrimeScriptTMOne Step RT-PCR Kit Ver.2购自Takara公司。
1.3 引物与探针的设计合成
根据APMV4/duck/China/G302/2012(GenBank序列号:KC439346)及GenBank上禽副黏病毒4型基因序列,针对相对保守区域,利用Primer Premier 5.0软件分别设计了APMV-4的特异性荧光RT-PCR引物和探针,引物、探针的名称和序列见表1。引物和探针均由宝生物工程(大连)有限公司合成。

表1 荧光RT-PCR引物和探针
1.4 RNA提取
取新鲜繁殖的病毒鸡胚尿囊液,采用Roche公司生产的High Pure Viral RNA Kit提取病毒分离株RNA。提取的RNA立即用于RT-PCR扩增或者于-80℃保存。
1.5 荧光RT-PCR
以提取的病毒RNA为模板,采用Takara公司 One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time) 配置荧光RT-PCR反应体系,并于LightCycler定量PCR仪进行RT-PCR反应。反应条件为:42℃ 5min;95℃ 10s;95℃ 5s,60℃30s,进行50个循环。
1.6 特异性试验
分别提取NDV(Ⅰ、Ⅱ类)、AIV(H5、H9亚型)、IBV、EDSV以及APMV-4的RNA,进行荧光RT-PCR扩增,并以DEPC处理水作为阴性对照。
1.7 灵敏度试验
用APMV-4的RNA做10倍系列稀释,进行荧光RT-PCR扩增。
1.8 常规RT-PCR
采用APMV-4鉴定引物,利用Takara公司PrimeScriptTMOne Step RT-PCR Kit Ver.2进行常规RT-PCR 扩 增。 上 游引 物 M1:5´-CAACACTTA CGGGTTTATC-3´;下游引物 M2:5´-CTTCTCGC AGTCTATCTTCT-3´,扩增片段长度为331 bp。反应条件为:50℃反转录30min;94℃预变性3min;94℃ 30s,52℃ 30s,72℃ 30s,进行 35个循环;72℃延伸7min。扩增产物用1.5%的琼脂糖凝胶电泳鉴定。
2 结果
2.1 体系优化
通过对TaqMan探针浓度、引物浓度、退火温度和时间进行优化后,确定荧光RT-PCR体系的最佳探针浓度为0.2µM、引物浓度为0.4µM、退火温度和时间为60℃ 30s。用优化好的反应体系扩增APMV-4 RNA,并用LightCycler 480软件进行分析,其扩增曲线呈典型的“S”型(图2)。
2.2 标准曲线的建立
取5个不同稀释度的RNA标准品(浓度分别为106~102EID50)进行荧光RT-PCR反应,每个稀释度的标准品做3个重复。以获得的Cp值为y轴,对应标准品的EID50的对数为x轴,制作标准曲线(图1)。标准方程为y = -2.931x + 40.50,相关系数为0.999。

图1 荧光RT-PCR检测RNA的标准曲线
2.3 特异性试验
分别取APMV-4、NDV(Ⅰ、Ⅱ类)、AIV(H5、H9亚型)、IBV、EDSV的RNA,以及DEPC处理水(阴性对照)进行荧光RT-PCR扩增,发现除APMV-4出现特异性扩增曲线外,其余病毒及阴性对照均没有扩增曲线(图2)。
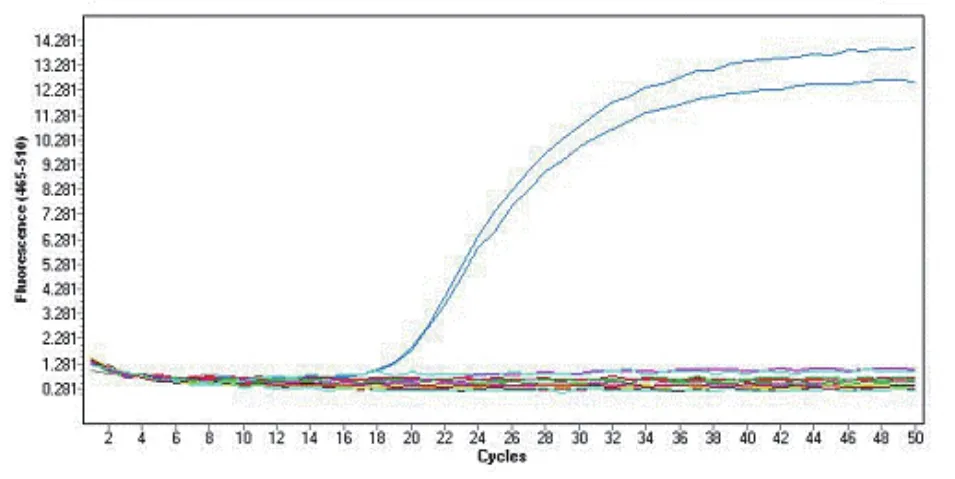
图2 荧光RT-PCR特异性试验结果
2.4 灵敏度试验
取浓度为105~10-1EID50的RNA为模板,进行荧光RT-PCR扩增,发现APMV-4的检测下限为1 EID50(图 3)。
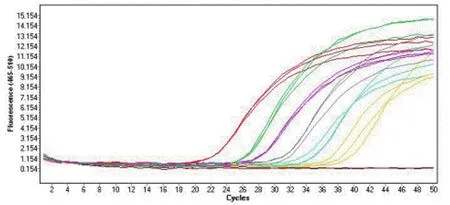
图3 荧光RT-PCR灵敏度试验结果
2.5 与常规RT-PCR敏感性比较
以105~1 EID50的APMV-4 RNA为模板,分别用常规RT-PCR和荧光RT-PCR扩增,发现常规RT-PCR对APMV-4的检测下限为102EID50(图4),荧光RT-PCR的检测下限为1 EID50,比常规RTPCR的敏感性高100倍左右。
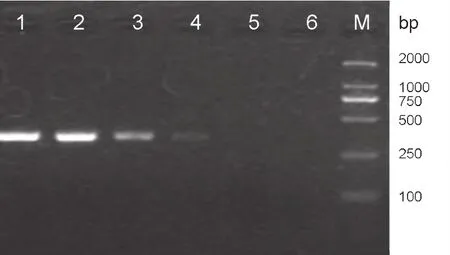
图4 常规RT-PCR敏感性检测结果
3 讨论
目前,国外的监测数据显示,已从鸭和鹅等水禽体内分离到APMV-4[4],而在国内,只是在南方个别省市的监测样品中分离到该病毒。研究显示,APMV-4可在牛肾细胞(MDBK)、幼仓鼠肾传代细胞(BHK21)、鸭胚细胞、非洲绿猴肾细胞(Vero)、鸡胚成纤维细胞(DF-1)和鹌鹑纤维肉瘤细胞(QT35)等多种细胞系上有效复制,说明该病毒的宿主范围十分广泛[12]。然而,目前人们对其病原学、发病禽类的临床表现仍不甚明了,而且,该病在家禽中发病率低,感染禽类的临床症状和剖检病变不明显[13],仅凭肉眼难以判断,容易出现误诊。目前实验室常用的APMV-4检测方法包括病原分离、RT-PCR试验和血清学试验(如ELISA)等[5,14],然而,以上方法操作相对复杂、检测周期较长,不适用于大规模的临床样品检测。因此,建立可用于APMV-4快速、灵敏、高效的检测技术十分必要。
与普通RT-PCR方法相比,荧光RT-PCR操作简便、检测时间短,应用该方法检测APMV-4,从RNA提取到获得检测结果可在1.5h内完成,并且在检测过程中可以进行实时监控。荧光RT-PCR方法在结果判定时不需要进行凝胶电泳,不使用溴化乙锭,保障了试验人员的安全,而且,该方法使用仪器收集荧光判定检测结果,也避免了主观因素的影响。
本实验中,根据APMV-4基因保守区域设计特异性引物和探针,在进行荧光RT-PCR检测时,引物和探针的双重保障使得该方法特异性更强,检测结果更准确。而且,本实验应用荧光RT-PCR检测APMV-4的下限为1 EID50,比常规RT-PCR的敏感性高100倍左右。实验证明应用荧光RT-PCR方法检测APMV-4是可行的,该方法适用于临床样本的快速诊断。
荧光RT-PCR也有不足之处,由于其运用了封闭的检测系统,减少了扩增后的电泳检测步骤,因而无法监测扩增产物的大小[15],而且APMV-4荧光RT-PCR试剂盒和检测探针的成本较高,也限制了其广泛应用于大规模的流行病学调查。
[1]Miller P J, Afonso C L, Spackman E, et al.Evidence for a new avian paramyxovirus serotype 10 detected in rockhopper penguins from the Falkland Islands[J].J Virol, 2010, 84(21):11496-11504.
[2]Briand F X, Henry A, Massin P, et al.Complete genome sequence of a novel avian paramyxovirus[J].J Virol, 2012, 86(14):7710.
[3]Shortridge K F, Alexander D J.Incidence and preliminary characterisation of a hitherto unreported, serologically distinct,avian paramyxovirus isolated in Hong Kong[J].Res Vet Sci,1978, 25(1):128-130.
[4]Alexander D J,Aymard M,Kessler N, et al.Antigenic and structural relationships between avian paramyxoviruses isolated from ducks in Hong Kong and Mississippi,U.S.A[J].J Gen Virol,1979,44(3):839-842.
[5]Stanislawek W L,Wilks C R,Meers J,et al.Avian paramyxoviruses and influenza viruses isolated from mallard ducks (Anas platyrhynchos) in New Zealand[J].Arch Virol,2002, 147(7):1287-1302.
[6]Nayak B, Nayak S, Paldurai A, et al.Evaluation of the genetic diversity of avian paramyxovirus type 4[J].Virus Res,2013, 171(1):103-110.
[7]Choi K S, Kim J Y, Kye S J, et al.Genetic diversity of avian paramyxovirus type 4 isolates from wild ducks in Korea from 2006 to 2011[J].Virus Genes, 2013, 46(2):302-308.
[8]Wang K C, Chen G Q, Jiang W M, et al.Complete genome sequence of a hemagglutination-negative avian paramyxovirus type 4 isolated from China[J].Genome Announc, 2013, 1(2):e0004513.
[9]Turek R, Gresikova M, Tumova B.Isolation of inf l uenza A virus and paramyxoviruses from sentinel domestic ducks[J].Acta Virol, 1984, 28(2):156-158.
[10]Shortridge K F, Alexander D J, Hu L Y, et al.Isolation of Newcastle disease virus from Phasianidae birds in Hong Kong[J].J Comp Pathol, 1978, 88(4):633-636.
[11]Alexander D J.Avian paramyxoviruses 2-9[A].// Saif YM.Diseases of Poultry[M]11th ed.Iowa State University Press,Ames, 2003:88-92.
[12]Nayak B, Kumar S, Collins P L, et al.Molecular characterization and complete genome sequence of avian paramyxovirus type 4 prototype strain duck/Hong Kong/D3/75[J].Virol J, 2008, 5:124.
[13]Warke A, Stallknecht D, Williams S M, et al.Comparative study on the pathogenicity and immunogenicity of wild bird isolates of avian paramyxovirus 2, 4, and 6 in chickens[J].Avian Pathol, 2008, 37(4):429-434.
[14]van Boheemen S, Bestebroer T M, Verhagen J H, et al.A family-wide RT-PCR assay for detection of paramyxoviruses and application to a large-scale surveillance study[J].PLoS One, 2012, 7(4):e34961.
[15]殷进方, 吴志鹏, 江灿芬, 等.猪瘟病毒的实时荧光RTPCR检测[J].中国畜牧兽医, 2009, 36(10):142-144.
