响应面分析法优化枸杞多糖的提取工艺
2014-05-17李丹丹吴茂玉朱风涛马晓燕
李丹丹 吴茂玉 宋 烨 朱风涛 马晓燕
(1.齐鲁工业大学食品与生物工程学院,山东济南250353;
2.中华全国供销合作总社济南果品研究院,山东济南250014)
枸杞(Lycium barbarumL.)是茄科枸杞属的多分枝灌木植物,主要产于我国新疆、青海、宁夏等地,国外主要分布在日本、朝鲜、欧洲及北美等地。枸杞含有丰富的多糖、脂肪、蛋白质、游离氨基酸及维生素等,特别是类胡萝卜素含量很高[1]。研究表明,枸杞具有滋肝养肾、明目的功效[2]。在枸杞众多功效成分中,对枸杞多糖(Lycium Barbarum Polysaccharides,LBP)的研究最为热门,近代研究发现,枸杞多糖具有增强机体免疫力、抗肿瘤、防衰老、增加造血功能等活性功能[3]。因此提取枸杞多糖对开发和利用枸杞资源有重要的意义。
本文就提取中影响枸杞多糖得率的几个重要因素做了系统研究,并运用响应面分析(Response Surfaceanalysis,RSA)法[4]对枸杞多糖的提取条件进行了优化。用Box-Behnken的中心组合实验设计,对实验数据进行分析,对拟合数学模型进行了较为详细的描述,得到了枸杞多糖提取的最佳条件。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
干制枸杞,购买于新疆中宁县。
1.1.2 实验试剂
葡萄糖,硫酸,苯酚,酒石酸钾钠,无水亚硫酸钠,氢氧化钠,3,5-二硝基水杨酸等,以上试剂均为分析纯。
1.2 仪器和设备
数显式电热恒温水浴锅,购于上海博迅实业有限公司医疗设备厂;万能粉碎机,购于天津市泰斯特仪器有限公司;TU180紫外可见分光光度计,购于北京普析通用仪器有限公司;
SHB-Ⅲ循环水式真空泵,购于郑州长城科工贸有限公司;
R-3旋转蒸发仪,购于瑞士。
1.3 实验方法
1.3.1 热水浸提枸杞多糖的工艺流程
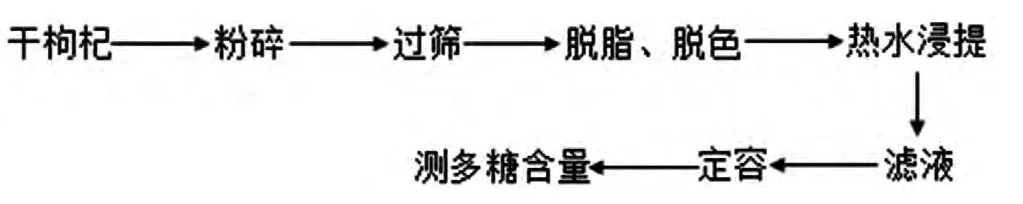
图1 热水浸提LBP的工艺流程Fig.1 The process of hotwater extract LBP
1.3.2 标准曲线的绘制
总糖标准曲线的绘制:采用苯酚硫酸法[5]。用分析天平精确称取10mg干燥恒重的无水葡萄糖,溶解定容100mL配制成浓度为100μg/mL的葡萄糖标准液备用。分别移取 0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL葡萄糖标准溶液置于编号为 0、1、2、3、4、5、6的试管中,其中0号管为空白对照。向各试管加入蒸馏水达到液体总量为2.0mL,分别加入1.0mL 6%苯酚,摇匀后立即加入5.0mL浓硫酸,室温放置15min后沸水浴30min,冷却后在490nm波长处测定吸光值,制作标准曲线。
还原糖标准曲线的绘制:采用3,5-二硝基水杨酸法(DNS法)[6]。
DNS溶液的配制:称取酒石酸钾钠182g,用500mL蒸馏水溶解,水浴加热(不超过50℃),在热溶液的环境下加入6.3g 3,5-二硝基水杨酸、2.1g NaOH、5.0g重结晶酚、5.0g无水Na2SO3,不停地搅拌至充分溶解,冷却后用蒸馏水定容于1L容量瓶中,备用。
还原糖标准曲线的绘制:用分析天平精确称取100mg干燥且恒重的无水萄糖,蒸馏水定容于100mL容量瓶中,配成浓度为1mg/mL的标准液。精密移取 0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL标准液分别置于编号为 0、1、2、3、4、5、6的25mL容量瓶中,其中0号为空白对照,用蒸馏水补至2.0mL。然后分别加入DNS试剂1.5mL,摇匀,放入沸水浴中加热5min,立刻用流水冷却,定容,摇匀,2min后于540nm波长处测定吸光值,绘制出标准曲线。
1.3.3 枸杞多糖得率的计算
取一定体积的多糖浸提液并用蒸馏水稀释到标准曲线的浓度范围内,按照1.3.2的方法进行显色,根据标准曲线分别计算总糖、还原糖的量和多糖含量。

式中:枸杞干粉的质量,g。
1.3.4 枸杞多糖最佳提取工艺条件的确定
通过单因素试验结果分析,选择料液比、浸提温度、浸提时间为试验因素,以多糖得率为衡量指标,对影响多糖得率的因素进行了Box-Behnken试验,运用Design Expert6.0软件进行响应面分析,优化得到最佳提取工艺条件。
2 结果与分析
2.1 提取枸杞多糖的单因素试验
2.1.1 料液比对枸杞多糖得率的影响
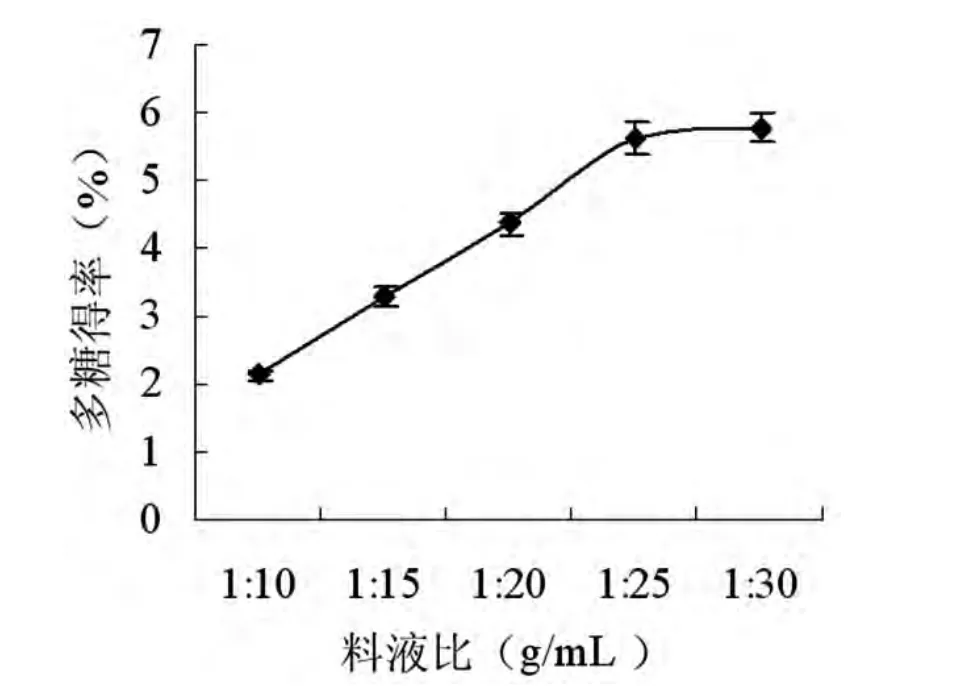
图2 料液比对枸杞多糖得率的影响Fig.2 Effects of solid-liquid ratio on the yield of LBP
称取一定质量的枸杞粉,分别设计料液比为1:10、1:15、1:20、1:25、1:30,单位为 g/mL,在某个温度下提取一定的时间,不同料液比下的枸杞多糖得率如图2所示。
由图2可以看出,在其他条件一定的情况下,随着料液比的减小,枸杞多糖的得率逐渐增大并且呈明显的上升趋势。当料液比增加到1:30时,枸杞多糖的得率达到最大值,但此时的得率与1:25条件下的得率相差很小,基本上呈持平状态,可知,当料液比超过1:25时,料液比的减小对枸杞多糖得率的影响不明显,因此从经济的角度考虑,料液比选择1:25较为适宜。
2.1.2 浸提温度对枸杞多糖得率的影响
称取一定质量的枸杞粉末,按料液比为1:25添加蒸馏水,分别于 50、60、70、80、90、100℃下浸提一定的时间,不同反应温度下的枸杞多糖的得率如图3所示。
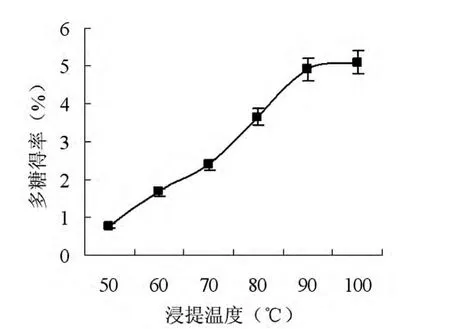
图3 浸提温度对枸杞多糖得率的影响Fig.3 Effects of extraction tem perature on the yield of LBP
由图3可知,温度对枸杞多糖的得率影响较大,随着温度的不断上升,枸杞多糖的得率也在不断增加。反应温度为100℃时多糖得率达到实验最大值,但相比于90℃时的得率而言增长空间较小,这可能是高温导致了多糖的降解,从而降低了多糖的浸出率[7]。因此,多糖浸出的适宜温度为90℃。
2.1.3 浸提时间对枸杞多糖得率的影响
称取一定质量的枸杞粉末,按料液比为1:25添加蒸馏水,分别于90℃下水浴加热浸提0.5、1、1.5、2、2.5、3h,多糖得率随着反应时间的变化曲线如图4所示。由图可知,随着反应时间的延长,多糖的得率呈现急剧增加的趋势,当时间达到2.5h时曲线逐渐趋于平衡。可见加热浸提2.5h以后,多糖的得率变化不明显,这可能是由于长时间的加热引起了多糖的降解,从而使得多糖得率下降[8]。所以综合考虑,选择热水浸提时间为2.5h。
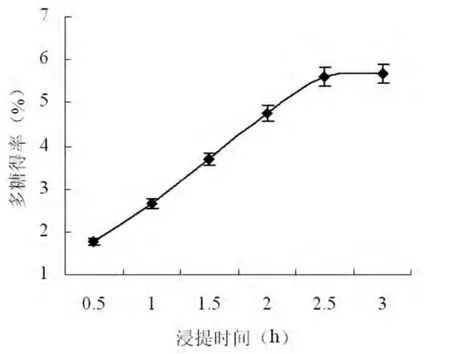
图4 浸提时间对枸杞多糖得率的影响Fig.4 Effects of extraction time on the yield of LBP
2.2 采用响应面分析法对枸杞多糖提取工艺的优化
2.2.1 响应面分析因素水平的选取
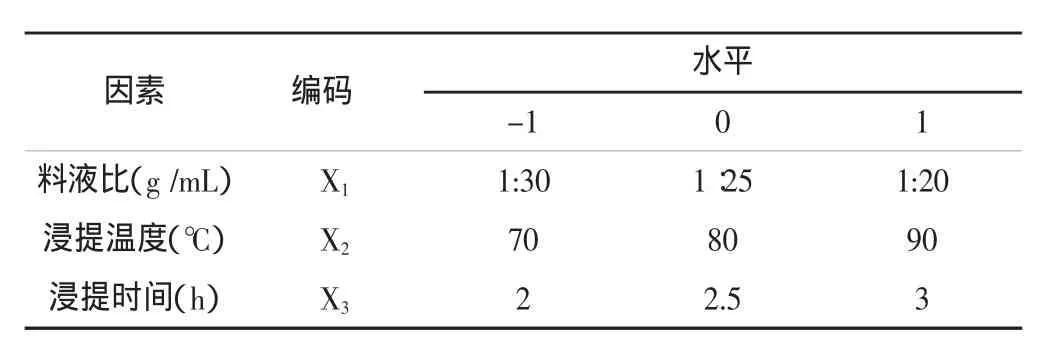
表1 试验设计因素与水平取值Tab.1 Code and level of variables chosen for the trials
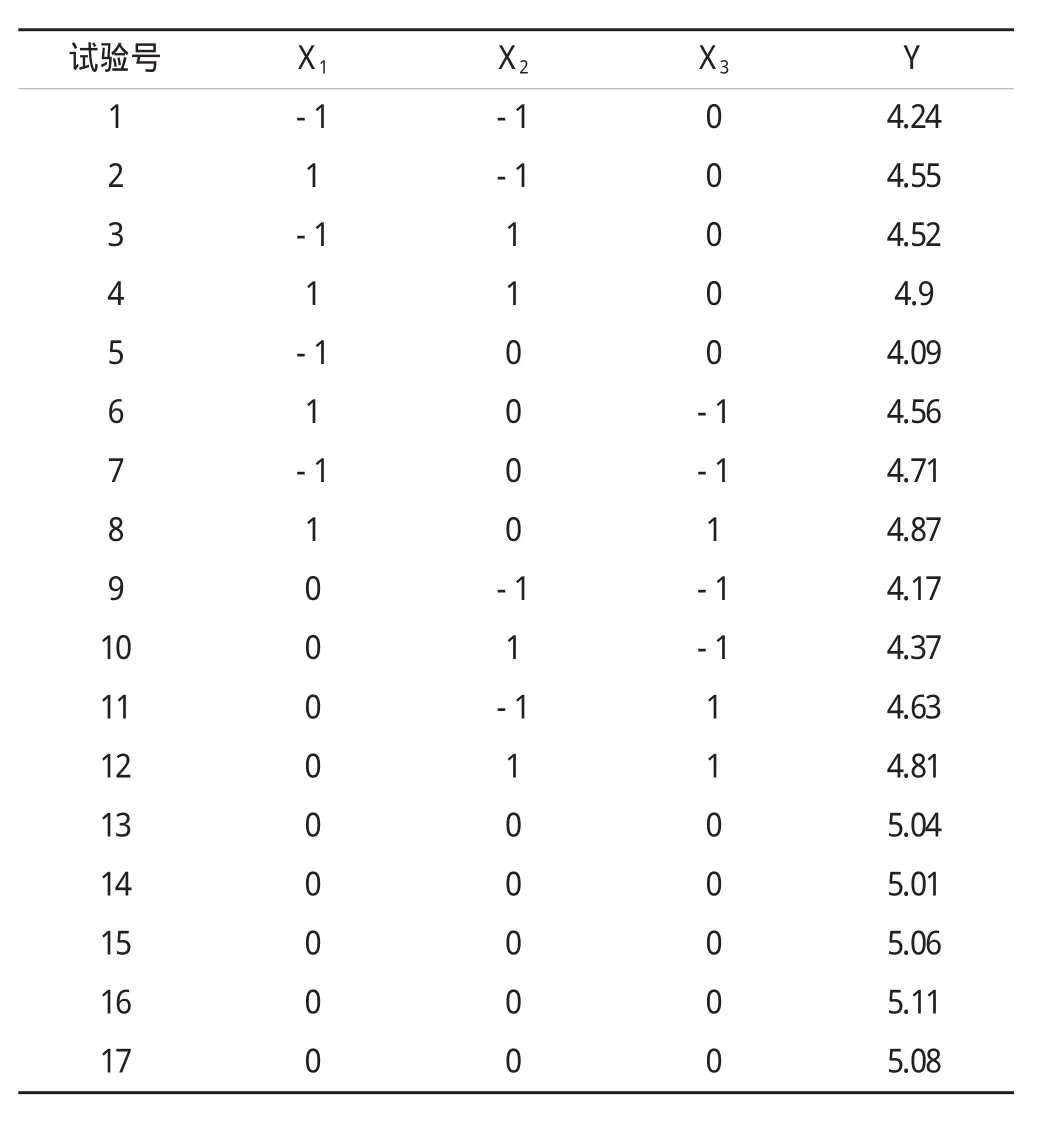
表2 Box-Behnken实验设计及响应值Tab.2 Box-Behnken experimental design arrangement and responses

表3 回归模型方差分析Tab.3 Analysis of variance(ANOVA)for regression equation for liquefaction process
根据的Box-Behnken试验设计原理,结合单因素试验的结果,选取料液比(X1)、浸提温度(X2)、浸提时间(X3)为考察因素,用 -1、0、1来表示低、中、高三水平,进行三因素三水平响应面优化试验,响应面试验设计因素与水平取值见表1。
2.2.2 响应面分析实验设计方案及结果
以上述因素为自变量,以多糖得率(Y)为响应值,进行响应面分析试验,试验设计及试验结果见表2。
利用Design Expert6.0软件对表2中的结果进行回归分析,对各因素回归拟合后,得到多糖得率对料液比(X1)、浸提温度(X2)、浸提时间(X3)的 3元 2次回归方程为:
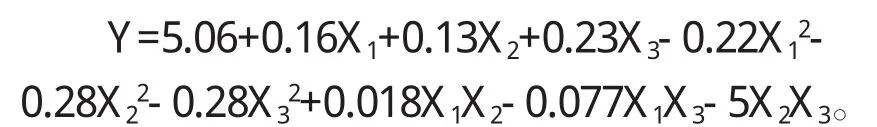
对回归方程进行方差分析和显著性检验结果如表3所示。从表3可知,回归项F值=97.21,P<0.0001,说明所选择模型极显著。表中的X1、X2、X3、X12、X22、X32、X1X3的 Pr>F值均小于 0.0001,说明这些均是极显著的模型项。失拟项F值为1.93,说明失拟项和纯误差的差异不显著,表明该二次回归模型能够较显著拟合料液比、浸提温度、浸提时间对枸杞多糖得率的影响。回归模型的决定系数R2=0.9921,说明响应值的变化有99.21%来自于所选变量,因此回归方程可以很好地描述各因素与响应值之间的关真实关系,可以利用该回归方程确定最佳提取条件。
2.2.3 各因素间的交互作用
根据以上回归方程,利用Design Expert6.0软件做不同因素间的响应面分析图和等高线图,如图5、图6、图7所示。该图组可直观地反映各因素及其交互作用对多糖得率的影响结果。其中等高线的形状可以反映两因素间交互作用的强弱,椭圆形表示两因素间交互作用较强,圆形则相反[9,10]。
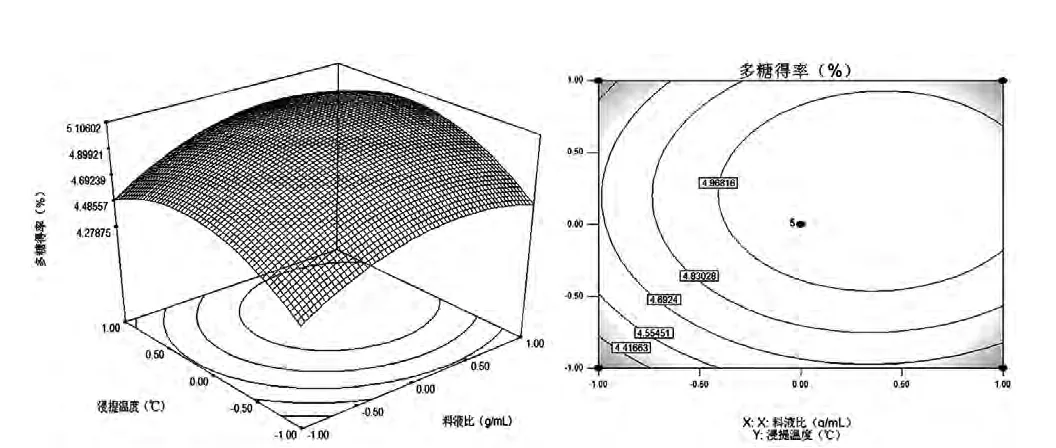
图5 料液比与浸提温度对枸杞多糖得率影响的响应面图和等高线图Fig.5 Response surface plot and contour plot of the effects of solid-liquid ratio and extracting tem perature on the yield of LBP
从图5~7可以直观地看出各因素的交互作用对响应值的影响,确定最佳因素水平范围。根据Box-Behnken的中心组合试验,对回归方程求一阶偏导方程等于零[11],整理得响应值最大时,X1=0.372,X2=0.12,X3=-0.02,对三种影响因素分别作如下变换:X1=(z-25)/5、X2=(T-80)/10、X3=(t-2.5)/0.5,所以对应的提取枸杞多糖的工艺条件为:料液比1:26.86,浸提温度81.2℃,浸提时间为2.51h。但考虑到实际操作的便利性,将提取枸杞多糖的最佳工艺条件修正为料液比1:27,浸提温度81℃,浸提时间为2.5h。并验证此条件下的枸杞多糖得率为5.03%,与模型预测值比较接近,说明用响应面法优化提取枸杞多糖的工艺参数可靠。

图6 料液比与浸提时间对枸杞多糖得率影响的响应面图和等高线图Fig.6 Response surface plot and contour plot of the effects of solid-liquid ratio and extracting time on the yield of LBP
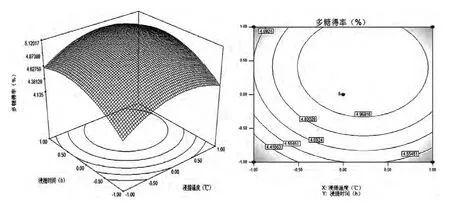
图7 浸提温度与浸提时间对枸杞多糖得率影响的响应面图和等高线图Fig.7 Response surface plot and contour plot of the effects of the extracting tem perature and time on the yield of LBP
3 结论
通过单因素实验设计,以及在此基础上通过设计3因素3水平响应面分析法实验,最终确定出枸杞多糖的提取最佳工艺参数:料液比1:27g/mL、浸提温度81℃、提取时间2.5h。在此工艺条件下提取的枸杞得率较高,实际得率可达5.03%。
[1]霍超,徐桂花.枸杞生理功效和活性成分的研究进展[J].中国食物与营养,2007,11:50-51.
[2]Harunobu A,Norman RF.A review of botanical characteristics,phytochemistry,clinical relevance in efficacy and safety of Lycium barbarum fruit(Goji)[J].Food Research International,2011(44):1702-1717.
[3]刘锡建,肖稳发,曹俭,等.枸杞多糖的研究进展[J].上海工程技术大学学报,2008,22(4):299-301.
[4]慕运动.响应面方法及其在食品工业中的应用 [J].郑州工程学院学报,2001,22(3):91-94.
[5]刘晓涵,陈永刚,林励,等.蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J].食品科技,2009,34(9):270-272.
[6]张惟杰.糖类复合物生化研究技术 [M].杭州:浙江大学出版社,1994.
[7]戴军.杜氏盐藻多糖的提取,分离分析及其生物活性的研究[D].无锡:江南大学,2007.
[8]赵鹏.款冬花多糖提取纯化工艺研究及结构鉴定[D].西安:西北大学,2010.
[9]万俊,蒋爱民,曲直,等.响应面法优化Camembert干酪加工工艺[J].现代食品科技,2012,28(7):840-844.
[10]Xu H,Sun L,ShiY,etal.Optimization of cultivation conditions for extracellular polysaccharide andmycelium biomass by Morchella esculenta As51620[J].Biochemical Engineering Journal,2008,39(1):66-73.
[11]刘军海,任惠兰,官波,等.响应面分析法优化白术多糖提取工艺[J].中成药,2008,30(5):667-670.
