鹅毛竹叶提取物抗氧化及酪氨酸酶抑制活性的研究
2014-05-16倪勤学许光治高前欣张有做
张 蕾,王 姝,倪勤学,许光治,高前欣,张有做*
(1. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;
3. 浙江农林大学农业与食品科学学院,浙江 临安 311300;4. 浙江省农产品品质改良技术研究重点实验室,浙江 临安 311300)
鹅毛竹叶提取物抗氧化及酪氨酸酶抑制活性的研究
张 蕾1,2,王 姝3,4,倪勤学3,4,许光治3,4,高前欣3,4,张有做3,4*
(1. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;
3. 浙江农林大学农业与食品科学学院,浙江 临安 311300;4. 浙江省农产品品质改良技术研究重点实验室,浙江 临安 311300)
采用Folin试剂还原比色法、硝酸铝—亚硝酸钠比色法和香草醛—冰醋酸比色法测定鹅毛竹叶甲醇提取物及不同极性部位中总酚、总黄酮和三萜的含量,采用DPPH法、ABTS法、FRAP法评价各提取物的抗氧化能力及还原能力,同时采用酪氨酸酶催化氧化左旋多巴(L-DOPA)速率法体外测定酪氨酸酶活力。结果表明:鹅毛竹(Shibataea chinensis)叶乙酸乙酯相的总酚、总黄酮及三萜的含量最高,分别为(28.63±0.19)%、(23.74±0.17)%和(15.27 ±0.67)%;该相在不同抗氧化体系中的抗氧化活性最强,同时该相抑制酪氨酸酶的活性也最强,其半抑制浓度为3.29 mg/mL;鹅毛竹叶醇提物及其不同极相部位的总黄酮含量与还原力和DPPH、ABTS自由基的清除能力呈正相关,相关系数分别为0.947 0、0.900 1和0.965 3,表明总黄酮是鹅毛竹叶提取物抗氧化活性的主要成分;总酚含量与酪氨酸酶抑制活性呈正相关,相关系数达到0.991 0,表明总酚是鹅毛竹叶提取物抑制酪氨酸酶活性的主要成分;鹅毛竹叶乙酸乙酯相对酪氨酸酶的抑制作用及抗氧化活性最强,其对酪氨酸酶抑制机制为可逆的竞争性抑制,其抑制常数为27.49 mg/mL。
鹅毛竹;竹叶;提取;抗氧化;酪氨酸酶;抑制类型
竹子是非常有利用价值的植物之一,属于禾本科竹亚科,是多年生的常绿植物。竹叶里含有丰富的次生代谢物,除纤维素、半纤维素、糖类等物质外,还含有许多对人体有益的活性物质,如类黄酮、酚酸类、氨基酸肽类、蒽醌类、萜类内酯等[1~2]。这些成分具有显著的抗氧化[3]、抗衰老[4]、抗菌[5]、类SOD活性[6]、阻断亚硝化反应[7]等生理活性。而有关酪氨酸酶活性抑制的报道较少,最早由程科军等[8]在苦竹笋中分离得一个具有抑制酪氨酸酶活性的氰苷化合物;张永兵等[9]在阔叶箬竹竹叶提取物中分离得具有抑制酪氨酸酶活性的化合物——对羟基肉桂酸乙酯。在我国,竹子品种繁多,分布广泛,竹叶资源是一种量大而且廉价的林业潜在资源,但是经过化学成分分析的竹种不到20种,仅仅占我国竹种数量的4%左右[10],而且以往的研究主要集中在刚竹属的竹种上。倭竹属鹅毛竹(Shibataea chinensis)由于秆形矮小,被归为地被竹种,具有开发成叶用竹林的潜在优势,课题组前期工作比较了6种地被竹种的有效成分含量和抗氧化性能,发现鹅毛竹具有显著强于其他竹种的抗氧化性能,具有进一步研究的潜力[11]。
本研究对鹅毛竹甲醇提取物及其不同极性部位中的总酚、总黄酮和三萜含量进行了测定,并通过清除DPPH·、ABTS+自由基和还原铁离子的能力评价了其抗氧化能力,同时对酪氨酸酶活性的抑制作用也进行了初步研究,以期为鹅毛竹资源在食品、化妆品、医药和保健领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
样品叶采集:鹅毛竹于2011年9月采自浙江省临安市浙江农林大学的翠竹园竹种质资源库。
主要试剂:酪氨酸酶、DPPH(2,2’-二苯基-1-苦味酰苯肼)、ABTS+购自Sigma公司,纯度均大于98%;左旋多巴(L-DOPA)购自阿拉丁公司,纯度大于99%;甲醇、乙醇、氯化铁、硫酸、二甲基亚砜、磷酸二氢钠、磷酸氢二钠等为分析纯,水为去离子水。
1.2 仪器与设备
DGG-9053AD型电热恒温鼓风干燥箱(上海森信实验仪器有限公司),RE-52A型旋转蒸发仪(上海亚荣生化仪器厂),UV-1800紫外分光光度计(岛津公司),MultiSkan FC型酶标仪(Thermo Scientific公司),PHSJ-3F型pH计(雷磁公司)等。
1.3 样品的制备
采集新鲜的鹅毛竹叶子,清洗,沥干,立刻用微波炉(间隙加热3次,每次1 min),然后置于烘箱中干燥,粉碎,过40目筛,备用。
称取5.00 g粉末样品,加入15倍的甲醇热回流提取2 h,提取3次,趁热过滤,洗渣,合并滤液,并用旋转蒸发仪减压浓缩至浸膏状,得到醇提取物。将醇提取物用一定体积的蒸馏水充分混悬,加入一定量的石油醚除去蜡质、色素、油脂等弱极性物质,然后以体积比1:1的溶剂量依次用乙酸乙酯、正丁醇分别萃取3次,分别旋转蒸发除去溶剂后,得到乙酸乙酯相、正丁醇相以及水相,各相溶液浓缩干燥至恒重,备用。
1.4 总酚含量的测定
1.4.1 标准曲线的制作 以对羟基苯甲酸为标准品,采用Folin试剂还原比色法[11]测定,精密称取对羟基苯甲酸标准品17.2 mg,无水乙醇溶解,容量瓶定容至50 mL,配成0.344 mg/mL的对羟基苯甲酸标准品溶液。准确吸取标准品溶液0、0.05、0.10、0.20、0.40、0.80、1.20、1.60 mL,移入25 mL具塞试管中,分别用无水乙醇稀释至10.0 mL。各加入1.0 mL Folin试剂和2.0 mL 20% Na2CO3水溶液,在沸水浴上加热10 min,用水冷却并稀释至25 mL。室温放置30 min,在745 nm的波长处测定吸光度(A)。以A值为纵坐标(Y),对羟基苯甲酸的质量为横坐标(X),绘制标准曲线,得回归方程:

1.4.2 样品测定 分别精密量取待测液0.1 mL,按绘制标准曲线中的方法在745 nm处测定A值,并根据对羟基苯甲酸的标准曲线,计算各试样的总酚量。
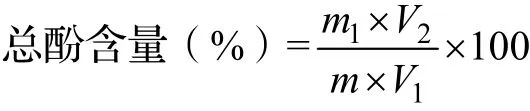
式中:m1为依据标准曲线计算出被测液中总酚含量(mg),m为供试品取样量(mg),V1为待测液分取的体积(mL),V2为待测液的总体积(mL)。
1.5 总黄酮含量的测定
1.5.1 标准曲线的制作 以芦丁为标准品,参照丁明等人[12]的硝酸铝—亚硝酸钠比色法加以改进,准确吸取浓度为150 μg/mL的芦丁溶液0、0.50、1.00、2.00、3.00、4.00 mL移入10 mL具塞试管中,用无水乙醇定容至5 mL,分别加入5%亚硝酸钠溶液0.3 mL,摇匀,放置5 min,加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min后加入
2 mL 1.0 mol/L氢氧化钠溶液,用无水乙醇定容至10 mL,静置10 min。在波长510 nm处测定A值。以A值为纵坐标(Y),以芦丁的质量为横坐标(X),绘制标准曲线,得回归方程:

1.5.2 样品测定 分别精密量取待测液1.0 mL,在510 nm的波长处测定A值,并根据芦丁的标准曲线,计算各试样总黄酮含量。
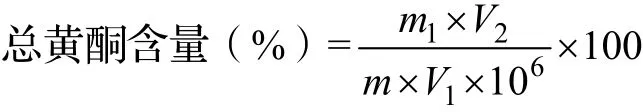
式中:m1为依据标准曲线计算出被测液中黄酮含量(μg),m为供试品取样量(g),V1为待测液分取的体积(mL),V2为待测液的总体积(mL)。
1.6 三萜含量的测定
1.6.1 标准曲线的制作 用熊果酸作为标准品,采用香草醛—冰醋酸比色法[11]绘制标准曲线。精密称取熊果酸标准品2.5 mg,用无水乙醇溶解,容量瓶定容至25 mL,即得100 μg/mL熊果酸标准品溶液。精密吸取标准品溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,于加热状态下氮气吹干溶剂,分别加入5%香草醛—冰醋酸0.5 mL,高氯酸0.8 mL,混匀后于65 ℃水浴反应15 min,取出放置冰水中冷却,加冰醋酸5 mL,混匀,在548 nm处测定A值。以在548 nm处测定的A值为纵坐标(Y),以熊果酸的质量为横坐标(X),绘制标准曲线,得回归方程:

1.6.2 样品测定 样品用无水乙醇适度稀释,分别精密量取不同待测液0.04 mL,在548 nm处测定A值,并根据熊果酸的标准曲线,计算各试样的三萜量。

式中:m1为依据标准曲线计算出被测液中熊果酸含量(μg),m为供试品取样量(g),V1为待测液分取的体积(mL),V2为待测液的总体积(mL)。
1.7 不同极相抗氧化活性测定
1.7.1 DPPH自由基清除试验 准确称取DPPH试剂0.01 g,用甲醇溶解至250 mL量瓶中,摇匀得0.10 mmol/L。分别取0.1 mL待测样液和3.9 mL DPPH溶液混合摇匀,在室温下反应1 h,517 nm波长下测定A值。以VC作为阳性对照并以甲醇为空白对照,计算各样品抑制率。
以待测样品浓度为横坐标(X),抑制率为纵坐标(Y)得待测样品清除DPPH自由基的关系曲线。计算得到待测样品的半数抑制浓度(IC50值)。

1.7.2 ABTS+自由基清除试验 取176 μL浓度为140 mM的过硫酸钾水溶液加入到10 mL浓度为0.384 mg/mL的ABTS+溶液中混合,避光反应12 ~ 16 h。
测定之前加入无水乙醇将ABTS+溶液稀释至吸光值为0.700±0.02(734 nm)下。以无水乙醇为空白试剂将分光光度计调零。将3.9 mL的ABTS+溶液与0.1 mL的待测液溶液混合摇匀,在室温下反应6 min,在734 nm波长下测定吸光值(A样品)。3.9 mL的ABTS+溶液与0.1 mL样品提取剂为空白对照,测的吸光值(A空白)。以VC作为阳性对照。以待测样品浓度为横坐标(X),抑制率为纵坐标(Y)得待测样品清除ABTS+自由基的关系曲线。计算得到待测样品的半数抑制浓度(IC50值)。

1.7.3 FRAP法分析铁离子还原能力 参照文献[13]方法,配制相同浓度0.1 mg/mL的样品溶液,各取0.3 mL加入2.7 mL工作液(0.3 mo1/L醋酸盐缓冲液25 mL,10 mmol/L TPTZ溶液2.5 mL,20 mmo1/L FeCl3溶液2.5 mL),混匀后在37℃反应10 min,于593 nm处测定A值。以70%乙醇溶液做空白对照。准确量取6.08 mg硫酸亚铁溶于适量的水中,加入18 mo1/L硫酸0.25 mL,再加水稀释至50 mL,得0.8 mmol/L的硫酸亚铁溶液,并置入小铁钉。依次配制 400、200、100、50、25 μmol/L标准溶液,以硫酸亚铁浓度为横坐标(X),A值为纵坐标(Y)绘制标准曲线,得回归方程:

将样品及对照品VC反应后的A值在标准曲线上获得相应的硫酸亚铁的浓度(μmol/L)定义为FRAP值。
1.8 酪氨酸酶活性抑制
1.8.1 酶活力的测定 底物多巴经过酪氨酸酶催化产生多巴醌,多巴醌经氧化生成黑色素,在475 nm波长处黑色素有最大吸收峰,其消光系数为ε=3 700(L·mol-1·cm-1)[14]。酶活力单位(U)定义为:以每分钟黑色素在475 nm波长的吸光度(OD475)增加0.001为一个酶活力单位。
酶活力测定参考文献[15]的方法并加以改进:反应总体系为200 μL,5 mM L-DOPA溶液20 μL置于试管中,加入pH6.8的磷酸盐缓冲溶液140 μL,于37℃恒温水浴锅中保温10 min,加入40 μL 250U/mL酪氨酸酶水溶液,并测定一定时间OD475的变化。
1.8.2 鹅毛竹叶提取物对酪氨酸酶抑制能力的测定 依照酶活力测定方法,以L-DOPA为底物,加入不同浓度的鹅毛竹叶乙酸乙酯相溶液40 μL使其终浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL,在37℃恒温水浴锅中各自保温10 min,加入40 μL酪氨酸酶水溶液于37℃恒温水浴锅中各自保温10 min后测定OD475,实验平行3次,取其平均值,以熊果苷为阳性对照,以磷酸缓冲溶液为空白对照,根据抑制物质量浓度—酶抑制率回归方程求得半抑制浓度(IC50)。同样的方法计算醇提物、正丁醇相及水相的半抑制浓度。
1.8.3 鹅毛竹叶提取物对酪氨酸酶的抑制作用机理的测定 在上述鹅毛竹叶乙酸乙酯相不同浓度的酶活性测定体系中,底物多巴浓度5 mM固定不变,分别加入250 U/mL酪氨酸酶溶液0、10、20、30、40 μL,测定加入0、4、6、8、10 mg/mL提取物对酶活力的影响,通过作图法判断鹅毛竹叶乙酸乙酯相抑制酪氨酸酶活性的抑制机制(实验做3组平行,取其平均值)。
1.8.4 鹅毛竹叶提取物对酪氨酸酶的抑制作用类型和抑制常数的测定 在鹅毛竹叶乙酸乙酯相不同浓度的酶活性测定体系中,固定体系中酶的浓度不变,分别加入5 mM多巴溶液40、50、66.67、100、200 μL,使底物多巴终浓度的倒数为5、4、3、2、1 mM-1,测定加入0、1、2、3、4 mg/mL提取物时,酶活力的变化,抑制类型通过Lineweaver-Burk双倒数作图法判断。抑制常数Ki和Kis,分别通过双倒数图中直线的斜率和纵轴截距对提取物浓度二次作图求出[16]。
1.9 数据处理
结果采用“SPSS 17.0”统计软件进行数据分析,结果以±s表示。
2 结果与分析
2.1 鹅毛竹叶不同极相中有效成分的含量
鹅毛竹叶醇提物及不同极相中总酚、总黄酮和三萜含量的测定结果见表1。由表1可知,鹅毛竹叶醇提物的提取率为15.90%,乙酸乙酯相、正丁醇相和水相的提取比例约为 1:2:3。其中醇提物及不同极相中的总酚含量从高到低为乙酸乙酯相 > 正丁醇相 > 醇提物 > 水相,其含量13.74% ~ 28.63%。提取物中总黄酮含量与总酚含量呈正相关,相关系数R2= 0.876 5,总黄酮含量5.27% ~ 23.74%。各提取物中三萜的含量3.75% ~ 15.27%,其含量高低为乙酸乙酯相 > 醇提物 > 正丁醇相 > 水相。

表1 醇提物及不同极相的得率和有效成分的含量(n=3)Table 1 Yield, contents of effective component in the methanol extract and different polarities from S. chinensis %
2.2 鹅毛竹叶不同极相萃取物抗氧化性能的比较
由表2可知,醇提物与不同极性部位对DPPH·和ABTS自由基的清除能力与铁还原的能力趋势基本一致。相比阳性对照,醇提物级不同极性部位的抗氧化能力均弱于VC的抗氧化能力,但醇提物与不同极性部位都具有一定的 DPPH自由基和ABTS自由基清除能力,且存在显著性差异(P< 0.05),它们对DPPH自由基和ABTS自由基清除能力大小顺序一样,依次为VC>乙酸乙酯相>正丁醇相>醇提物>水相。同时,鹅毛竹叶醇取物及其不同极性部位均表现出不同程度的还原能力,其中乙酸乙酯相的还原力接近与VC的还原力,它们的还原力大小同样为VC>乙酸乙酯相>正丁醇相>醇提物>水相。

表2 不同极相的抗氧化活性(n=3)Table 2 Antioxidant activities in different polarities from S. chinensis μg/mL
2.3 不同极相对酪氨酸酶的抑制作用
鹅毛竹叶醇提物及不同极相对酪氨酸酶活性的影响见图 1。鹅毛竹叶各提取物对酪氨酸酶的抑制作用均低于熊果苷的抑制作用,但均显示出了一定的酪氨酸酶抑制作用,并对酪氨酸酶活性的抑制作用随着物质的浓度增加而加强,其中乙酸乙酯相和正丁醇相对酪氨酸酶的抑制作用较为明显,通过回归方程计算得出两者的半抑制浓度(IC50)分别为3.29 mg/mL、5.68 mg/mL,醇提物的半抑制浓度仅次于正丁醇相的半抑制浓度,其IC50为8.30 mg/mL,而水相的半抑制浓度则达到9.46 mg/mL,同样的方法得到熊果苷的IC50为1.53 mg/mL。

图1 抑制率与样品浓度的关系Figure 1 Relationship between inhibitory effect and sample concentration
2.4 鹅毛竹叶提取物对酪氨酸酶的抑制作用机制
以酶活力对酶浓度作图,如果酶活力的变化图形是一组平行线,则加入的抑制剂对酶抑制作用是不可逆的过程,如果得到一组相交于原点的直线,则加入的抑制剂对酶的抑制作用是可逆的过程[17]。在底物浓度不变,改变酪氨酸酶浓度时,酪氨酸酶经鹅毛竹叶乙酸乙酯相作用后的剩余酶活力与加入的酶量间的关系见图 2,由图2可知,随着反应体系中乙酸乙酯相的浓度增大,直线斜率逐渐下降,所有直线均通过原点,说明鹅毛竹叶乙酸乙酯相对酪氨酸酶的抑制作用是可逆过程,也即抑制作用是通过鹅毛竹叶乙酸乙酯相和酶结合有效地抑制了酶活力,从而降低了酶的催化效率,而不是通过减少有效酶量而降低酶活力[18]。
2.5 鹅毛竹叶提取物对酪氨酸酶的抑制作用类型和抑制常数
进一步研究鹅毛竹叶乙酸乙酯相抑制酪氨酸酶活性的作用类型,在测定的体系中,酪氨酸酶的浓度固定不变,改变加入底物多巴的浓度,测定浓度为 0、1.0、2.0、3.0、4.0 mg/mL的抑制剂对酶活力的影响,以Lineweaver-Burk双倒数作图法判断抑制剂的抑制类型,其测定结果见图3。由图3(a)可知,随着抑制物浓度的增大,所有的直线均相交于纵轴的一点,Km随着浓度的增大逐渐增大,Vmax则基本保持不变,所以判断鹅毛竹叶乙酸乙酯相对酪氨酸酶的抑制作用属于竞争性抑制,表明鹅毛竹叶提取物乙酸乙酯相仅能与游离酶(E)结合,不能与酶—底物复合物(ES)结合。同时,以图 3(a)中各直线的斜率对抑制剂的浓度进行二次作图,得到图3(b),由图中直线计算出鹅毛竹叶乙酸乙酯相对酪氨酸酶的抑制常数Ki= 27.49 mg/mL。

图2 鹅毛竹叶提取物乙酸乙酯相对酪氨酸酶的抑制机制Figure 2 Inhibitory mechanism of the ethylacetate extract from leaves of S. chinensis on tyrosinase
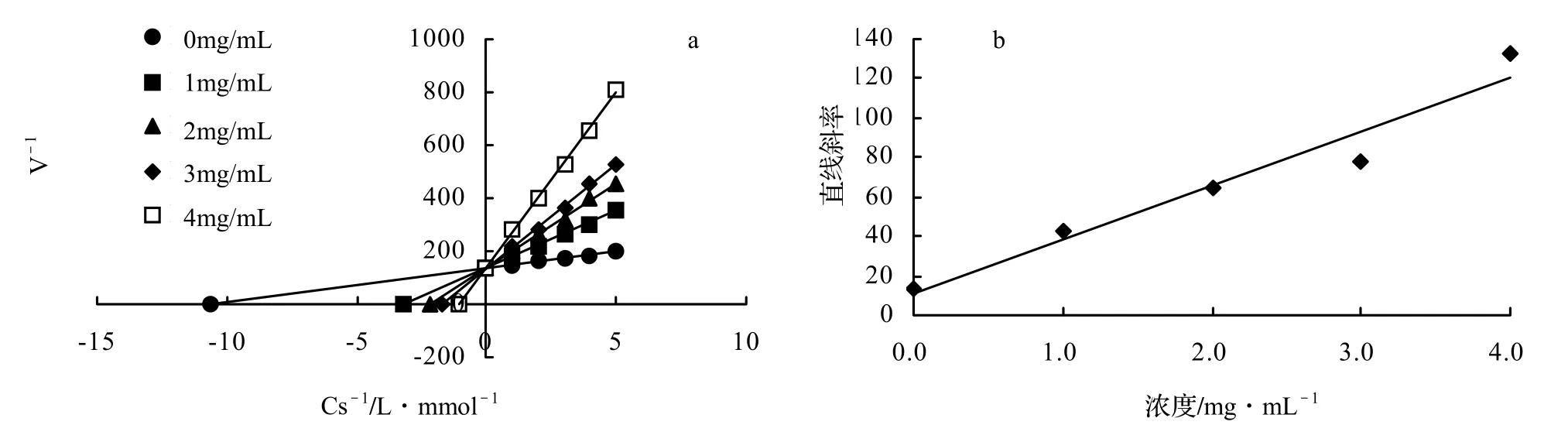
图3 鹅毛竹叶乙酸乙酯相对酪氨酸酶抑制作用类型和抑制常数Figure 3 Lineweaver-Burk plots for inhibition of ethyl acetate extract from leaves of S. chinensis on tyrosinase
2.6 总酚、总黄酮和三萜含量与抗氧化活性及抑制酪氨酸酶活性的相关性
鹅毛竹叶醇提物及不同极性部位中有效成分含量与其抗氧化活性、抑制酪氨酸酶活性的相关性见表3。
由表3可知,鹅毛竹叶醇提物及不同极性部位的总黄酮含量与抗氧化活性存在很大的相关性,它们的抗氧化活性与总黄酮含量的相关系数都在90%以上,因此,可认为黄酮是鹅毛竹叶提取物抗氧化的主要成分。其中总酚含量与ABTS自由基清除能力的相关性略高于总黄酮含量与ABTS自由基清除能力的相关性,而且提取物中总酚含量与酪氨酸酶抑制能力的相关性达到99%以上,这是因为鹅毛竹叶提取物中不仅有黄酮,还存在酚酸类物质,所以酚酸和黄酮是总酚清除ABTS自由基以及抑制酪氨酸酶活性的主要活性成分。同时表3中的数据显示,酪氨酸酶抑制能力与抗氧化能力之间呈正相关,相关性在90%以上,因此可推断鹅毛竹叶提取物抑制酪氨酸酶的能力与其抗氧化有很强的关联性。

表3 鹅毛竹叶醇提物及不同极性部位总酚、总黄酮和三萜含量与抗氧化活性及酪氨酸酶抑制的相关性Table 3 The correlation between content of total phenols, total flavonoids, triterpenoid and the antioxidant activity, the tyrosinase inhibition in ethanol extract and its different polarities from leaves of S. chinensis
3 讨论
天然植物的资源丰富,安全性高,目前从植物资源中提取分离酪氨酸酶抑制剂成为热点[21]。傅国强等[22]通过对196味中药对酪氨酸酶活性抑制作用的筛选发现,光果甘草、牡丹皮、苍耳子、天麻等20味中药对酪氨酸酶具有显著抑制作用。Baurin等[23]以桑叶为对照,对隶属38个属67种热带植物抑制酪氨酸酶活性的作用进行筛选,发现5种热带植物也具有抑制酪氨酸酶活性的作用,为研发热带植物酪氨酸酶抑制剂提供了一定的科学依据。曾祖平等[24]针对柿叶中对黑素细胞增殖及酪氨酸酶活性有明显抑制作用的部位进行筛选,研究发现,柿叶醇提取物低浓度时对酪氨酸酶的抑制作用强,萃取后所得各组分对酶的抑制作用低于萃取前的醇提物对酶的抑制作用,三氯甲烷组分与乙酸乙酯组分合并后对酶的抑制作用高于萃取前的醇提物,说明柿叶对酪氨酸酶的抑制可能是由不同成分共同作用的结果。本试验中,以次生代谢物丰富、生物活性广泛的竹叶提取物为研究材料,研究其对酪氨酸酶活性的抑制作用及其机理,研究发现在醇提物及不同极性部位中,随着提取物浓度的增加,抑制能力随之增强,其中乙酸乙酯相对酪氨酸酶活性的抑制作用最强,其半抑制浓度为3.29 mg/mL,高于萃取前的醇提物对酶的抑制作用。在相关性分析中,总酚含量与酶抑制能力的相关性到达99%以上,可推测,总酚是鹅毛竹叶提取物中抑制酪氨酸酶活性的主要成分。在对乙酸乙酯相对酪氨酸酶抑制类型的研究中表明,乙酸乙酯相对酪氨酸酶的抑制表现为可逆的竞争性抑制,其抑制常数Ki = 27.49 mg/mL。
目前,国内外普遍认为酪氨酸酶抑制剂对该酶的抑制机理有4种途径:一是络合酪氨酸酶中的铜离子,使铜离子失去对氧的结合能力,降低酶活性;二是作为强抗氧化剂拮抗氧对酪氨酸酶的激活;三是通过清除氧自由基,削弱酪氨酸酶的供氧作用;四是作为酪氨酸酶的竞争性,抑制酶活性[25]。李娜等[26]从清除自由基和螯合金属离子两方面研究了红花黄酮对酪氨酸酶的抑制及其机理,研究发现,红花黄酮类化合物对DPPH自由基、羟基自由基和超氧自由基均有清除作用,对酪氨酸酶有显著性。本试验通过测定鹅毛竹叶提取物清除DPPH自由基、ABTS自由基能力及铁还原能力研究竹叶提取物对酪氨酸酶的抑制机理。研究发现,鹅毛竹叶提取物具有清除DPPH自由基、ABTS自由基的能力和铁还原能力。相关性分析中,抑制酪氨酸酶活性的能力与抗氧化能力之间呈正相关,相关性在90%以上,因此推断鹅毛竹叶醇提物及不同极性部位对酪氨酸酶的抑制作用可能是通过清除自由基,终止自由基链的引发,削弱酪氨酸酶反应过程中的供氧而抑制酪氨酸酶催化活性;但是也存在鹅毛竹叶提取物中的抗氧化剂拮抗了氧气对酪氨酸酶的激活而降低酪氨酸酶的催化活性的可能性,鹅毛竹叶提取物对酪氨酸酶的具体抑制作用机制以及具有酪氨酸酶活性的物质还有待进一步分析研究。而且本文仅对酪氨酸酶进行体外实验,尚有待进一步对鹅毛竹叶提取物细分并进行体内实验,为鹅毛竹叶的开发利用提供科学依据。同时,为了综合开发利用我国丰富竹叶资源,也为竹叶活性成分在色素障碍性皮肤病的治疗、化妆品行业、食品添加剂等领域的利用提供一定的参考。
[1] 龚金炎,吴晓琴,夏道宗,等. RP-HPLC 法测定竹叶提取物中黄酮类和酚酸类成分[J]. 中草药,2010, 41(1):63-65.
[2] 何跃君,岳永德. 竹叶提取物的有效成分及其应用研究进展[J]. 生物质化学工程,2008,42(3):31-37.
[3] 张英,丁霄霖. 竹叶有效成分和抗活性氧自由基效能的研究[J]. 竹子研究汇刊,1996,13(7):17-24.
[4] 张英,唐莉莉. 毛金竹叶提取物抗衰老作用的试验研究[J]. 竹子研究汇刊,1997,14(4):62-66.
[5] 倪向梅,曹光群. 竹叶提取物的体外抑菌及抗氧化活性的研究[J]. 天然产物研究与开发,2011,2(3):717-721.
[6] 张英. 竹叶提取物类SOD活性的邻苯三酚法测定[J]. 食品科学,1997,18(5):47-49.
[7] 许钢,张虹,庞洁. 竹叶提取物对亚硝化反应的抑制[J]. 无锡轻工大学学报,2000,19(6):583-586.
[8] 程科军,陈竞,梁高林,等. Taxiphyllin:苦竹笋中具有酪氨酸酶抑制活性的氰苷[J]. 天然产物研究与开发,2005,17(6):733-735, 772.
[9] 张永兵. 竹叶提取物对酪氨酸酶和黑色素瘤细胞的影响[D]. 北京:中国林业科学研究院,2009.
[10] 赖炘,陈其兵. 竹叶提取物的化学成分及其生理功能研究进展[J]. 福建林业科技,2013,40(1):214-220.
[11] 倪勤学,刘颖坤,龚凌霄,等. 6种地被竹叶有效成分及其抗氧化活性研究[J]. 中草药,2011,42(11):2 317-2 321.
[12] 丁明,陈少妃,徐耀华. 黄条金刚竹中总黄酮的提取及含量测定[J]. 浙江农业科学,2011(4):910-913.
[13] Ardestani A, Yazdanparast R. Inhibitory effects of ethylacetate extract of Teucrium polium on in vitro protein glycoxidation[J]. Food Chem Toxicol, 2007, 45(12):2 402-2 411.
[14] Osvaldo Z, Antonella B, Patrizia C, et al. Truffle-thio-flavours reversibly inhibit truffle tyrosinase[J]. FEMS Microbiol Lett, 2003(220):81-88.
[15] 楼彩霞,田燕泽,朴香兰,等. 连翘不同极性部位对酪氨酸酶活性抑制作用研究[J]. 时珍国医国药,2011,22(10):2 415-2 416.
[16] 宋康康,丘陵,黄瑛,等. 熊果甙作为化妆品添加剂对酪氨酸酶抑制作用[J]. 厦门大学学报(自然科学版),2003,42(6):791-794.
[17] 焉翠蔚,徐睿,孙妍,等. 菲律宾蛤仔提取物抑制酪氨酸酶活性的研究[J]. 中国海洋大学学报(自然科学版),2009,39(6):1 233-1 236, 1 260.
[18] 孙晓梅. 真江蓠和孔石莼提取物对酪氨酸酶活性抑制作用的研究[D]. 青岛:中国海洋大学,2011.
[19] Fenol L G, Penalverm J, Rodriguez-Lopez J N, et al. Tyrosinase kinetics: discrimination between two models to explain the oxidation mechanism of monophenol and diphenol substrates[J]. Int J Biochem & Biol, 2004, 36(2):235-246.
[20] Kubo I, Chen Q X, Nihei K, et al. Molecular design of antibrowning agents: antioxidative tyrosinase inhibitors[J]. Food Chem, 2003, 81(2):241-247.
[21] 唐建阳,苏明星,刘凤娇,等. 砂仁提取物对蘑菇酪氨酸酶活力的抑制效应[J]. 厦门大学学报(自然科学版),2012,51(2):258-262.
[22] 傅国强,马鹏程,吴勤学,等. 196味中药乙醇提取物对酪氨酸酶的抑制作用[J]. 中华皮肤科杂志,2003,26(2):103-106.
[23] Baurin N, Arnoult E, Scior T, et al. Preliminary screening of some tropical plants for anti-tyrosinase activity[J]. J Ethnopharmacol, 2002(82):155-158.
[24] 曾祖平,张秀梅,李萍,等. 柿叶提取物对黑素细胞增殖和酪氨酸酶活性的影响[J]. 中国民族民间医药,2009(20):1-2.
[25] 张永兵. 竹叶提取物对酪氨酸酶和黑色素瘤细胞的影响[D]. 北京:中国林业科学研究院,2009.
[26] 李娜,鲁晓翔. 红花黄酮对酪氨酸酶的抑制及其机理研究[J]. 食品科技,2010,35(12):176-179, 190.
Antioxidant and Inhibitory Activities of Extracts from Leaves of Shibataea chinensis on Tyrosinase
ZHANG Lei1,2,WANG Shu3,4,NI Qin-xue3,4,XU Guang-zhi3,4,GAO Qian-xin3,4,ZHANG You-zuo3,4*
(1. Zhejiang University of Science & Technology, Hangzh ou 310 023, China; 2. Zhejiang P rovincial Key Lab for Chem & Bio P rocessing Technology of A gricultural Products, Hangzhou 31 0023, China; 3. College of A griculture and F ood Science, Zhejiang A & F University, Lin’an 311300, China; 4. Key Lab for Quality Improvement of Agricultural Products of Zhejiang, Lin’an 311300, China)
The inhibitory effect on tyrosinase and anti-oxidant activity of methanol extract and its different polarities (ethyl acetate, n-butyl alcohol, water) from leaves of Shibataea chinensis was studied. The contents of total phenols, total flavonoids, and triterpenoids in the extracts were detected by Forint reduction assay reagent, aluminum nitrate-sodium nitrite colorimetry, and vanillin-acetic acid assay. The antioxidative and reducing activities of extracts from leaves of S. chinensis were assessed by DPPH, ABTS and FRAP. Tyrosinase activity was estimated by oxidation rate of L-dopa. The result showed that the contents of total phenols, total flavonoids and triterpenoids from leaves of S. chinensis were found the maximum in the ethylacetate, about 28.63%±0.19%, 23.74%±0.17% and 15.27%±0.67%, and had the best inhibitory effect on tyrosinase and antioxidant activity. Its 50% inhibiting concentration was estimated to be 3.29 mg/mL. In addition, positive correlation was existed between the total flavonoids content and the antioxidant ability to reducing power, DPPH· and ABTS for methanol extract and its polarities, with the correlation coefficient of0.947, 0.9001 and 0.9653. It can be concluded that the total flavonoids content is a main component for the antioxidant activity of extracts from leaves of S. chinensis. Meanwhile, positive correlation was existed between their total phenols content and the inhibitory effect on tyrosinase, with the correlation coefficient of 0.991, indicating that total phenols content is a main component for the inhibitory effect on tyrosinase. The ethylacetate extract from S. chinensis is the best and a reversible competitive inhibitor for the oxidation of L-dopa and the anti-oxidant activity is also the best.
Shibataea chinensis; bamboo leaves; antioxidant activity; tyrosinase; inhibition
S718.43
A
1001-3776(2014)05-0008-08
2014-05-17;
2014-07-01
浙江省大学生科技创新活动计划(2013R412042);浙江农林大学创新训练项目(201201006)
张蕾(1981-),女,浙江浦江人,助理研究员,博士生,从事药用植物功效成分提取与应用;*通讯作者。
