姜黄素衍生物B06对2型糖尿病大鼠肝脏的保护作用*
2014-05-16王玲徐梦菲刘曦王维维陈三妹程锦国陈国荣
王玲,徐梦菲,刘曦,王维维,陈三妹,程锦国,陈国荣△
(温州医科大学1附属第一医院病理科,2附属第二医院,浙江温州 325015;3浙江大学附属第二医院病理科,浙江杭州 310000;4绍兴文理学院医学院,浙江绍兴 312000)
姜黄素衍生物B06对2型糖尿病大鼠肝脏的保护作用*
王玲1,徐梦菲1,刘曦2,王维维3,陈三妹4,程锦国2,陈国荣1△
(温州医科大学1附属第一医院病理科,2附属第二医院,浙江温州 325015;3浙江大学附属第二医院病理科,浙江杭州 310000;4绍兴文理学院医学院,浙江绍兴 312000)
目的:研究姜黄素衍生物B06对2型糖尿病大鼠肝脏的保护作用及机制。方法:雄性SD大鼠35只,随机均分成5组:正常对照组、高脂组、高脂治疗组、糖尿病组和糖尿病治疗组。采用高脂饮食加链脲佐菌素诱导2型糖尿病大鼠模型。高脂治疗组及糖尿病治疗组用0.2 mg·kg-1·d-1B06灌胃8周。治疗结束后用光镜和透射电镜观察大鼠肝组织的形态学改变,并用Western blotting方法检测肝脏AMP活化蛋白激酶α(AMPKα)和磷酸化AMPKα(p-AMPKα)蛋白的表达。结果:高脂组及糖尿病组大鼠肝脏显示肝细胞脂肪变性、坏死,炎症细胞浸润,纤维组织增生,2型糖尿病大鼠和高脂血症大鼠肝脏组织p-AMPKα表达降低;经B06干预后,糖尿病大鼠和高脂血症大鼠肝脏的形态学损害明显得到改善,且肝脏组织p-AMPKα的表达水平升高(P<0.05)。结论:B06对2型糖尿病大鼠的肝脏具有保护作用,可能与其上调肝脏p-AMPKα蛋白表达有关。
糖尿病;高脂血症;姜黄素衍生物B06;肝;AMP活化蛋白激酶α;大鼠
2型糖尿病发病机制复杂,但总的来说,是以胰岛素抵抗为主,同时伴随有高脂血症,有广泛的并发症,其中肝脏是受累的重要的靶器官之一。姜黄素衍生物B06去除了姜黄素不稳定的β-二酮基团,改善了其不稳定性和在体内的代谢速度快、吸收少、生物利用度低等缺点,更好地发挥姜黄素的降血脂、抗动脉粥样硬化、抗氧化、抗肿瘤等多种药理作用[1]。然而,姜黄素衍生物B06对高脂饲养及2型糖尿病大鼠肝脏的作用国内外尚未见报道。本研究通过对糖尿病大鼠和高脂血症大鼠行B06干预,观察肝脏的形态学改变,并测定肝脏组织AMP活化蛋白激酶α(AMP-activated protein kinase α,AMPKα)、磷酸化AMPKα(phosphorylated AMP-activated protein kinaseα,p-AMPKα)的蛋白表达水平,探讨其对肝脏的影响及作用机制。
材料和方法
1 动物分组及模型建立
健康雄性SD大鼠(温州医科大学实验动物中心提供)35只,SPF级,体重160~200 g,普通饲料适应性喂养1周后,随机均分成5组:正常对照(NC)组、高脂(high-fat,HF)组、高脂治疗(HF+B06 treatment,HFT)组、糖尿病(diabetes mellitus,DM)组和糖尿病治疗(DM+B06 treatment,DMT)组。对照组继续普通饲料喂养,其余组改用高脂饲料(饲料配方参考文献[2])喂养4周后,其中DM组与DMT组大鼠按30 mg/kg单次腹腔注射链脲佐菌素(链脲佐菌素溶于0.1 mmol/L枸橼酸缓冲液内,pH 4.0),72 h后尾静脉采血测空腹血糖,大于16.7 mmol/L为模型成功,NC组、HF组及HFT组腹腔注射等容积枸橼酸缓冲液。成模后,后4组继续高脂饲料喂养,HFT组及DMT组用0.2 mg·kg-1·d-1B06灌胃8周,其余组给予等容积的2%羧甲基纤维素钠灌胃。实验期间动物自由进食进水,未使用胰岛素及其它降糖药物。治疗结束后,禁食12 h后股动脉放血处死动物。
2 药品
姜黄素衍生物B06为温州医科大学药学院广教授惠赠。
3 主要试剂
胰岛素检测试剂盒购自上海西塘生物科技有限公司;链脲佐菌素购自厦门星隆达化学试剂有限公司;AMPKα和p-AMPKα抗体购自Cell Signaling。
4 空腹血糖(fasting blood glucose,FBG)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)和稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)的测定
分别取上述5组大鼠,股动脉放血处死,取血3 mL室温凝固约25 min,1 500 r/min离心20 min,分离血清,用日立7600大型生化分析仪检测各组大鼠FBG、TC、TG、LDL-C和HDL-C。ELISA测定空腹胰岛素(fasting insulin,FINS)水平,并计算HOMA-IR。
5 肝脏的病理检查
5.1 HE染色标本制备具体步骤见参考文献[3-4]。
5.2 胶原纤维(Masson)染色标本制备石蜡切片,常规脱蜡,苏木素染色5 min,1%盐酸乙醇分化2 s,置于Masson液[组成成份:变色酸2R(chromotrope 2R)0.25 g、磷钨酸0.5 g、冰醋酸0.5 mL和蒸馏水50 mL]中染色5 min,水洗,亮绿液染色5 min,95%乙醇脱水1 min,于石炭酸二甲苯中3 s,二甲苯透明,中性树胶封固。
5.3 电镜标本制备具体步骤见参考文献[3-4]。
6 Western blotting法检测肝脏组织中p-AMPKα蛋白的表达
6.1 蛋白样品制备从-80℃冰箱中取出肝脏组织,称取50 mg组织块置于5 mL试管中,用预冷的PBS洗组织块3次。倒去PBS,加500 μL裂解液,用组织匀浆器将组织彻底破碎。冰上静置30 min。置于1.5 mL离心管中,12 000 r/min离心5 min。取上清液分装于0.5 mL离心管中并置于-80℃保存。
6.2 结果分析用Bio-Rad Quantity One 4.6凝胶成像分析系统拍照,用计算机图像分析软件(GelPro32)进行灰度扫描分析。以目的蛋白条带(AMPKα或p-AMPKα)与β-actin条带累积吸光度(A)值之比作为反映蛋白表达水平的相对指标。
7 统计学处理
采用SPSS 17.0统计软件。数据均为正态分布,以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
结果
1 生化检验结果
1.1 FBG、FINS和HOMA-IR检测结果与NC组相比,HF组FBG和FINS明显升高(P<0.05),HOMA-IR明显升高(P<0.01);DM组FBG和HOMAIR显著升高(P<0.01),FINS差异不显著;经B06干预后,HFT组和DMT组大鼠FBG、FINS和HOMAIR均显著降低(P<0.01),见表1。1.2血清TG、TC、LDL-C、HDL-C检测结果及LDLC/HDL-C的比值与NC组比较,HF组血浆TG显著升高(P<0.01),TC和LDL-C升高(P<0.05),HDL-C差异不显著,LDL-C/HDL-C升高(P<0.05); 经B06干预后,HFT组大鼠TG下降(P<0.05),其余血脂指标差异不显著。与NC组比较,DM组大鼠TG、TC和LDL-C显著升高(P<0.01),LDL-C/HDLC显著升高(P<0.01)。经B06干预后,DMT组大鼠TC、TG、LDL-C水平及LDL-C/HDL-C显著降低(P<0.01),见表2。

表15 组大鼠FBG、FINS及HOMA-IR结果对比Table 1.Comparison of the levels of FBG,FINS and HOMA-IR among different groups(Mean±SD.n=7)
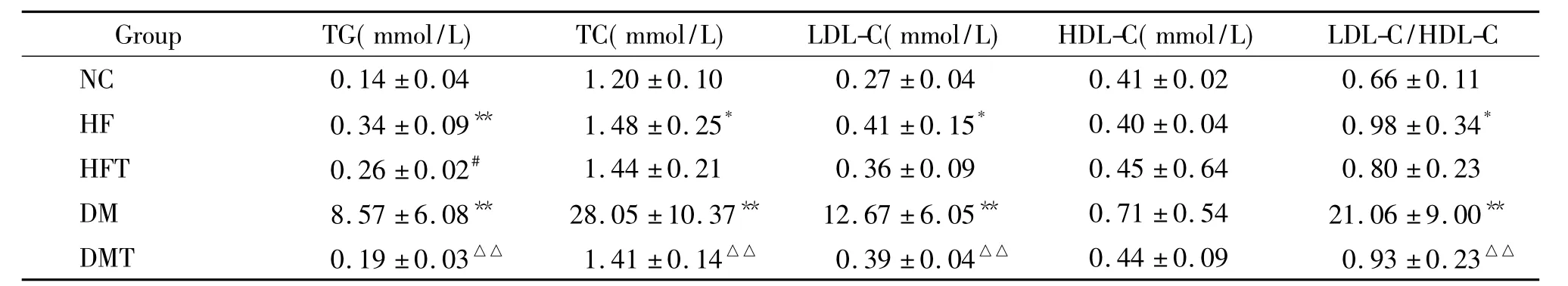
表25 组大鼠血脂结果比较Table 2.Comparison of the concentrations of blood lipids among different groups(Mean±SD.n=7)
2 肝脏的形态学改变
2.1 光镜下观察结果(1)HE染色:NC组大鼠肝细胞呈立方形,排列整齐,汇管区及小叶结构清晰,见图1A;HF组肝细胞脂肪变性明显,细胞浆内形成大小不等的脂滴,有炎症细胞浸润,胶原纤维增生不明显,见图1B;HFT组肝细胞脂肪变性较之前减轻,炎症细胞减少,见图1C;DM组中大鼠肝细胞水样变性、脂肪变性明显,脂滴以小脂滴为主,胶原纤维明显增生并延伸至汇管区周围肝细胞间,伴有多灶区炎症细胞浸润,见图1D;DMT组中肝细胞变性明显减轻,细胞间纤维组织减少,见图1E。(2)Masson染色:NC组大鼠肝脏肝小叶结构清晰,肝细胞形态正常,仅有中央静脉壁、汇管区血管壁可见少量被染成绿色的胶原纤维,其余部位未见明显纤维组织,见图2A;HF组大鼠肝小叶结构完整但排列紊乱,其中可见脂肪变性的肝细胞,汇管区周围、肝细胞间见少量胶原纤维环绕,不形成明显纤维化区域,见图2B;DM组肝小叶结构基本完整,肝细胞索明显破坏,可见肝细胞脂肪变性并伴有坏死及炎症细胞浸润,肝脏纤维组织增生明显,除汇管区外,其余肝组织间也可见胶原纤维相互连接包绕肝细胞,绿染面积增大,见图2C;HFT组和DMT组中肝小叶结构病变减轻,胶原纤维成分减少,肝组织纤维化程度明显减轻,见图2D、E。
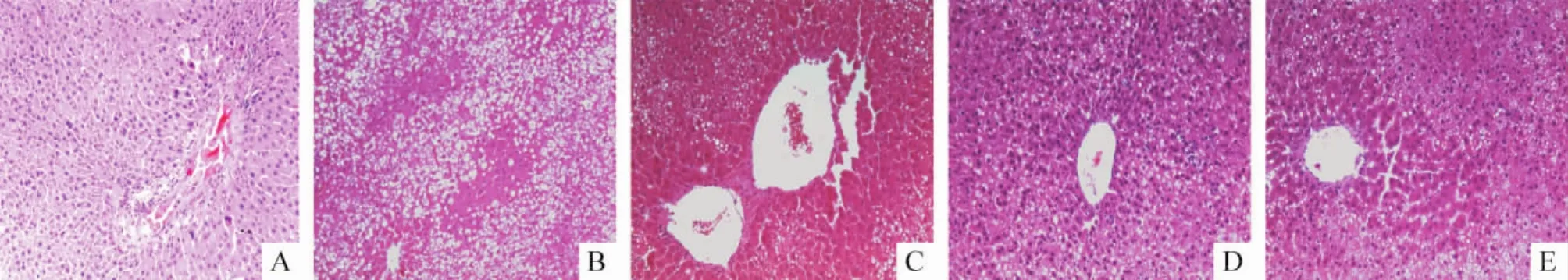
Figure 1.Hepatic tissue morphological changes of each group(HE staining,×100).A:NC group;B:HF group;C:HFT group;D: DM group;E:DMT group.图1 HE染色观察各组大鼠肝脏的形态学改变
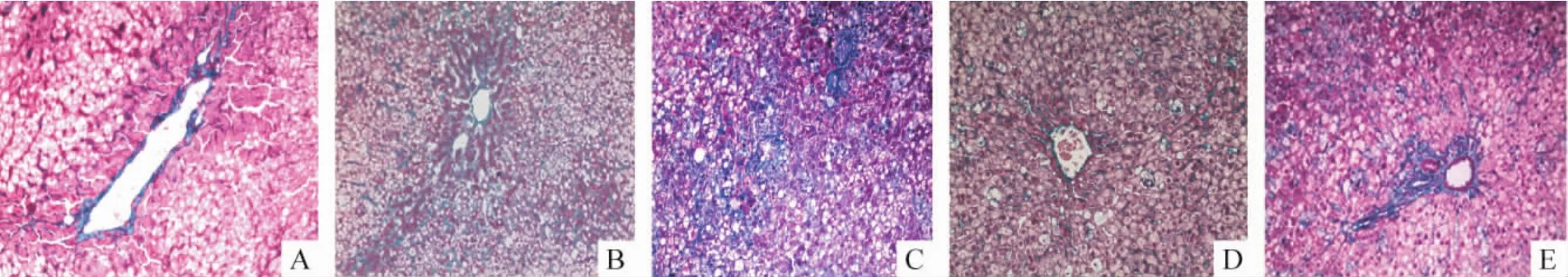
Figure 2.Hepatic tissue morphological changes of each group(Masson staining,×200).A:NC group;B:HF group;C:DM group; D:HFT group;E:DMT group.图2 Masson染色观察各组大鼠肝脏的形态学改变
2.2 电镜超微结构观察结果NC组肝细胞细胞核椭圆形,胞浆内线粒体呈椭圆形,嵴丰富,内质网呈层状排列,核糖体、糖原丰富,无脂滴形成,见图3A。HF组大鼠肝细胞内充满脂质颗粒,大小不一,部分相互融合成巨大脂滴,粗面内质网增多,线粒体肿胀,内室扩张,嵴减少,见图3B。DM组大鼠脂质颗粒明显增多,以小脂滴为主;肝细胞核固缩,染色质加深,染色质呈不规则块状凝集,多居于核膜下;内质网减少、扩张、断裂;线粒体肿胀,嵴排列紊乱、模糊、中断;狄氏间隙胶原纤维明显增生,见图3C。HFT组及DMT组肝细胞内脂质颗粒数量减少,核固缩减轻,线粒体增多,肿胀明显减轻,板状嵴清晰,粗面内质网增多,排列较整齐,见图3D、E。
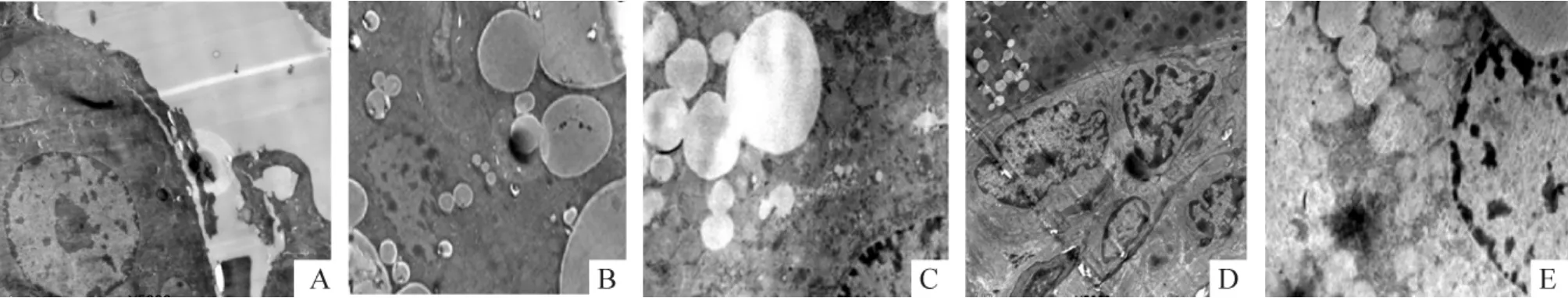
Figure 3.Ultrastructure of rat hepatocytes in each group observed under transmission electron microscope(×5 000).A:NC group; B:HF group;C:DM group;D:HFT group;E:DMT group.图3 电镜下各组大鼠肝细胞超微结构的改变
3 肝组织p-AMPKα的表达水平
与NC组比较,HF组AMPKα表达水平无显著差异,p-AMPKα表达降低(P<0.05),经B06干预后,HFT组AMPKα表达水平无显著差异,p-AMPKα表达升高(P<0.05);与NC组比较,DM组AMPKα 及p-AMPKα表达显著降低(P<0.01),经B06干预后,DMT组AMPKα及p-AMPKα表达显著升高(P<0.01),见图4。
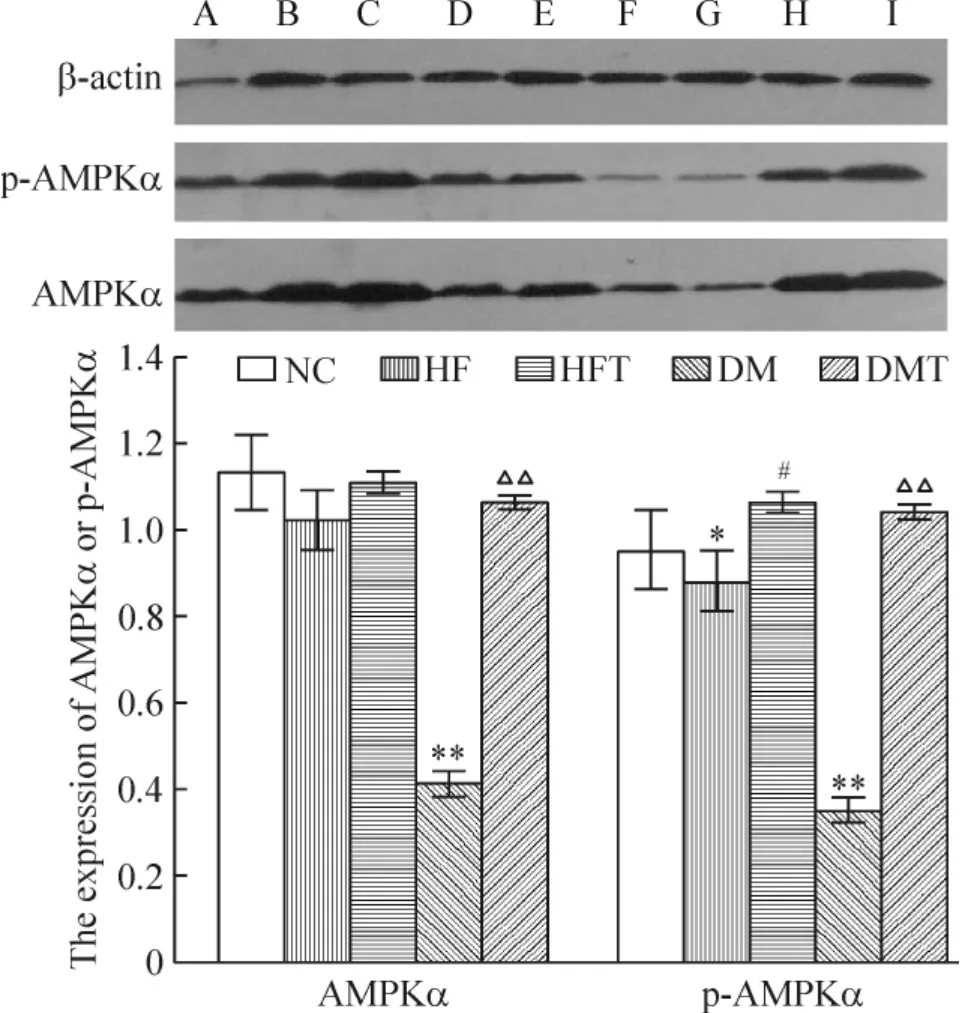
Figure 4.Comparison of the levels of AMPKα and p-AMPKα among different groups.A:NC group;B,C:HFT group;D,E:HF group;F,G:DM group;H,I:DMT group.Mean±SD.n=7.*P<0.05,**P<0.01 vs NC;#P<0.05 vs HF;△△P<0.01 vs DM.图4 各组大鼠肝脏内AMPKα及p-AMPKα蛋白的表达
讨论
在美国,肝脏病变是2型糖尿病患者死亡的主要原因之一,2型糖尿病患者肝脏病变的标准死亡率远远大于2型糖尿病患者心血管病变的标准死亡率[5]。糖尿病患者由于对糖利用有障碍,导致机体大量动员脂肪,从而引起过多游离脂肪酸进入肝脏,这是糖尿病肝病发生的关键因素;另一方面,由于糖尿病患者胰岛素抵抗或分泌不足,导致机体胰岛素抗脂溶作用减弱,也是导致肝损伤的一个主要原因。McGarry[6]在2001年的美国糖尿病协会年会上提出2型糖尿病中糖代谢紊乱的根源为脂代谢异常,他甚至将2型糖尿病称为“糖脂病”。
AMPK是一种细胞内能量代谢的重要调节因子[7]。它是一种异源三聚体,由α、β和γ 3个亚基组成[8],其中α亚基起着催化作用,β和γ亚基则有着调节作用。α亚基N末端包含一个典型的丝/苏氨酸激酶结构域,Thr172位点是其活性调节位点,此位点的磷酸化是维持AMPKα活性所必需的,故p-AMPKα是其活性形式。β亚单位通过连接α和γ亚单位从而作为该复合物的结构核心。本实验检测肝脏内AMPKα和p-AMPKα的表达水平。
大量的研究说明,AMPK可通过减少血糖来源和增加血糖去向从而在糖代谢中起重要作用。Halse等[9]的研究证实AMPK可以通过促使细胞对葡萄糖的摄取和利用、抑制糖原的合成,进而促进葡萄糖向糖酵解方向转化,从而降低血糖浓度;另有研究发现雷帕霉素靶蛋白复合物2(target of rapamycin complex 2,TORC2)蛋白是一种调节转录因子的活性蛋白,其对调控肝脏的糖代谢起关键作用,而活化的AMPK能使TORC2处于磷酸化状态并滞留在细胞内,导致糖生成相关的酶表达受限,从而使糖生成减少;此外,Foretz等[10]的研究则表明活化的AMPK还可通过抑制果糖-1,6-二磷酸酶从而起到抑制糖异生的作用。最近研究发现脂联素是一种对抗糖尿病胰岛素抵抗的激素,它具有调节能量平衡、葡萄糖和脂肪代谢的作用。在2型糖尿病的发病过程中,血浆脂联素水平的下降与胰岛素抵抗的进展程度相平行,Shishodia等[11]认为其信号转导机制是通过激活AMPK起作用的。另外,Yamauchi等[12]证实,在肝脏中,脂联素是通过激活AMPK下调葡萄糖-6-磷酸酶,减少肝脏葡萄糖的输出,进而减轻肝脏胰岛素抵抗。
相关的研究表明,AMPK在脂代谢中也有重要的作用。羟甲基戊二酰CoA还原酶和乙酰CoA羧化酶分别是胆固醇和脂肪酸合成的关键酶,而且都是AMPK活化的重要底物。激活AMPK可使两者磷酸化而失活,从而分别抑制胆固醇和脂肪的合成。另外肉毒碱脂酰转移酶1是脂肪酸氧化的关键酶,丙二酰辅酶A是其生理性的抑制剂。AMPK激活后可使乙酰辅酶A羧化酶磷酸化失活,下调胞浆内丙二酰辅酶A的含量,解除其对肉毒碱脂酰转移酶1的抑制作用,促进细胞内脂肪酸的氧化供能。
此外,研究表明,AMPK也是改善肝脏纤维化的关键靶点。肝星状细胞向肌成纤维细胞转型的激活过程是肝纤维化形成的中心环节[13],激活的肝星状细胞大量增殖,合成分泌过多的胶原促使肝纤维化形成;然而,在肝纤维化逆转过程中伴随肝星状细胞的凋亡[14],因此诱导肝星状细胞的凋亡及阻止其激活增生也成为肝纤维化治疗的重要策略之一[15],最近研究结果也显示,AMPK表达可以诱导肝星状细胞株LX2发生凋亡[16],从而改善肝脏纤维化。
近些年来,大量研究提示姜黄素衍生物可以稳定血糖,改善糖尿病的代谢紊乱,在治疗和预防糖尿病方面有显著的疗效。本实验研究发现DM组和HF组大鼠血糖、血脂的大多指标都有显著升高,并都产生了胰岛素抵抗,肝细胞发生脂肪变性伴肝细胞坏死及不同程度纤维化,经B06干预后,DMT组和HFT组大鼠血糖指标及血脂主要指标均显著降低(少数没有显著差异的结果,都出现了相应的趋势,笔者考虑为姜黄素对不同指标的作用强度不同及样本例数的限制所致),肝脏形态学有明显改善;同时,DM组中肝组织AMPKα和p-AMPKα的表达均显著降低,提示AMPKα和p-AMPKα可能参与了2型糖尿病大鼠肝脏的纤维化、糖脂代谢异常和IR的发生,与文献报道一致,经B06干预后,DMT组AMPKα 和p-AMPKα的表达明显升高(HF组与NC组及HFT组与HF组组间比较,AMPK无显著差异,我们认为可能是HF组持续高脂喂养时间较短所致,只表现为降低或升高趋势),这说明B06可以激活肝组织AMPK,AMPK可能是其下游靶标之一,这与相关文献报道一致[17],但具体机制还待进一步研究。
综上所述,本实验说明了姜黄素衍生物B06可能通过调节肝脏内AMPKα及其活性从而达到改善大鼠肝脏纤维化、降血糖、降血脂和增加胰岛素敏感性的疗效。
[1]Parvathy KS,Negi PS,Srinivas P,et al.Antioxidant,antimutagenic and antibacterial activities of curcumin-βdiglucoside[J].Food Chem,2009,115(1):265-271.
[2]郑海红,苏志涛,肖艳,等.银杏叶提取物对2型糖尿病大鼠肝脏糖皮质激素受体表达的影响[J].中国病理生理杂志,2009,25(5):934-938.
[3]吴亮,吴晓烨,王环,等.2型糖尿病大鼠脑内11β-HSD1和GR的表达与认知功能的关系及棉酚的干预作用[J].中国病理生理杂志,2009,25(7):1336-1341.
[4]王蓉蓉,谢琳,吴晓晔,等.银杏叶提取物对实验性2型糖尿病大鼠肝脏的保护作用[J].中国病理生理杂志,2007,23(3):566-569.
[5]Tolman KG,Fonseca V,Tan MH,et al.Narrative review: hepatobiliary disease in type 2 diabetes mellitus[J].Amm Intern Med,2004,141(12):946-956.
[6]McGarry JD.Dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J].Diabetes,2002,51(1):7-18.
[7]俞盛,金建生.姜黄素对糖尿病及其微血管病变治疗研究的进展[J].医学综述,2007,13(19):1496-1498.
[8]Scott JW,Ross FA,Liu JK,et al.Regulation of AMP—activated protein kinase by a pseudesubstrate sequence on the gamma subunit[J].EMBO,2007,26(3):806-815.
[9]Halse R,Fryer LG,McCormaclc JG,et al.Regulation of glycogen synthase by glucose and glycogen:a possible role for AMP activated protein kinase[J].Diabetes,2003,52 (1):9-15.
[10]Foretz M,Ancellin N,Andreelli F,et al.Short-term overexpression of a constitutively active form of AMP-activated protein kinase in the Liver leads to mild hypoglycemia and fatty 1iver[J].Diabetes,2005,54(5):1331-1339.
[11]Shishodia S,Sethi G,Aggarwal BB.Curcumin:getting back to the roots[J].Ann N Y Acad Sci,2005,1056: 206-217.
[12]Yamauchi T,Kamon J,Minokoshi Y,et al.Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J].Nat Med,2002,8(11):1288-1295.
[13]Safadi R,Friedman SL.Hepatic fibrosis:role of hepatic stellate cell activation[J].MedGenMed,2002,4(3): 27.
[14]Iredale JP,Benyon RC,Pickering J,et al.Mechanisms of spontaneous resolution of rat liver fibrosis[J].J Clin Invest,1998,102(3):538-549.
[15]Gressner AM,Weiskirchen R.Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets[J].J Cell Mol Med,2006,10(1):76-99.
[16]张婧,谭丽,林骏,等.腺病毒介导AMPK激活的蛋白激酶的过表达诱导肝星状细胞株LX2凋亡[J].南方医科大学学报,2007,27(6):821-823.
[17]Lee HI,McGregor RA,Choi MS,et al.Low doses of curcumin protect alcohol-induced liver damage by modulation of the alcohol metabolic pathway,CYP2E1 and AMPK [J].Life Sci,2013,93(18-19):693-699.
Effect of curcumin derivative B06 on liver from type 2 diabetic rats
WANG Ling1,XU Meng-fei1,LIU Xi2,WANG Wei-wei3,CHEN San-mei4,CHENG Jinguo2,CHEN Guo-rong1
(1Department of Pathology,The First Affiliated Hospital,2The Second Affiliated Hospital,Wenzhou Medical University,Wenzhou 325015,China;3Department of Pathology,The Second Affiliated Hospital,Zhejiang University,Hangzhou 310000,China;4School of Medical Sciences,Shaoxing University,Shaoxing 312000,China.E-mail:chengr1978@ aliyun.com)
AIM:To observe the protective effect of curcumin derivative B06 on the liver from the rats with hyperlipidemia and type 2 diabetes mellitus.METHODS:Male Sprague-Dawley rats(n=35)were divided randomly into 5 groups:normal control group,high-fat group,high-fat+B06-treated group,diabetic group and diabetic+B06-treated group.After fed with a high-fat diet for 4 weeks,the rats in the later 2 groups were injected with streptozotocin intraperitoneally to induce type 2 diabetes mellitus.The rats in B06-treated groups were given B06 by gavage at a dose of 0.2 mg· kg-1·d-1for 8 weeks.After the treatment,the morphology of the liver was observed under light and transmission electron microscopes.The protein expression of AMP-activated protein kinase α(AMPKα)and phosphorylated AMPK α(p-AMPKα)was detected by Western blotting.RESULTS:Fatty degeneration,hepatocellular necrosis,inflammatory cell infiltration and hyperplasia of fibrous tissue were observed in the liver from the rats in high-fat group and diabetic group,and were relieved after B06 treatment.The protein expression of p-AMPKα was decreased in the liver of the rats in diabetic group and high-fat group,and it was increased in the liver of the high-fat and diabetic rats in B06-treated group.CONCLUSION:Curcumin derivative B06 exerts a protective effect on the liver in type 2 diabetic rats,and the increased expression of p-AMPKα may be involved in the mechanism of protection.
Diabetes mellitus;Hyperlipidemia;Curcumin derivative B06;Liver;AMP-activated protein kinase α;Rats
R587.1
A
10.3969/j.issn.1000-4718.2014.02.024
1000-4718(2014)02-0328-06
2013-10-23
2014-01-07
浙江省公益性技术应用研究计划项目(No.2011c23123);温州市高层次人才创新技术项目
△通讯作者Tel:0577-55579795;E-mail:chengr1978@aliyun.com
