2型糖尿病视网膜病变患者外周血单个核细胞中PEDF与TNF-α水平的变化*
2014-05-16吕秋菊唐喜香丘雅维曾可静穆攀伟陈燕铭曾龙驿
吕秋菊,唐喜香,丘雅维,曾可静,穆攀伟,陈燕铭,曾龙驿
(中山大学附属第三医院内分泌与代谢病科,广东广州 510630)
2型糖尿病视网膜病变患者外周血单个核细胞中PEDF与TNF-α水平的变化*
吕秋菊,唐喜香,丘雅维,曾可静,穆攀伟,陈燕铭△,曾龙驿
(中山大学附属第三医院内分泌与代谢病科,广东广州 510630)
目的:色素上皮衍生因子(PEDF)是影响糖尿病视网膜病变(DR)发生发展的重要因子,本研究观察2型糖尿病视网膜病变患者外周血单个核细胞(PBMCs)中PEDF、磷酸化NF-κB p65及TNF-α的表达,探讨DR的发病机制。方法:选取2011年10月~2013年4月在我院内分泌科住院确诊为2型糖尿病的患者(DM组)108例,并根据眼底造影结果将患者分为无糖尿病视网膜病变组(NDR组)52例和糖尿病视网膜病变组(DR组)56例,同期糖耐量实验正常者52例作为对照组(NC组)。密度梯度离心法收集患者PBMCs,提取总蛋白,Western blotting检测3组患者PBMCs中PEDF、磷酸化NF-κB p65和TNF-α蛋白表达水平,ELISA测定血浆PEDF与TNF-α水平,收集患者体检指标并测量患者生化指标。结果:Western blotting检测结果显示NDR组和DR组PEDF、磷酸化NF-κB p65和TNF-α蛋白水平明显高于NC组(P<0.05);DR组TNF-α蛋白水平明显高于NDR组(P<0.05),DR组PEDF及磷酸化NF-κB p65蛋白水平略高于NDR组,差异无统计学意义(P>0.05);NDR组和DR组血浆PEDF与TNF-α水平均明显高于NC组(P<0.05),DR组明显高于NDR组(P<0.05)。在糖尿病组,血浆PEDF水平与TNF-α及血尿酸水平呈正相关(r=0.39,r=0.25,P<0.05)。结论:本研究首次证实PBMCs中可表达PEDF;2型糖尿病患者PBMCs中PEDF表达水平增加,TNF-α及血浆PEDF的表达水平上调,PEDF可能通过与炎症因子TNF-α相互作用影响DR发生发展。
色素上皮衍生因子;外周血单个核细胞;糖尿病视网膜病
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症,是当今劳动适龄人口致盲的主要原因之一。明确DR发病机制对预防和控制DR有重要作用。近年来,大量研究认为,早期DR的发生发展与局部慢性低度炎症状态密切相关[1]。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)主要由单核细胞和淋巴细胞组成,在炎症反应中起重要作用。DR逐渐发生时,PBMCs炎症状态是否发生改变,目前报道甚少。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是一种分子量为50 kD的分泌型糖蛋白,其作用与DR发生过程中血管新生和炎症反应密切相关。PEDF主要由肝脏和脂肪细胞[2]分泌,在糖尿病及其并发症发生过程中起着重要作用,目前尚未见任何关于PBMCs分泌PEDF的报道。本研究旨在探讨DR患者与非糖尿病视网膜病变(non-diabetic retinopathy,NDR)患者外周血单个核细胞中PEDF、磷酸化核转录因子κB(phosphorylated nuclear factor κB,p-NF-κB)及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)蛋白表达的差异,为DR与炎症之间关系进行进一步深入的探讨提供线索。
材料和方法
1 研究对象及材料
1.1 对象选取我院2011年10月~2013年4月诊断为2型糖尿病(diabetes mellitus,DM)的患者108例,其中男55例,女53例,年龄(59.3±9.7)岁,糖尿病诊断符合WHO 1999年标准。根据眼底荧光血管照影和眼底检查结果,将糖尿病患者分为2组:糖尿病不合并视网膜病变患者(NDR组)52例,年龄(56.3±7.1)岁,糖尿病合并视网膜病变患者(DR 组)56例,年龄(62.2±10.9)岁。正常对照(normal control,NC)组选择体检健康者52例,男23例,女29例,年龄(56.4±11.8)岁,无心脏病、高血压,口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)排除糖尿病。研究对象均无明确的心、肝、肺及肾脏疾病,排除急、慢性感染性疾病及恶性肿瘤等。
1.2 材料与试剂Lymphoprep人淋巴细胞分离液购自达科为公司;细胞裂解液购自广州捷倍斯公司;蛋白酶抑制剂、磷酸酶抑制剂和BCA蛋白浓度测定试剂盒均购自Pierce;PVDF膜购自Millipore;兔抗人PEDF多抗购自Santa Cruz,兔抗人磷酸化NF-κB p65单抗、兔抗人TNF-α单抗和β-actin单抗均购自Cell Signaling Technology。荧光标记的羊抗兔II抗购自Odyssey。
2 方法
2.1 一般检查对所有受试者询问病史、家族史、吸烟史,测量血压、心率、身高、体重等,检测血常规和尿常规。
2.2 血浆PEDF及TNF-α水平检测血浆PEDF及TNF-α水平采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定,试剂盒购自Millipore和安迪生物科技上海有限公司,操作均严格按照试剂盒说明书的要求步骤进行。
2.3 Western blotting检测PBMCs中PEDF、TNF-α 和p-NF-κB p65(Ser536)蛋白水平收集病人清晨空腹静脉血3 mL,2 h内以Ficoll淋巴细胞分离液密度梯度离心法分离PBMCs,加入细胞裂解液后,4℃、16 000×g离心15 min取上清液即可得总蛋白,BCA法测蛋白浓度,配平蛋白浓度。每样品取15 μL上样,SDS-PAGE约2 h,用电转移法将蛋白转移至PVDF膜上,5%脱脂奶粉或5%BSA室温封闭2 h,加入兔抗人PEDF多抗、兔抗人p-NF-κB p65单抗、兔抗人TNF-α单抗或兔抗人β-actin单抗(1∶1 500) 4℃过夜。经荧光标记的羊抗兔II抗(1∶10 000)室温孵育1 h后洗膜,将膜置于Odyssey近红外光荧光扫描仪上进行扫描。以目的蛋白与β-actin条带吸光度值之比表示目的蛋白表达水平。
3 统计学处理
采用SPSS 13.0分析,计数资料用卡方检验,计量资料行正态性检验,符合正态分布的数据以均数±标准差(mean±SD)表示,非正态数据以中位数(第1四分位数,第3四分位数)[median(Q1,Q3)]表示。对于符合正态分布、方差齐的数据,组间比较采用单因素方差分析,相关性采用Pearson相关分析。对于非正态分布或方差不齐的数据,组间比较采用秩和检验,相关性采用Spearman相关分析。以P<0.05(双侧)为差异有统计学意义。
结果
1 临床基本资料
3组间患者性别及年龄差异无统计学意义(P>0.05);DR组血尿酸(serum uric acid,SUA)水平较NC组及NDR组高,差异有统计学意义(P<0.05); DR组和NDR组白细胞(white blood cell,WBC)计数较NC组高,差异有统计学意义(P<0.05),见表1。

表1 各组临床资料与实验室指标Table 1.Clinical and experimental characteristics among the three groups
2 PBMCs中p-NF-κB p65(Ser536)、PEDF和TNF-α蛋白的表达水平
PBMCs可表达p-NF-κB p65(Ser536)、PEDF和TNF-α蛋白。NDR组和DR组患者PBMCs中p-NF-κB p65(Ser536)蛋白水平显著高于NC组,差异有统计学意义(P<0.05);DR组患者PBMCs中p-NF-κB p65(Ser536)蛋白水平略高于NDR组,但差异无统计学意义(P>0.05)。NDR组及DR组患者PBMCs 中PEDF蛋白水平明显高于NC组,差异有统计学意义(P<0.05);DR组略高于NDR组,但差异无统计学意义(P>0.05)。NDR组及DR组患者PBMCs中TNF-α蛋白水平明显高于NC组,差异有统计学意义(P<0.05),DR组明显高于NDR组,差异有统计学意义(P<0.05),见图1。
3 血浆PEDF与TNF-α水平
血浆PEDF水平在NDR组[(2.46±0.71)mg/ L]和DR组[(2.82±0.62)mg/L]明显高于NC组[(2.04±0.65)mg/L],差异有统计学意义(P<0.05),DR组明显高于NDR组,差异有统计学意义(P<0.05)。血浆TNF-α水平在NDR组[(66.72± 21.18)ng/L]和DR组[(78.03±23.30)ng/L]明显高于NC组[(53.82±23.69)ng/L],差异有统计学意义(P<0.05),DR组明显高于NDR组,差异有统计学意义(P<0.05),见图2。
4 相关性分析
患者血浆PEDF水平与TNF-α及SUA水平均呈显著正相关(r值分别为0.39和0.25,P<0.05)。血浆PEDF水平与患者年龄无明显相关性。

Figure 1.Protein levels of p-NF-κB p65(Ser536),PEDF and TNF-α in PBMCs among the three groups.NC:normal control subjects(n=52);NDR:non-diabetic retinopathy patients(n=52);DR:diabetic retinopathy patients(n=56).Mean±SD.*P<0.05 vs NC group;#P<0.05 vs NDR group.图1 各组PBMCs中p-NF-κB p65(Ser536)、PEDF和TNF-α蛋白的表达水平
讨论
PEDF是1989年Tombran-Tink等[3]首次从胎儿视网膜色素上皮细胞培养液中提取出的一种蛋白因子,是由418个氨基酸构成的分泌性糖蛋白,分子量约50 kD,属于丝氨酸蛋白酶抑制剂超家族成员,但并不具有抑制剂活性。PEDF是血管内皮生长因子(vascular endothelial growth factor,VEGF)的拮抗因子,除了其强烈的抗血管新生作用[4]之外,其抗炎作用也逐渐受到重视[2,5]。Zhang等[6]的研究发现,糖尿病视网膜病变及氧诱导的视网膜病变小鼠玻璃体内注射PEDF后,炎症因子水平如VEGF、TNF-α、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)、细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)等均下降,而小分子RNA干扰PEDF表达后,炎症因子水平上升。近年多项研究提示,DR的发生发展与慢性炎症密切相关[7]。PBMCs主要由单核细胞和淋巴细胞组成,T淋巴细胞激活,可直接损伤胰岛细胞,促发1型糖尿病[8];过度肥胖时,单核细胞激活后转化为巨噬细胞,聚集到脂肪组织释放如TNF-α、白细胞介素6 (interleukin-6,IL-6)等炎症介质,介导和参与炎症反应,引起胰岛素抵抗,逐渐进展为2型糖尿病。随着炎症介质刺激的累积,视网膜血管损伤、增生,进而发展为视网膜病变[9]。因此,PBMCs是研究糖尿病发生机制的重要对象。本研究首次发现,PEDF可表达于人PBMCs,并在糖尿病患者PBMCs中明显增高,且DR组高于NDR组。同时DR组和NDR组血浆PEDF水平明显高于NC组,与PBMCs蛋白表达水平趋势一致,但DR组血浆PEDF水平明显高于NDR组,可能由于血浆中PEDF是所有分泌器官分泌PEDF的总和,PBMCs分泌的PEDF量只占其中一部分,因此差异不如血浆PEDF变化显著。另2项日本的人群研究发现[10-11],NDR组血清PEDF与NC组及DR组差异不明显,可能是2项研究中NDR组的样本量均较少(<18例)有关。结合我们的研究分析,PBMCs是分泌PEDF的重要器官,其PEDF分泌量的变化可能影响血浆PEDF浓度,并随着糖尿病并发症的发生而逐渐升高。这提示血浆PEDF在2型糖尿病组尤其糖尿病视网膜病变组明显增高可能预示糖尿病视网膜病变的发生发展。
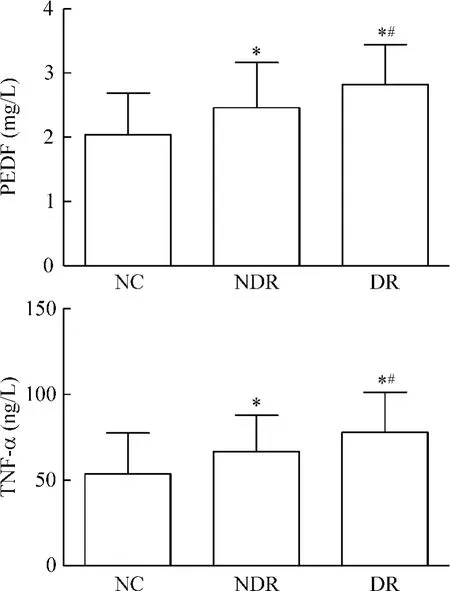
Figure 2.Levels of PEDF and TNF-α in plasma among the three groups.NC:normal control subjects(n=52);NDR: non-diabetic retinopathy patients(n=52);DR:diabetic retinopathy patients(n=56).Mean±SD.*P<0.05 vs NC group;#P<0.05 vs NDR group.图2 各组血浆PEDF和TNF-α水平
NF-κB p65是核转录因子蛋白NF-κB的亚基,在炎症反应中起重要作用,以二聚体的形式与其抑制因子IκB结合以无活性的形式存在于胞浆中,炎症、营养过剩、内质网应激等多种因素激活NF-κB p65,激活的NF-κB p65进入细胞核,增强多种炎症因子如TNF-α、IL-1、IL-6、干扰素γ(interferon-γ,IFN-γ)的转录和表达,而产生的细胞因子如TNF-α反过来激活NF-κB p65,形成正反馈,增强炎症反应[12]。研究发现,新诊断2型糖尿病患者PBMCs中p-NF-κB p65蛋白表达水平明显高于正常对照组[13]。本研究进一步发现糖尿病患者PBMCs中p-NF-κB p65 和TNF-α蛋白表达水平在DR组高于NDR组。TNF-α主要由单核-巨噬细胞分泌,而单核细胞是PBMCs的主要组成部分,PBMCs激活时TNF-α分泌增多。我们前期的研究发现,DR患者血清TNF-α水平较NDR患者明显升高[14],与本实验PBMCs中TNF-α趋势相同,提示DR患者较NDR患者处于更严重的炎症状态,这种炎症状态的加重可能与PBMCs激活有关。
本研究还发现,血浆PEDF水平与TNF-α及SUA呈正相关。其中,TNF-α是重要的炎症介质[15],尿酸被认为与慢性低度炎症呈正相关[16]。本研究结果提示血浆PEDF可能随炎症程度的加重而升高。
糖尿病是一种慢性炎症性疾病,随着长期高糖刺激,糖尿病患者微血管结构和功能发生改变,逐步发展为DR。多项研究提示炎症参与了DR的发病机制。本研究中,随着DR的发生,PBMCs中炎症转录因子p-NF-κB p65及炎症因子TNF-α蛋白表达水平升高,提示PBMCs炎症状态的改变可能与DR的发生发展有关,而这种炎症状态的改变可能是由于各种因素如长期高糖、血糖波动、缺血缺氧等刺激PB-MCs中NF-κB p65磷酸化激活炎症通路引起的;PBMCs中PEDF表达随TNF-α的上升而增高,可能是炎症激活某种通路的结果,具体的作用机制尚需进一步研究。同时,血浆PEDF水平升高,与具促炎效应的SUA及TNF-α呈正相关,说明PEDF与炎症关系密切。但其在糖尿病视网膜病变发病过程中与炎症的关系尚不明确。多项研究表明,PEDF具有抗炎作用,PEDF过表达转基因小鼠研究发现,高氧诱导缺血性视网膜病变和激光诱导视网膜病理血管增生时,转基因小鼠视网膜缺血缺氧程度及炎症因子表达水平均明显低于野生型小鼠[17],而PEDF基因敲除小鼠则出现相反的表现[18],提示PEDF通过抑制炎症及视网膜血管新生延缓视网膜病变的发生发展。而一些临床研究结果表明,PEDF与血清炎症因子水平呈正相关[19],可能是由于机体的代偿反应机制,即DR期炎症因子分泌的增加引起机体对PEDF需求量增加,从而代偿性升高以拮抗炎症反应。而DR发生时,由于视网膜血管闭塞及缺血,导致视网膜局部血流减少,致视网膜PEDF量下降。PBMCs在此过程中可能起着重要作用,其主要成分单核细胞在活化时可到达视网膜局部释放PEDF,抑制视网膜病变的发展。而视网膜局部血流量下降时,所能激活的PBMCs数量有限,导致视网膜局部PEDF水平下降。这可能是DR患者视网膜局部PEDF减少而外周血PEDF升高的原因。但引起外周血PEDF增高的具体机制及PEDF与NF-κB p65活化及TNF-α之间的因果关系尚需进行下一步深入研究。
[1]Cheung N,Mitchell P,Wong TY.Diabetic retinopathy [J].Lancet,2010,376(9735):124-136.
[2]Crowe S,Wu LE,Economou C,et al.Pigment epithelium-derived factor contributes to insulin resistance in obesity[J].Cell Metab,2009,10(1):40-47.
[3]Tombran-Tink J,Johnson LV.Collagen-induced alterations in intercellular adhesion and antigen expression in retinoblastoma cells[J].Exp Eye Res,1989,48(4): 549-559.
[4]李涛,李加青,罗燕,等.重组色素上皮衍生因子对人视网膜微血管内皮细胞迁移及凋亡的影响[J].中国病理生理杂志,2010,26(11):2240-2245.
[5]Filleur S,Nelius T,de Riese W,et al.Characterization of PEDF:a multi-functional serpin family protein[J].J Cell Biochem,2009,106(5):769-775.
[6]Zhang SX,Wang JJ,Gao G,et al.Pigment epitheliumderived factor(PEDF)is an endogenous antiinflammatory factor[J].FASEB J,2006,20(2):323-325.
[7]Goldberg RB.Cytokine and cytokine-like inflammation markers,endothelial dysfunction,and imbalanced coagulation in development of diabetes and its complications [J].J Clin Endocrinol Metab,2009,94(9):3171-3182.
[8]Mallone R,Mannering SI,Brooks-Worrell BM,et al.Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive T cell responses: position statement of the T-Cell Workshop Committee of the Immunology of Diabetes Society[J].Clin Exp Immunol,2011,163(1):33-49.
[9]Adamis AP.Is diabetic retinopathy an inflammatory disease?[J].Br J Ophthalmol,2002,86(4):363-365.
[10]Ogata N,Matsuoka M,Matsuyama K,et al.Plasma concentration of pigment epithelium-derived factor in patients with diabetic retinopathy[J].J Clin Endocrinol Metab,2007,92(3):1176-1179.
[11]Matsuyama K,Ogata N,Matsuoka M,et al.Relationship between pigment epithelium-derived factor(PEDF)and renal function in patients with diabetic retinopathy[J].Mol Vis,2008,14:992-996.
[12]Baker RG,Hayden MS,Ghosh S.NF-κB,inflammation,and metabolic disease[J].Cell Metab,2011,13(1): 11-22.
[13]石秀林,李芳萍,蔡梦茵,等.新诊断2型糖尿病患者血清炎症因子及外周血单个核细胞中核因子κB活性变化[J].中山大学学报:医学科学版,2006,27(3): 266-270.
[14]陈燕铭,王一娜,钟毅敏,等.2型糖尿病视网膜病变患者血清炎症因子和脂联素水平的变化[J].中国病理生理杂志,2011,27(6):1154-1158.
[15]范琰琰,叶光华,林刻智,等.α7nAChR的激活通过抑制TNF-α表达促进糖尿病小鼠伤口愈合[J].中国病理生理杂志,2013,29(6):1053-1058.
[16]Coutinho T de A,Turner ST,Peyser PA,et al.Associations of serum uric acid with markers of inflammation,metabolic syndrome,and subclinical coronary atherosclerosis[J].Am J Hypertens,2007,20(1):83-89.
[17]Park K,Jin J,Hu Y,et al.Overexpression of pigment epithelium-derived factor inhibits retinal inflammation and neovascularization[J].Am J Pathol,2011,178(2): 688-698.
[18]Huang Q,Wang S,Sorenson CM,et al.PEDF-deficient mice exhibit an enhanced rate of retinal vascular expansion and are more sensitive to hyperoxia-mediated vessel obliteration[J].Exp Eye Res,2008,87(3):226-241.
[19]Umei H,Yamagishi SI,Imaizumi T.Positive association of serum levels of pigment epithelium-derived factor with high-sensitivity C-reactive protein in apparently healthy unmedicated subjects[J].J Int Med Res,2010,38 (2):443-448.
Levels of PEDF and TNF-α in PBMCs of type 2 diabetic retinopathy patients
LÜ Qiu-ju,TANG Xi-xiang,QIU Ya-wei,ZENG Ke-jing,MU Pan-wei,CHEN Yanming,ZENG Long-yi
(Department of Endocrinology&Metabolism,The Third Affiliated Hospital,Sun Yat-sen University,Guangzhou 510630,China.E-mail:yanmingch@tom.com)
AIM:To investigate the roles of pigment epithelium-derived factor(PEDF),phosphorylated NF-κB p65 and TNF-α in peripheral blood mononuclear cells(PBMCs)in diabetic retinopathy(DR)patients.METHODS:Fifty-two healthy persons were enrolled in the study as normal control group(NC group).Type 2 diabetic patients served as DM group(n=108),which were sub-divided into non-diabetic retinopathy group(NDR group,n=52)and diabetic retinopathy group(DR group,n=56)by angiography.The PBMCs were isolated by the technique of density-gradient centrifugation.The protein levels of PEDF,phosphorylated NF-κB p65 and TNF-α in the PBMCs were determined by Western blotting.The levels of plasma PEDF and TNF-α were detected by ELISA.The content of serum uric acid(SUA)and white blood cell count were measured.RESULTS:The levels of PEDF,TNF-α and phosphorylated NF-κB p65 in the PBMCs were statistically higher in NDR group and DR group than those in control group.The level of TNF-α increased significantly in DR group as compared with NDR group.The levels of PEDF and phosphorylated NF-κB p65 were slightly but not significantly higher in DR group than those in NDR group.The plasma levels of PEDF and TNF-α were evidently elevated in NDR group and DR group compared with NC group,and those were obviously higher in DR group than those in NDR group.In the diabetic patients,the plasma level of PEDF was positively correlated with the levels of TNF-α(r=3.39,P<0.05) and SUA(r=0.25,P<0.05).CONCLUSION:The expression of PEDF in PBMCs is markedly increased,accompanied with the elevation of phosphorylated NF-κB p65 and TNF-α in type 2 diabetic patients especially with DR,suggesting that PEDF is possibly involved in the development of DR by inflammatory mechanism.
Pigment epithelium-derived factor;Peripheral blood mononuclear cells;Diabetic retinopathy
R363
A
10.3969/j.issn.1000-4718.2014.02.020
1000-4718(2014)02-0308-05
2013-09-26
2013-12-30
广东省科技计划(No.2011B031800155);广东省自然科学基金资助项目(No.S2011010004811)
△通讯作者Tel:020-85253408;E-mail:yanmingch@tom.com
