甘氨双唑钠协同顺铂有效促进肺腺癌细胞中p21表达*
2014-05-16廖小方赵中洪郭绍文彭政朱小平王燕邹燕胡伟
廖小方,赵中洪,郭绍文,彭政,朱小平,王燕,邹燕,胡伟
(1浙江省中医药大学附属衢州中心医院放疗科,浙江衢州 324000;2上海中医药大学附属曙光医院,上海 200130)
甘氨双唑钠协同顺铂有效促进肺腺癌细胞中p21表达*
廖小方1△,赵中洪1,郭绍文2,彭政1,朱小平1,王燕1,邹燕1,胡伟1
(1浙江省中医药大学附属衢州中心医院放疗科,浙江衢州 324000;2上海中医药大学附属曙光医院,上海 200130)
目的:探讨甘氨双唑钠(CMNa)协同顺铂对肺腺癌细胞中p21表达的影响及其分子机制。方法:使用NCBI公共数据库分析顺铂对人肺腺癌细胞作用的mRNA芯片数据,寻找差异基因;对人肺腺癌A549细胞系用CMNa和顺铂处理,用real-time PCR技术验证A549细胞系差异基因的表达;用RT-PCR及染色质免疫沉淀技术进一步检测CMNa对p21及其上游分子p53表达的影响。结果:通过参考公共数据库中顺铂处理A549细胞系的mRNA芯片数据,对若干差异表达基因进行实验验证,发现p21受顺铂影响最为显著;CMNa联合顺铂处理可以有效促进A549细胞系p21的表达,但对A549细胞系单纯进行CMNa处理,p21无明显变化。此外,通过染色质免疫沉淀检测发现,CMNa联合顺铂处理可增加上游分子p53的表达,从而引起p21的上调。结论:CMNa可以协同顺铂上调p53表达,从而促进人肺腺癌细胞p21的表达,这提示CMNa对肺腺癌细胞的放疗增敏作用可能还有新的作用机制。
甘氨双唑钠;顺铂;肺肿廇;p21蛋白;p53蛋白
肺腺癌属于非小细胞性肺癌(non-small cell lung carcinoma,NSCLC),Ⅲ期非小细胞性肺癌治疗效果至今尚不理想,单纯放疗5年生存率只有5%左右,单纯化疗5年生存率只有0~3%,肿瘤中心存在乏氧细胞对放射抗拒是治疗失败的主要原因之一,因此寻找更好的放疗增敏剂是常见的策略。目前临床上主要使用的放射增敏剂之一是硝基咪唑类药物,其中由我国自主研发的甘氨双唑钠(sodium glycididazole,CMNa)已经证实对肺癌、鼻咽癌、食管癌等均有较好的放射增敏作用[1-3],尤其是其联合顺铂在治疗非小细胞性肺癌中,确实有明显的放疗增敏作用。CMNa对放疗的增敏效应主要是通过亲电子作用对受损肿瘤细胞进行亲合,固定损伤;另一方面还可以抑制DNA聚合酶β(DNA polymerase β,Polβ)对肿瘤细胞中受损DNA进行修复[4]。
顺铂是细胞周期非特异性药物,能与射线作用在肿瘤细胞的不同亚群,同时能干扰细胞周期的进程,在p53被抑制的肿瘤中,调控细胞周期主要由p21来完成,它是近年来研究细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)抑制家族中的重要成员,受p53正调控,可以对DNA复制引起的损伤进行监测,阻滞细胞周期,从而达到细胞增殖抑制的效果。
目前CMNa在国外研究甚少,大部分都是阐述其对放疗增敏具有一定作用,但对其化疗增敏方面的研究却不多[5],另外CMNa提高增敏作用的机制又是如何呢。本文从NCBI GEO Datasets数据库(编号为GDS3101)有关顺铂诱发的非小细胞肺癌基因mRNA表达芯片分析结果中选出CDK抑制蛋白1A CDK(inhibitor 1A,CDKN1A;即p21)、sestrin 1 (SESN1)、Fas、铁氧还蛋白还原酶(ferredoxin reductase,FDXR)和镁/锰离子依赖的蛋白磷酸酶1D (proteinphosphatase1D,Mg2+/Mn2+-dependent,PPM1D)等5个差异表达基因作为研究对象,它们参与DNA损伤、细胞周期、细胞凋亡等调控。然后通过CMNa与顺铂联合处理A549肺腺癌细胞,进一步验证CMNa与顺铂的联合作用下对这些差异表达基因的影响,从而推测CMNa可能涉及到的对肿瘤细胞治疗的机制。所选的这5个基因在顺铂处理后的表达改变以及GO分析结果见表1。
材料和方法
1 材料
2 细胞培养
A549细胞均在5%CO2、37℃的加湿孵箱中培养,培养基为含有10%胎牛血清的DMEM(Gibco)培养基。
3 药物处理
取对数生长期A549细胞接种于96孔培养板中,每孔细胞数为1×103培养12 h后,顺铂终浓度10 mg/L[6]与CMNa终浓度1 mmol/L培养96 h[1],每组样本5个复孔。
4 Real-time PCR检测
p21 real-time PCR上游引物5’-TGGCACCTCACCTGCTCTG-3’,下游引物5’-CCACCTGGGGACCCTTCA-3’;p21 ChIP检测上游引物5’-TTGGGCAGCAGGCTGTGGCTC-3’,下游引物5’-GATCCCAGCCCTGTCGCAAGG-3’[7];p53上游引物5’-AGATTCAGAACGGCTCCTCG-3’,下游引物5’-GGGCACCGCTTCACCA-3’;GAPDH上游引物5’-AGAAGGCTGGGGCTCATTTG-3’,下游引物5’-AGGGGCCATCCACAGTCTTC-3’。Real-time反应条件:95℃30 s后,95℃5 s,60℃30 s,40个循环。RT-PCR反应条件:95℃30 s后,95℃5 s,60℃30 s,28个循环。
5 Western blotting检测
细胞裂解提取蛋白后,用SDS-PAGE胶电泳分离,转移至PVDF膜上,5%脱脂奶粉室温下封闭2 h,I抗(p21、p53和GAPDH均为1∶1 000稀释)孵育过夜,HRP标记的II抗室温孵育1 h,后按试剂盒说明操作。
6 细胞周期检测
pCDH/HSP27组和阴性对照组U266细胞用终浓度为0、5、10、20、40和80 nmol/L的BTZ处理8 h后,蛋白酶体活性检测结果(图8)显示,随着BTZ浓度的递增,2组U266细胞中20S蛋白酶体的活性均被抑制;在10、20、40和80 nmol/L BTZ浓度组中,pCDH/HSP27组U266细胞中20S蛋白酶体的活性均明显高于阴性对照组(P值均<0.05)。这一结果表明,HSP27表达上调可减弱BTZ对骨髓瘤细胞蛋白酶体活性的抑制。
收集正常、顺铂单独处理和CMNa与顺铂联合处理的悬浮及贴壁A549细胞。制备成单细胞悬液,加入70%乙醇,4℃固定过夜。于次日漂洗2遍,加入50 mg/L RNA酶A。37℃孵育1 h,加入50 mg/L的碘化丙啶,4℃避光1 h,上流式细胞仪进行细胞周期分析。选用FL2-H-PI通道,激发波长为488 nm。
7 ChIP检测
将种有1×106细胞数目的培养皿倒去培养液,用1%甲醛-PBS溶液20 mL室温固定10 min,加入1×等体积的glycine-PBS溶液终止固定。PBS冲洗2遍,加入1 mL含有0.5%PMSF的shearing液(新鲜配制),冰上超声处理(工作时间10 s,静置时间30 s,30个循环,功率200 W)。离心取上清得到DNA蛋白混合液(input),与p53 I抗/IgG、磁珠及苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)一起4℃孵育过夜,次日对反应体系进行解交联,去除磁珠,将input进行酚氯仿抽提,乙醇沉淀,对p21启动子序列进行real-time PCR检测。通过Ct值的高低来评估p53与p21启动子结合的情况。
8 统计学处理
应用SPSS 15.0统计软件分析,数据以均数±标准差(mean±SD)表示,两组样本比较采用t检验,多组样本比较采用方差分析。以P<0.05为差异有统计学意义。
结果
1 验证芯片中得到的差异表达基因确实在顺铂处理的A549细胞中有高表达
对A549细胞系进行10 mg/L顺铂处理,培养96 h以后,发现细胞数目明显减少,见图1;另外检测了所得差异基因的mRNA表达水平,我们发现这些基因表达水平经顺铂处理而升高,其中p21表达水平最为显著,见图2。这与此前研究报道一致[8-9],同时也证明芯片的数据结果可靠。
2 CMNa与顺铂联合处理A549细胞系后能有效提高p21的表达
联合终浓度1 mmol/L CMNa处理A549细胞后检测mRNA水平,对比顺铂单独处理组,p21与PPM1D表达升高,且p21上调更为显著,见图3。同时p21蛋白水平也在CMNa联合顺铂处理后有明显的上调,但是单独用CMNa处理A549细胞,则p21表达与阴性对照无明显变化,见图4,这提示CMNa引起A549细胞p21表达上调需要在顺铂的支持下。

Figure 1.The A549 cells without cisplatin treatment(A)and treated with 10 mg/L cisplatin(B).Magnification: ×40.图1 未作处理的A549细胞系及用10 mg/L顺铂处理的A549细胞系
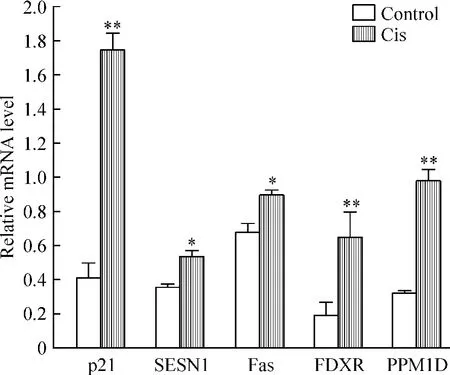
Figure 2.The expression of candidate genes in A549 cells treated with cisplatin(Cis)or not.Mean±SD.n=6.*P <0.05,**P<0.01 vs control.图2 候选基因在顺铂处理与未处理的A549细胞中的表达
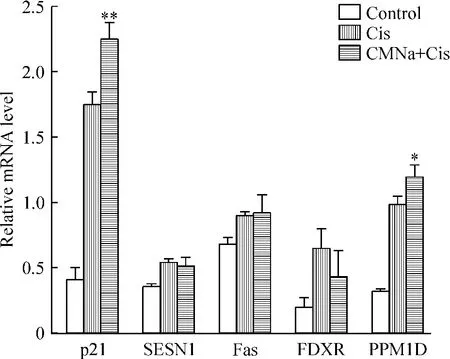
Figure 3.The expression of candidate genes in A549 cells treated with cisplatin(Cis)and CMNa.Mean±SD.n= 6.*P<0.05,**P<0.01 vs control.图3 候选基因在甘氨双唑钠联合顺铂处理的A549细胞中的表达
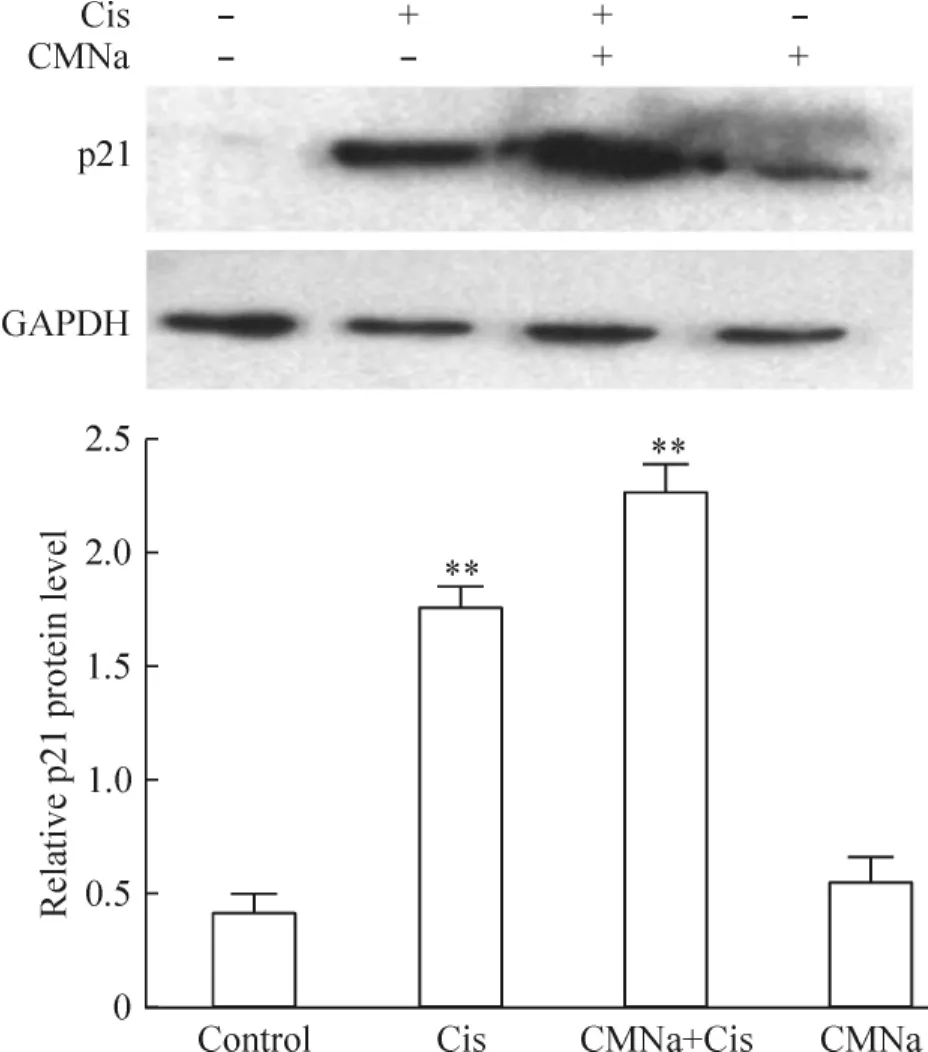
Figure 4.p21 protein expression in A549 cells treated with cisplatin(Cis)and CMNa.Mean±SD.n=6.**P<0.01 vs control.图4 p21蛋白在顺铂和CMNa处理的A549细胞中的表达
3 CMNa与顺铂联合处理可以提高p53的表达,从而介导p21的上调
CMNa与顺铂联合处理A549细胞发现CMNa可有效增加p53的表达,见图5A;接着我们检测了p21 的5’端区域上p53的结合情况,也发现了p53蛋白水平升高,从而激活了下游p21的转录表达,图5B。
4 CMNa与顺铂联合处理,可以有效促进A549细胞G1/S期阻滞
CMNa与顺铂联合处理的A549细胞比单独顺铂作用的A549细胞G1期细胞明显减少,S期细胞则明显增加,但G2/M期细胞数目变化无显著差异,见图6、表2。这说明CMNa与顺铂联合处理可以有效调控p21介导的G1/S期阻滞。
讨论
临床研究表明,以铂类为基础的多药物联合方案对晚期NSCLC有益[10],但其疗效仍然不理想,文献数据显示其客观有效率为25%~45%,1年生存率仅为40%~50%[11-12]。因此如何有效增加NSCLC化疗敏感性,已成为临床上一重要策略。目前顺铂用于肿瘤治疗的机制主要就是对肿瘤细胞周期进行调控[13],可以引起G1期的阻滞[14],也可以引起G2/M期的阻滞[15]。而在睾丸癌中发现,顺铂促进下游转录起始点p21的激活依赖p53表达的提高[16]。因此其它药物联合顺铂的化疗方案中,对顺铂介导的肿瘤细胞通路、分子网络等必然存在进一步促进作用。
CMNa是一种高效低毒的硝基咪唑类放疗增敏剂,它本身无抗癌作用,单独对A549处理CMNa也证实了这一点。CMNa作为肿瘤放化疗增敏剂的机制主要包括两方面,一是通过特异性转移肿瘤中乏氧细胞受损分子的电子,从而固定治疗靶点,来增强治疗效果[17];二是通过抑制Polβ,抑制肿瘤细胞中DNA分子的修复,从而提高化疗效果[5]。本文证实了CMNa与顺铂联合作用下,可以通过介导上调p53表达,从而促进p21的表达。那么CMNa对肿瘤细胞增敏作用很有可能一方面是通过对肿瘤细胞中受损DNA分子进行固定,参与依赖p53途径的DNA损伤反应,促进p21的表达,通过抑制CDK复合物及增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)[18],从而提高顺铂对细胞周期的阻滞效应,引起G1/S期阻滞;另一方面又抑制Polβ介导的碱基切除修复。这两方面的作用下大大提高了顺铂对肿瘤细胞的杀伤作用。然而,CMNa如何协同顺铂有效杀伤肿瘤细胞的具体分子机制有待进一步考察。
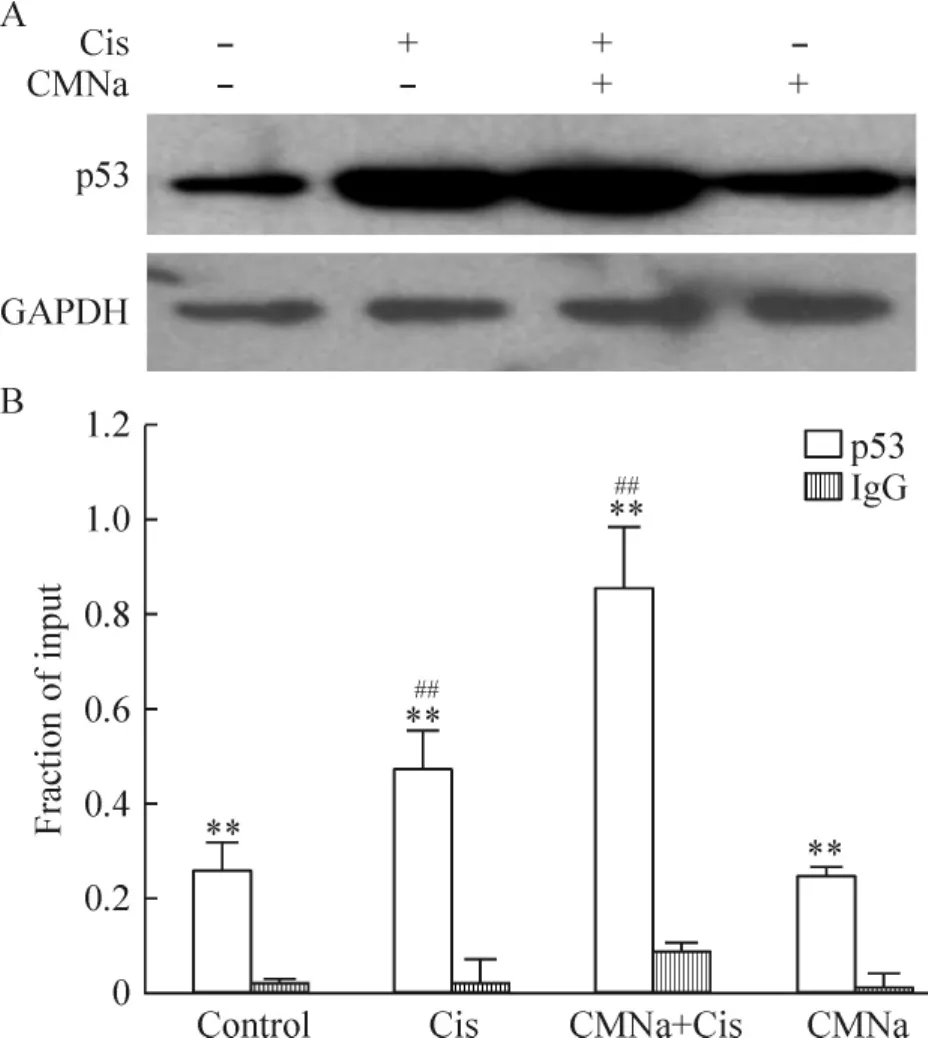
Figure 5.p53 expression in A549 cells treated with cisplatin orcombination of CMNa and cisplatin(Cis).A:the protein level of p53;B:p53 protein binding in 5’region of p21 sequence.IgG is a negative control.Mean± SD.n=4.**P<0.01 vs IgG;##P<0.01 vs control.图5 在顺铂处理的A549细胞和顺铂与CMNa联合处理的A549细胞p53蛋白的表达
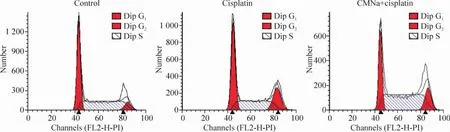
Figure 6.Cell cycle detection in A549 cells treated with cisplatin or combination of CMNa and cisplatin by FACS analysis.图6 顺铂处理的A549细胞和顺铂与CMNa联合处理的A549细胞细胞周期的变化
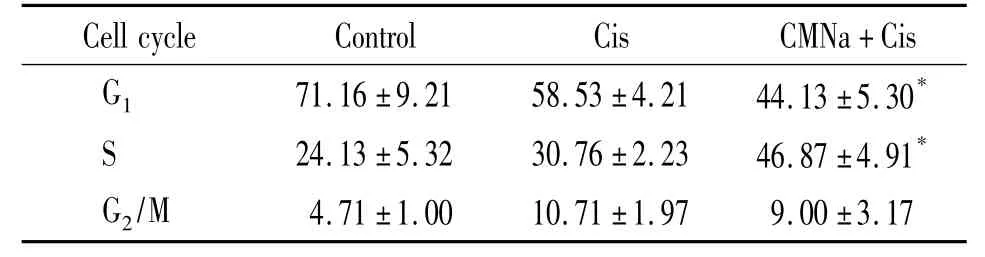
表2 CMNa与顺铂联合处理与单独顺铂处理对A549细胞细胞周期的影响Table 2.The cell cycle distribution comparison between CMNa with cisplatin group and cisplatin group(%.Mean± SD.n=3)
[1]张霞,季洪兵,陈忠华,等.甘氨双唑钠对肺癌体内外放射治疗的增敏作用[J].福州总医院学报,2006,13 (3):166-167,170.
[2]夏广荣,刘桂梅,靳国华,等.甘氨双唑钠放射增敏作用的临床研究[J].中华放射医学与防护杂志,2006,26 (5):470-472.
[3]张福正,邹勤舟,赵涤非,等.CMNa在鼻咽癌放疗中增敏作用的临床研究[J].中国肿瘤临床与康复,2006,13 (6):554-556.
[4]郑秀龙,高建国,杨立锡.甲硝唑氨酸(CM)对受照相对密度生长期V79细胞DNA聚合酶β的抑制与放射增强作用间的关系[J].辐射研究与辐射工艺学报,1992,10 (4):198-202.
[5]袁志军,罗以,王倩之,等.甘氨双唑钠对晚期非小细胞肺癌化疗的增敏作用[J].肿瘤防治研究,2009,36 (7):606-608.
[6]陈卫强,戚好文,吴昌归,等.双氢青蒿素和顺铂诱导人肺腺癌A549/CDDP细胞凋亡[J].现代肿瘤医学,2007,15(5):616-619.
[7]黄倩,陶勇浩.多种恶性肿瘤p21基因启动子及编码区点突变的检测[J].中华医学遗传学杂志,2000,17 (3):169-172.
[8]Wei J,Zhao J,Long M,et al.p21WAF1/CIP1 gene transcriptional activation exerts cell growth inhibition and enhances chemosensitivity to cisplatin in lung carcinoma cell[J].BMC Cancer,2010,10:632.
[9]李占亭,师建国,卫军霞,等.运用saRNA激活p21基因表达上调对肺癌细胞生长及化疗敏感性的影响[J].现代肿瘤医学,2012,20(1):14-18.
[10]Non-small cell lung cancer collaborative group.Chemotherapy in non-small cell lung cancer:a meta-analysis using updated data on individual patients from 52 randomised clinical trials[J].BMJ,1995,311(7010):899-909.
[11]Kosmidis P,Mylonakis N,Nicolaides C,et al.Paclitaxel plus carboplatin versus gemcitabine plus paclitaxel in advanced non-small-cell lung cancer:a phase III randomized trial[J].J Clin Oncol,2002,20(17):3578-3585.
[12]Paccagnella A,Oniga F,Bearz A,et al.Adding gemcitabine to paclitaxel/carboplatin combination increases survival in advanced non-small-cell lung cancer:results of a phase II-III study[J].J Clin Oncol,2006,24(14):681-687.
[13]Yadav V,Sultana S,Yadav J,et al.Gatifloxacin induces S and G2-phase cell cycle arrest in pancreatic cancer cells via p21/p27/p53[J].Plos One,2012,7(10):e47796.
[14]亓放,张宝泉,徐炎,等.顺铂诱导的喉癌细胞凋亡及其对细胞周期的影响[J].中华医学杂志,1999,79 (4):298-301.
[15]Chen H,Landen CN,Li Y,et al.Enhancement of cisplatin-mediated apoptosis in ovarian cancer cells through potentiating G2/M arrest and p21 upregulation by combinatorial peigallocatechin gallate and sulforaphane[J].J Oncol,2013,2013:872957.
[16]di Pietro A,Koster R,Boersma-van Eck W,et al.Proand anti-apoptotic effects of p53 in cisplatin-treated human testicular cancer are cell context-dependent[J].Cell Cycle,2012,11(24):4552-4562.
[17]邱娇娇,佐满珍.甘氨双唑钠和塞来昔布联合同步放化疗对宫颈癌细胞的影响[J].武汉大学学报:医学版,2011,32(5):615-618.
[18]粟厚仪,梁立治.细胞周期调控基因p21WAF1/CIP1与肿瘤[J].国外医学:肿瘤学分册,1998,25(6):323-326.
Sodium glycididazole combined with cisplatin efficiently promotes p21 expression in lung adenocarcinoma
LIAO Xiao-fang1,ZHAO Zhong-hong1,GUO Shao-wen2,PENG Zheng1,ZHU Xiao-ping1,WANG Yan1,ZOU Yan1,HU Wei1
(1Department of Radiotherapy,Quzhou Central Hospital Affiliated to Zhejiang Province University of Traditional Chinese Medicine,Quzhou 324000,China;2Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200130,China.E-mail:xiaof_cun@126.com)
AIM:To investigate the effect of sodium glycididazole(CMNa)on the sensitivity of lung adenocarcinoma to cisplatin.METHODS:The microarray data of human lung adenocarcinoma A549 cells treated with cisplatin from NCBI public database were reanalyzed for searching the genes with significantly differential expression.The A549 cells were used in the study and treated with CMNa+cisplatin.The expression levels of the verified candidate genes from database searching were detected by real-time PCR.The role of CMNa in the expression of p21 and its upstream target p53 was also determined.RESULTS:A list of candidate genes from the microarray dataanalysis was obtained,in which p21 was verified in A549 cell line treated with cisplatin by database searching and analyzing.A549 cells were treated with CMNa and cisplatin,and p21 expression was enhanced in the cells treated with CMNa+cisplatin but not CMNa alone.In addition,enhanced p21 expression in A549 cells treated with CMNa+cisplatin was mediated by promotion of the upstream p53 level.CONCLUSION:CMNa co-operates with cisplatin to improve p21 expression in human lung adenocarcinoma,which is mediated through enhancement of the p21 upstream target p53,indicating another new insight of CMNa function in radiosensitivity of human lung adenocarcinoma.
Sodium glycididazole;Cisplatin;Lung neoplasms;p21 protein;p53 protein
R363
A
10.3969/j.issn.1000-4718.2014.02.011
1000-4718(2014)02-0256-06
2013-07-28
2013-12-23
浙江省卫生厅基金资助项目(No.2010kyA194)
△通讯作者Tel:0570-3023071;E-mail:xiaof_cun@126.com
