隔核ghrelin对糖尿病胃动力障碍大鼠胃运动影响及下丘脑弓状核的潜在调控机制*
2014-05-16闫长虹高胜利郭菲菲孙向荣公衍玲
闫长虹, 徐 珞, 高胜利, 郭菲菲, 孙向荣, 公衍玲
(1青岛大学医学院病理生理教研室,山东青岛 266021;2菏泽医学专科学校,山东菏泽 274099;3青岛科技大学化工学院,山东青岛 266042)
隔核ghrelin对糖尿病胃动力障碍大鼠胃运动影响及下丘脑弓状核的潜在调控机制*
闫长虹1,2, 徐 珞1△, 高胜利1, 郭菲菲1, 孙向荣1, 公衍玲3
(1青岛大学医学院病理生理教研室,山东青岛 266021;2菏泽医学专科学校,山东菏泽 274099;3青岛科技大学化工学院,山东青岛 266042)
目的:研究隔核ghrelin对糖尿病(DM)大鼠胃运动的调控,并探讨下丘脑弓状核与隔核间ghrelin通路对胃运动的调控机制。方法:链脲佐霉素腹腔注射制备DM大鼠模型;荧光免疫组化和real-time PCR方法检测DM大鼠隔核内ghrelin受体GHS-R1a表达变化;大鼠胃表面固定感应片在体记录胃运动并计算胃运动变化率;荧光金逆行示踪方法显示下丘脑弓状核和隔核间纤维联系,并采用中枢注射药物、核团损毁或电刺激等方法观察核团纤维联系对DM大鼠胃运动的调控作用。结果:(1)DM大鼠隔核GHS-R1a表达低于正常大鼠(P<0.05),胃运动明显减弱,胃收缩幅度和频率显著降低(P<0.05)。(2)隔核注射ghrelin增强正常和DM大鼠胃运动(P<0.05),且呈量效关系。(3)荧光金在注射入隔核7 d后逆行至弓状核内神经元,其中部分神经元为ghrelin免疫阳性神经元;(4)正常大鼠体内,损毁隔核对胃运动和电刺激弓状核引起的胃运动变化无显著影响(P>0.05);而对DM大鼠,损毁隔核减弱胃运动和电刺激弓状核后胃运动(P<0.05)。(5)隔核微量注射ghrelin受体阻断剂[DLys-3]-GHRP-6未显著改变正常大鼠电刺激弓状核后胃运动变化(P>0.05),但可减弱DM大鼠电刺激弓状核引起的胃运动变化(P<0.05)。结论:隔核ghrelin和下丘脑弓状核-隔核间ghrelin通路在糖尿病大鼠胃运动调控中发挥重要作用。
糖尿病;隔核;下丘脑;胃运动;Ghrelin
糖尿病(diabetes mellitus,DM)是一种多病因的代谢疾病,随着人们生活水平的提高,人口老龄化以及肥胖发生率的增加,DM的发病率呈逐年上升趋势。DM患者常伴有胃肠运动障碍[1],临床表现为胃弛缓与胃潴留,严重者可发生糖尿病胃轻瘫(diabetic gastroparesis,DGP)。DGP典型症状为腹胀、早饱、厌食、嗳气、恶心、呕吐、体重减轻,长期患病除导致营养不良外,还可影响血糖控制和糖尿病继发器官病变,成为降低患者生活质量的重要并发症[2]。但目前糖尿病性胃肠运动障碍病因尚不特别明确,可能与胃肠道平滑肌、植物神经改变等外周因素[3-4]有关,但目前脑肠肽(如ghrelin、胃动素、nesfatin-1等)中枢机制研究逐渐成为焦点,尤其与情绪活动相关的边缘系统,如隔核、海马在胃肠功能调控作用倍受关注。本研究将采用免疫荧光组化、real-time PCR、荧光逆行示踪、胃运动记录等方法观察DM大鼠胃肠运动变化及ghrelin对DM大鼠胃运动刺激作用,探讨下丘脑摄食相关中枢弓状核与隔核之间ghrelin神经通路的调节作用。
材料和方法
1 动物分组及模型制备
采用健康成年雄性SD大鼠(由青岛市药检所提供)260只,体重230~300 g,置于室温25℃ ±2℃,12 h/12 h昼夜循环光照条件下生活,自由摄食、饮水。随机取180只制作DM大鼠模型,另有80只正常大鼠。所有动物实验均符合《青岛大学实验动物保护和使用管理办法》。
参照Wei等[5]方法制作大鼠糖尿病模型。造模前禁食(不禁水)12 h;造模组大鼠腹腔注射新鲜配制 1% 链脲佐霉素 (streptozotocin,STZ;Sigma-Aldrich;65 mg/kg),对照组大鼠注射1 mL柠檬酸缓冲液(0.1 mol/L)。4周后,筛选DM大鼠成功模型,筛选标准为血糖浓度>15 mmol/L,且出现烦渴、多尿和体重下降等症状。
DM大鼠模型共有94只(52.2%),其中16只大鼠用于观察 ghrelin受体 GHS-R1a(growth hormone secretagogue receptor 1a)及其mRNA在隔核的表达,6只大鼠采用荧光金逆行示踪技术探讨下丘脑弓状核ghrelin神经元向隔核的投射,72只大鼠用于观察胃运动改变。
3 在体胃运动实验
3.1 隔核埋管术及核团注射 大鼠禁食15~20 h,硫巴比妥钠 (200 mg/kg;Sigma-Aldrich)腹腔麻醉。用牙科钻在颅骨表面钻孔,清除脑膜,参照Paxinos-Watson大鼠脑图谱[6],将自制不锈钢套管(长25 mm,外径0.7 mm,内径0.4 mm)置入隔核(前囟1.8~-0.8 mm,中线旁开0~1 mm,颅骨表面下5.5~5.8 mm),牙托粉固定。将一小螺丝钉固定于颅骨表面,用502胶和自凝牙托粉混合固定套管,并置入不锈钢内芯以防阻塞。
核团内微量注射:微量注射器尖端伸出套管2 mm进入核团,将待注射药物在3 min内缓慢注射完毕,留针3 min。Ghrelin(G3902)和[D-Lys3]-GHRP-6(G4535)均购于Sigma-Aldrich。
实验结束后,用微量注射器经核团内注射1 μL滂胺天蓝,随后用4%多聚甲醛经心脏灌注固定,快速断头取脑,4%多聚甲醛浸泡24 h后冰冻切片,对照图谱观察微量注射套管尖端的定位,位置不正确者弃去。
3.2 胃应力传感器植入术 剑突下行腹部正中切口,充分暴露胃,在距离幽门0.5 cm处,将应力传感器(应变片)沿纵行肌方向缝贴于胃窦浆膜面,绝缘导线经皮下引至颈后部皮肤切口,穿出体外。逐层关闭腹腔,缝合。术后每日腹腔注射青霉素2×104U。术后3 d,待动物恢复正常饮食,无任何疼痛和应激反应现象,即可进行实验。
3.3 麻醉大鼠胃运动记录 实验前动物禁食15~20 h,自由饮水。实验时大鼠硫巴比妥钠腹腔麻醉。用成都仪器厂RM-46胃运动记录仪连续描记胃运动曲线。胃运动信号经传感器将胃运动应力变化转为电信号,传至计算机,通过计算机即时收集胃肠运动数据,由记录仪软件做实验后数据处理。
胃运动变化率的计算公式:胃运动指数(motility index,MI)=5 min内胃运动曲线下面积,胃运动变

4 Real-time PCR
总RNA的提取和单链 cDNA(single-stranded DNA,ss-cDNA)合成参照文献[7]进行。采用Premier 6.1(PREMIER Biosoft)设计引物(表1),所有PCR引物均由Life Technologies公司合成。
取1 μL ss-cDNA产物作为待测样本,采用SYBR Green I定量 PCR试剂盒(TaKaRa)分别对GHS-R1a、ghrelin、神经肽Y(neuropeptide Y,NPY)、食欲素(orexin)和GAPDH进行扩增(扩增条件:95℃ 15 s,64℃1 min,共40个循环),随后对PCR产物进行熔解曲线分析。以不含ss-cDNA模板的PCR反应体系设为阴性对照。通过比较 GHS-R1a与GAPDH的Ct值进行定量:ΔCt=CtGHS-R1a-CtGAPDH。

表1 引物序列Table 1.Primer sequences
5 神经元逆行示踪与荧光免疫组化染色
成年健康及DM大鼠各取6只,硫巴比妥钠腹腔麻醉,参照Paxinos-Watson图谱,定位隔核(同前),用1 μL微量注射器缓慢注入0.2 μL 3%荧光金(Sigma-Aldrich)。大鼠放入笼中饲养7 d,麻醉状态下经心灌注固定(4%多聚甲醛),断头取脑,参照Paxinos-Watson图谱行冰冻切片(20 μm)。切片经4%正常羊血清/0.5%Triton X-100/PBS孵育2 h,与山羊抗ghrelin(1∶200,sc-10368,Santa Cruz)或GHSR1a(1∶200,sc-10359,Santa Cruz)抗体孵育(24 h,4℃),加入FITC交联的兔抗羊IgG(1∶100,sc-2777,Santa Cruz),置于黑暗湿盒内孵育2 h,甘油/PBS封片剂封片。荧光显微镜下观察免疫阳性细胞或荧光金分布。以正常羊血清代替Ⅰ抗做为阴性对照,其它步骤同上。
6 电刺激弓状核和电损毁三角隔核
参照Paxinos-Watson图谱将刺激电极插入右侧弓状核(前囟后2.12~4.30 mm,正中线旁开0~0.7 mm,颅骨下9.8~10.3 mm)。刺激参数为波宽0.5 ms,强度20 μA,频率50 Hz,持续10 s[8]。假电刺激只埋藏电极,不通电。
电损毁隔核用阳极直流电1 mA持续20 s[9]进行电解损毁。假电损毁组只埋藏电极,不通电。电损毁7 d后进行胃运动实验。
7 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 13.0和Prism 5.0统计学软件进行数据处理。两个独立样本组间均数比较用t检验,多组间均数差异性比较采用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
结果
1 隔核GHS-R1a受体的表达
荧光免疫组化研究显示,在正常和DM大鼠隔核中均有GHS-R1a免疫阳性细胞表达,但DM大鼠隔核内GHS-R1a表达明显降低[(10.0±2.1)/mm2vs(3.0±0.7)/mm2,P<0.05],见图1A。
Real-time PCR结果显示,DM大鼠隔核内GHSR1a mRNA表达循环阈值的循环次数较对照组大鼠明显增加[(9.22±2.45)vs(14.11±4.01)],mRNA含量约为对照组大鼠的(42.1±11.0)%(P<0.05),见图1B。上述结果提示,DM大鼠隔核内GHS-R1a表达降低。
2 隔核注射ghrelin对DM大鼠胃运动的影响
与正常大鼠比较,DM大鼠胃运动明显减弱,表现为胃收缩幅度[(7.21±2.47)g/min vs(4.03± 1.24)g/min,P<0.05]和胃收缩频率[(4.99± 0.87)Hz vs(3.02±0.21)Hz,P<0.05,见图2C、D]显著降低,变化率分别为(55.89±5.70)%和(60.52±10.20)%,见图2。结果提示,空腹DM大鼠胃运动能力降低。
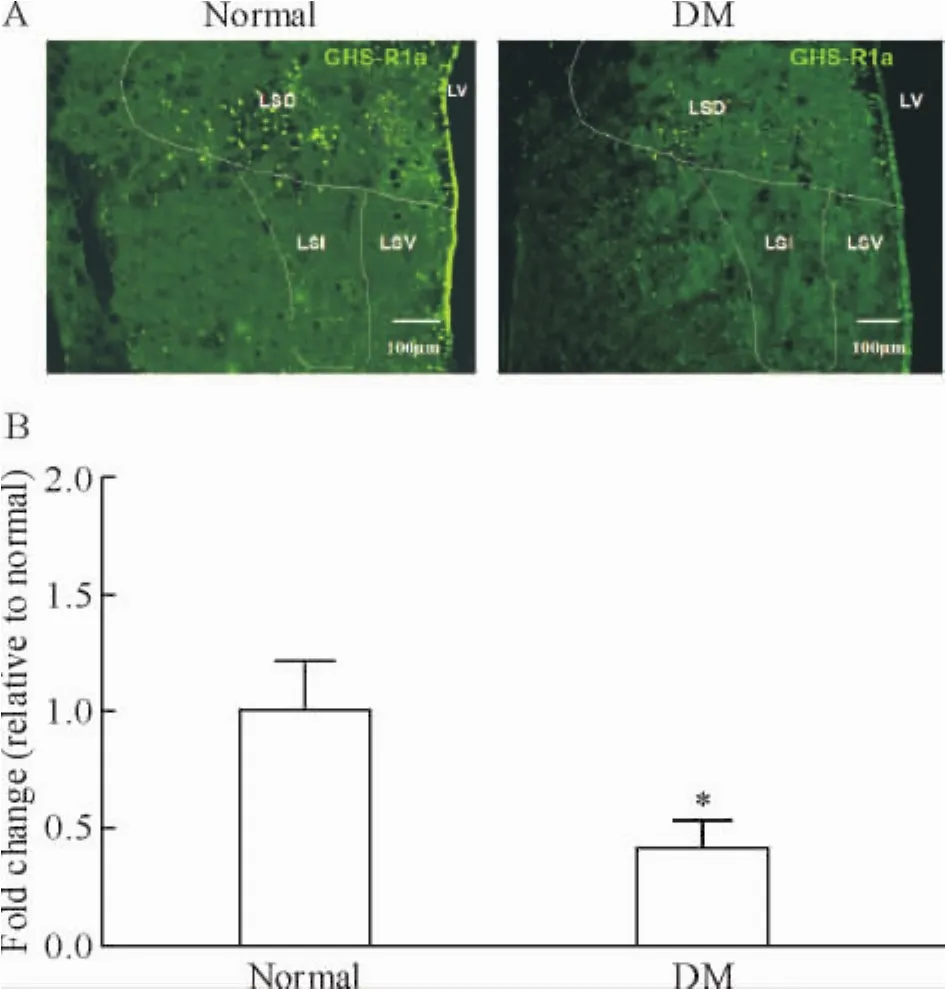
Figure 1.The protein(A)and mRNA(B)expression of ghrelin receptor GHS-R1a in septal nucleus of normal and DM rats.LSD:lateral septal nucleus,dorsal part;LSI:lateral septal nucleus,intermediate part;LSV:lateral septal nucleus,ventral part.Mean±SD.n=8.*P<0.05 vs normal.图1 正常和糖尿病大鼠外侧隔核ghrelin受体GHS-R1a蛋白和mRNA表达的变化
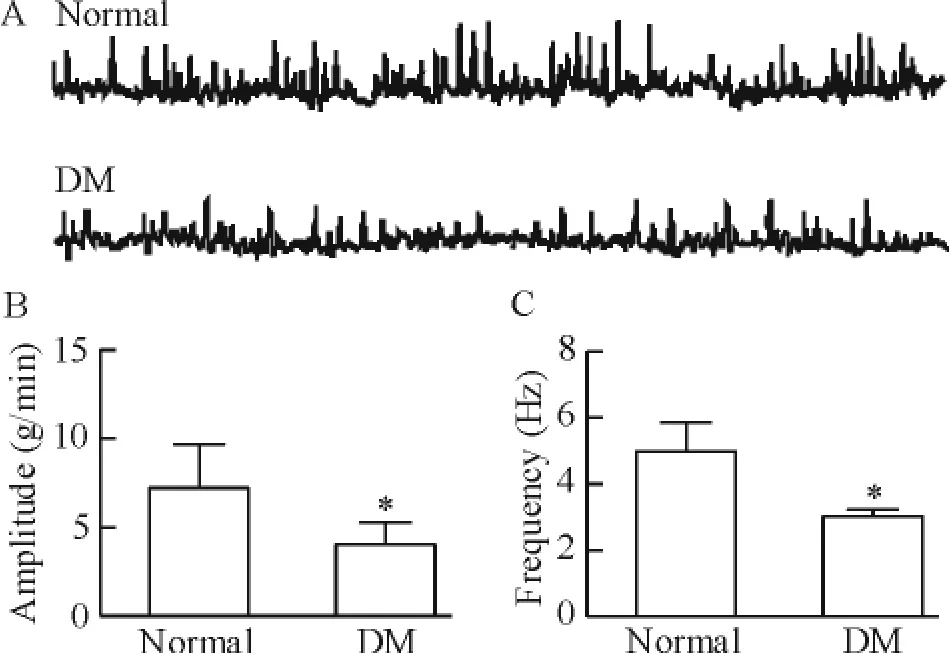
Figure 2.The gastric motility of normal rats and DM rats.A: gastric motility traces;B:comparison of amplitude of gastric motility;C:comparison of frequency of gastric motility.Mean±SD.n=8.*P<0.05 vs normal.图2 正常大鼠和糖尿病大鼠胃运动
正常大鼠隔核注射不同剂量ghrelin(0.05、0.5和5 nmol/L),胃运动在注射后5~10 min开始增加,10~15 min内变化最为明显,MI变化率分别为(50.99±15.31)%、(72.46±17.08)%和(88.74± 21.32)%(P<0.05或P<0.01),见图3A,且呈显著量效依赖关系。给予ghrelin受体阻断剂[D-Lys-3]-GHRP-6+ghrelin混合液,胃运动加强作用不再出现(P>0.05),见图3A。在DM大鼠,隔核微量注射0.05 nmol/L ghrelin,胃运动MI有增加趋势,但与对照组相比无显著差异(P>0.05),见图3B;而注射0.5 nmol/L和5 nmol/L ghrelin,大鼠胃运动显著增强,胃运动MI明显增加,注射后10~15 min时变化率分别为(55.67±16.50)%和(71.41±21.50)%(均P<0.05),见图3B。给予[D-Lys-3]-GHRP-6+ghrelin混合液,ghrelin促进胃运动增加作用消失(P>0.05),见图3B。结果提示,在正常大鼠,隔核注射ghrelin对胃运动的促进作用强于DM大鼠,可能与DM大鼠隔核内GHS-R1a表达降低有关。
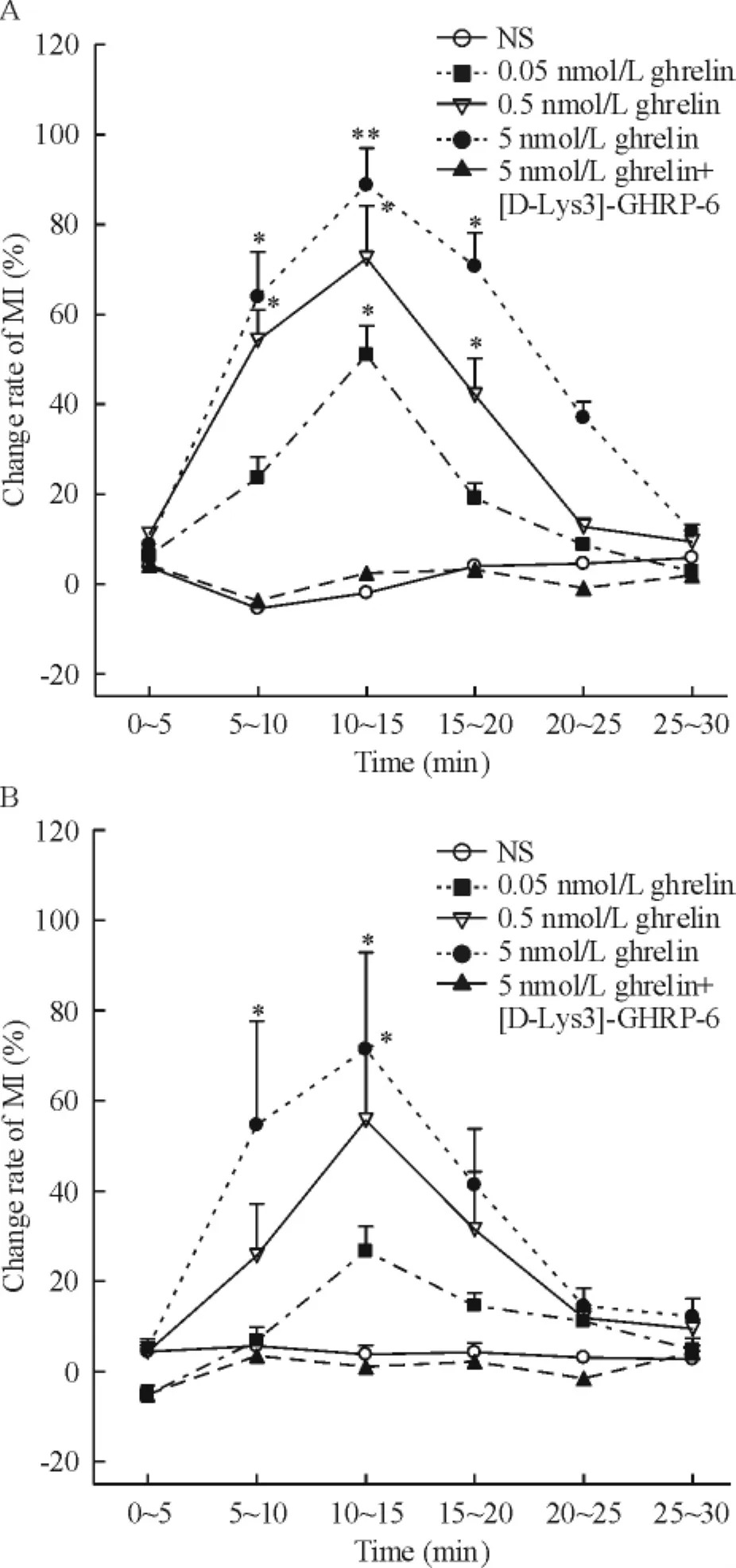
Figure 3.The effect of injection of ghrelin into septal nucleus on the gastric motility of normal rats(A)and DM ats (B).Mean±SD.n=8.*P<0.05,**P<0.01 vs NS.图3 隔核注射ghrelin对胃运动的影响
3 隔核-下丘脑弓状核ghrelin通路构成及其对胃运动的调控
3.1 隔核-下丘脑弓状核ghrelin通路构成 隔核微量注射荧光金,大鼠术后7 d灌注固定、取脑、切片,并进行ghrelin免疫荧光染色。在318 nm激发波长下,荧光显微镜下可见弓状核中有大量胞体呈黄色光的神经元,即为荧光金标记神经元(图4A)。在490 nm激发波长下,可见隔核内有ghrelin免疫阳性神经元表达(图4B),且部分ghrelin与荧光金标记的神经元共存(图4C),提示弓状核有ghrelin免疫阳性神经元投射至隔核。
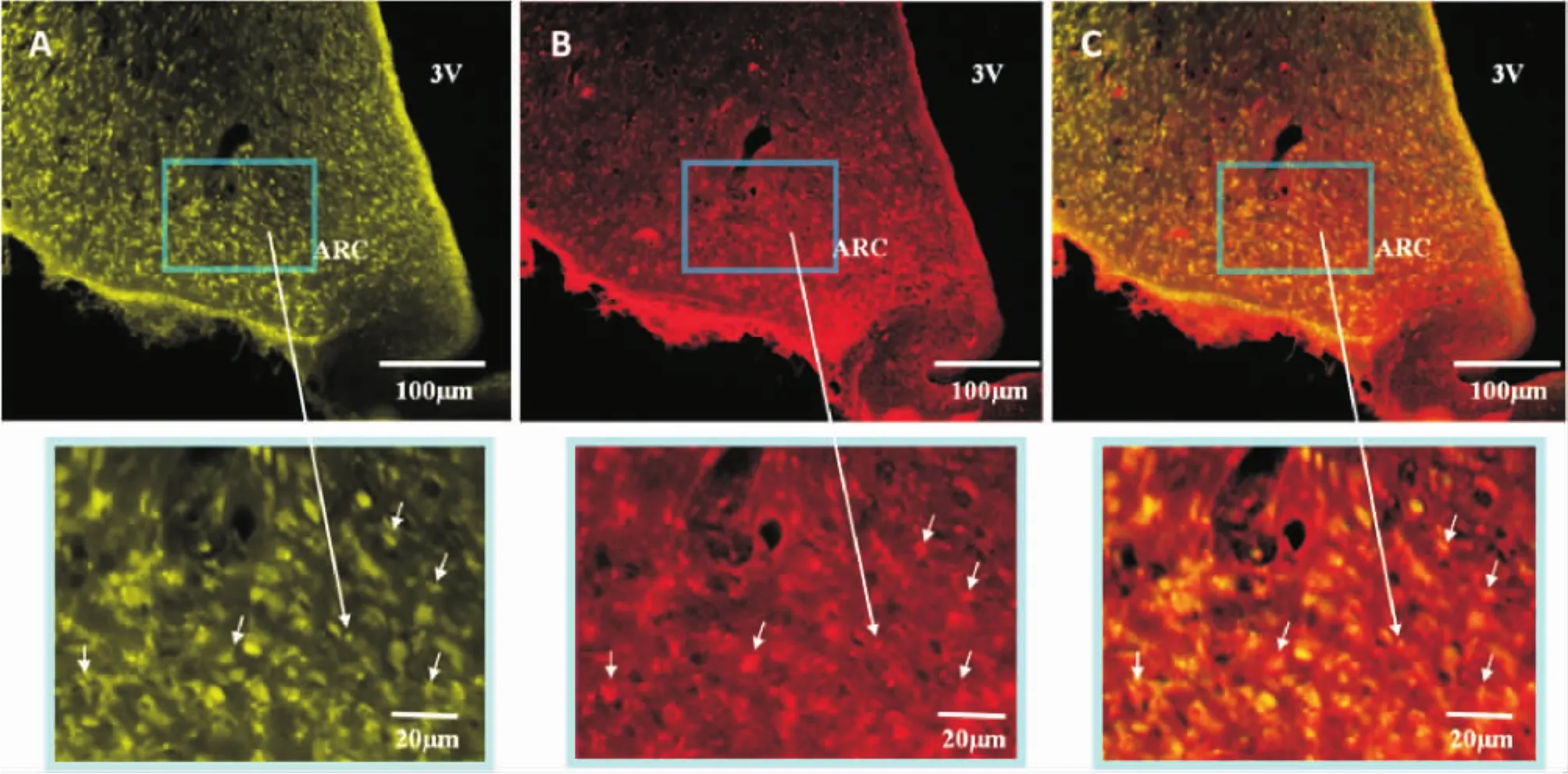
Figure 4.The expression of fluorogold-and ghrelin-positive neurons in the arcuate nucleus(ARC)of rats.A:fluorogold-positive neurons;B:ghrelin-positive neurons;C:fluorogold/ghrelin double-labled neurons.3V:the third ventricle of cerebrum.图4 大鼠弓状核荧光金与ghrelin免疫阳性神经元的表达
3.2 电损毁隔核对DM大鼠胃运动的影响 正常大鼠隔核损毁后胃运动变化率为(-10.23± 2.12)%,与假损毁大鼠[(2.01±0.77)%]相比无显著差异(P>0.05);在DM大鼠,隔核损毁后胃运动变化率[(-35.28±12.51)%]较假损毁DM大鼠[(5.18±1.44)%]显著下降(P<0.05),见图5A。结果提示,隔核参与DM大鼠对胃运动的调控。
3.3 隔核-下丘脑弓状核通路对胃运动的调控隔核在正常和DM大鼠体内对胃运动的作用程度不同,隔核-下丘脑弓状核通路是否参与此过程?为此本实验进一步损毁隔核,观察正常和DM大鼠电刺激弓状核后胃运动的变化。如图5B显示,正常大鼠电刺激弓状核后5~10 min胃运动变化率最大[(105.20±25.80)%],与假电刺激对照组[(5.62 ±2.18)%]比较显著增高(P<0.05);大鼠在三角隔核电损毁术后7 d,电刺激弓状核后5~10 min胃运动变化率为(96.52±31.12)%,与假损伤+电刺激对照组[(111.62±27.88)%]比较无明显差异(P>0.05)。在DM大鼠,电刺激弓状核后5~10 min,与假电刺激对照组比较,胃运动显著增强[(88.65±23.14)%vs(8.35±3.39)%,P<0.05];电损毁三角隔核术后7 d,电刺激弓状核仍可导致胃运动明显增强[(43.98±10.14)%vs(-5.26± 2.01)%,P<0.05],但较假损毁隔核+电刺激组明显减弱[(43.98±10.14)%vs(82.31±22.91)%,P<0.05],见图5C。结果提示,隔核-下丘脑弓状核通路参与DM大鼠胃运动调控。
3.4 Ghrelin受体阻断剂[D-Lys-3]-GHRP-6对隔核-下丘脑弓状核通路作用 正常大鼠隔核内微量注射1 nmol[D-Lys-3]-GHRP-6,电刺激弓状核大鼠胃运动最大变化率与隔核注射NS+电刺激弓状核对照组比较无显著差异[(98.57±19.22)% vs (108.38±29.25)%,P>0.05],见图5B。在DM大鼠,隔核注射[D-Lys-3]-GHRP-6后电刺激弓状核,胃运动显著增强,最大变化率为(56.48±13.87)%,但明显低于NS+电刺激弓状核对照组[(96.57± 15.62)%,P<0.05],见图5C。结果提示,在DM大鼠,弓状核可能通过直接或间接释放ghrelin至隔核,参与胃运动调控。
3.5 DM大鼠下丘脑促胃动激素表达变化 结果如图6所示,DM大鼠下丘脑 ghrelin mRNA和 NPY mRNA均显著高于正常大鼠(均P<0.05),但食欲素mRNA表达无显著变化(P>0.05)。该结果进一步证实,下丘脑ghrelin和NPY可能参与DM大鼠胃动力障碍的调控。
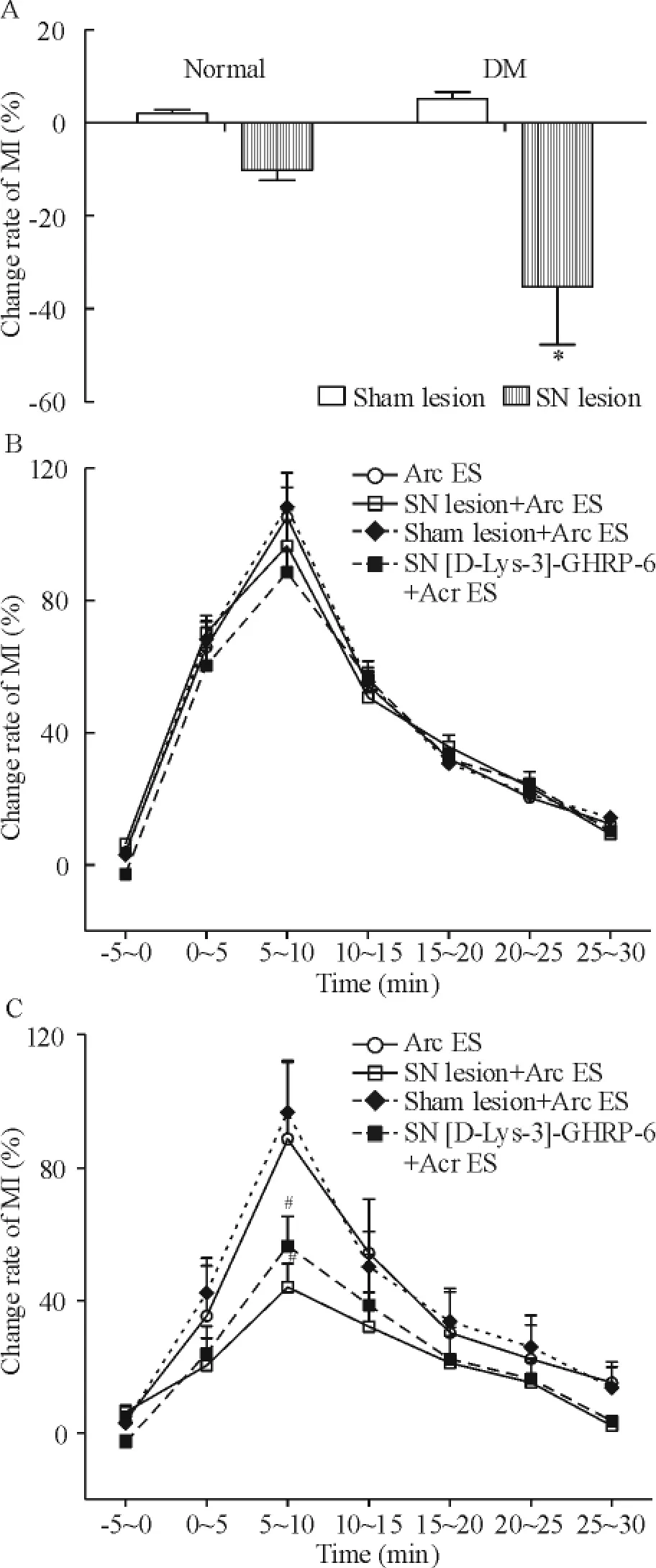
Figure 5.The effect of septal-arcuate(Arc)pathway on the gastric motility of DM rats.A:lesion of septal nucleus (SN)decreased the gastric MI%of DM rats;B:SN lesion did not affect the gastric MI%of normal rats; C:SN lesion weakened the increased gastric MI%by Arc electrical stimulation(ES)in DM rats.Mean± SD.n=8.*P<0.05 vs sham lesion;#P<0.05 vs sham lesion+Arc ES.图5 隔核-弓状核通路对DM大鼠胃运动的影响

Figure 6.The changes of mRNA expression of ghrelin,neuropeptide Y(NPY)and orexin in the hypothalamus of DM rats.Mean±SD.n=8.*P<0.05 vs normal.图6 DM大鼠下丘脑ghrelin、NPY和食欲素mRNA表达变化
讨论
糖尿病人多并发胃运动障碍,严重者可出现DGP,对此的研究多集中于胃肠道改变和促胃动力药的外周作用研究[1],而本实验则主要研究中枢对胃肠运动调控,应用荧光免疫组化和real-time PCR检测发现DM大鼠隔核内GHS-R1a表达显著下降(图1),同时DM大鼠胃运动功能减弱(图2),提示糖尿病大鼠胃轻瘫可能与隔核中GHS-R1a表达减少有关,Yang等[10]发现GHS-R基因敲除大鼠胃排空延迟,胃壁肌层内神经细胞数量减少。这些进一步说明GHS-R1a及其配体ghrelin可能在糖尿病胃轻瘫发病中发挥重要作用。
Ghrelin作为GHS-Rla体内的天然配体由Kojima等[11]在1999年发现,包含28个氨基酸,分子量约为3.3kD。Ghrelin广泛分布于体内多种组织器官,如大小肠、胰腺、肾脏、肝脏、垂体、下丘脑及海马等[12-14]。第三脑室内注射ghrelin可增加大鼠摄食和胃运动增强[15],而ghrelin信号通路受损后胃肠道运动功能明显下降,并容易发生胃食管返流症[16]。本实验在隔核中注射微量ghrelin后正常大鼠和DM大鼠胃运动幅度都明显增加,且呈剂量依赖性(图3),DM大鼠增加幅度低于正常大鼠。这表明隔核在注射ghrelin后经过某种途径可引起胃运动增加,DM大鼠隔核对ghrelin反应性低于正常大鼠。
机体营养代谢状态可通过外周血液营养成分、激素或迷走神经等发送信息至脑干,以调节各脑区的功能活动。因此,胃肠道、脑干、下丘脑和边缘系统相互作用,构成一个复杂的网络,共同调节摄食,隔核作为边缘系统的一部分,在摄食与能量平衡调节中也发挥一定的作用。Scopinho等报道,外侧隔核给予去甲肾上腺素增加大鼠摄食量,且α1受体拮抗剂WB4101显著减弱此作用。这提示我们,外侧隔核可能与摄食相关的奖赏行为有关。尽管大量的研究结果表明ghrelin与能量驱动的消耗有关,也有一些证据提示 ghrelin可能参与摄食的奖赏机制。GHS-R配体直接注射至腹侧被盖可引起大鼠强烈的进食反应,提示ghrelin通过中脑边缘系统的奖赏通路可引发摄食[18]。这些研究提示,隔核ghrelin对胃运动的调控作用可能也与摄食相关的奖赏机制有关,但有待进一步研究。
隔核又称隔复合体,位于侧脑室的内侧,胼胝体下方,左右两侧在中线上合并。按位置可将隔核分为背内侧核群(内侧隔核和斜角带核)、腹外侧核群(外侧隔核)、背侧核群(终纹床核)及尾侧核群(隔海马伞核和三角隔核)。作为Papez环路和基底外侧边缘环路的共有区域,隔核在情绪与动机的产生学习记忆的形成与巩固、睡眠和觉醒中发挥重要作用,对心血管和胃肠道等内脏活动也具有明显的调节作用[19-20]。近年发现,隔核与海马、下丘脑、杏仁核、松果体、中脑、扣带回、嗅球和丘脑存在广泛的传入和胆碱能传出神经纤维联系,参与多种生理功能的调控。例如,从内侧隔核投射到海马的γ-氨基丁酸能和胆碱能纤维通路参与学习与记忆过程[21];相反,外侧隔核主要投射到下丘脑和中脑区域,从而参与社会活动、焦虑、恐惧及与边缘系统奖赏通路相关的行为活动[22-24]。外侧隔核还接受来自海马和杏仁核的大量谷氨酸能纤维传入,与一系列记忆相关活动有关[25]。
本研究也进一步证实,在弓状核内有ghrelin免疫阳性神经元存在(图4)。同时还发现,在弓状核向隔核的神经通路上有ghrelin阳性神经元的投射(图4),从而建立了下丘脑弓状核-隔核ghrelin能神经通路。脑对摄食的调控分为两部分:稳态调节和附属调节[26]。稳态调节主要由下丘脑负责;附属调节则是由边缘系统,特别是海马、杏仁核等核团完成,以便对环境条件和刺激如记忆、压力、情绪、奖赏和快感等做出合适的反应。此通路的发现进一步验证了中枢内摄食调控网络的复杂性和多样性。
弓状核-隔核间ghrelin通路功能研究发现,电刺激损毁隔核后正常大鼠胃运动无明显变化,而DM大鼠胃运动明显减弱(图5),表明DM大鼠胃运动的调控不同于正常大鼠,并推测可能与隔核在DM大鼠胃运动调控中的功能强化或DM大鼠中枢神经系统各核团间平衡代偿能力下降有关。正常大鼠电刺激损毁隔核或隔核内注射ghrelin受体抑制剂对电刺激弓状核引起的胃运动变化无明显作用,而DM大鼠则会出现明显减弱(图5)。DM大鼠胃平滑肌细胞反应[3]、自主神经功能[4]、平滑肌能量代谢方式[5]等方面都发生明显变化,但本实验首次通过观察中枢神经系统内核团和通路变化对DM大鼠胃肠运动变化的影响,提出高血糖引发中枢系统内递质及受体分布改变引发中枢性胃肠运动变化,为将来糖尿病胃轻瘫中枢和外周合并治疗提供理论基础。
本实验中ghrelin受体GHS-R1a在DM大鼠下丘脑中表达减少,前期实验发现[27],DM大鼠下丘脑弓状核内GHS-R1a减少,表明DM大鼠下丘脑多个核团中GHS-R1a均表达减少,这可能引起中枢内ghrelin代偿性分泌增多。另外,实验结果显示在应用GHS-R1a阻断剂时胃运动减弱显著,同样情况下正常大鼠胃肠道运动无明显变化。正常大鼠ghrelin、食欲素和NPY等多种激素同时参与胃肠运动调控,保持胃肠功能的“稳态”;而DM时胰岛素分泌紊乱,机体代偿功能失调,其它相关激素也必然受到影响,并且DM早期的“多食”症状,进一步刺激各种促胃动素分泌变化。
我们进一步对ghrelin、NPY和食欲素等的mRNA在下丘脑内的表达变化进行分析,发现ghrelin mRNA表达在DM大鼠下丘脑中表达明显增多,NPY表达也轻度增加,食欲素表达无明显改变。Gelling等[28]的研究也表明DM大鼠ghrelin浓度升高,且脑室注射后可显著促进DM大鼠摄食,说明ghrelin在DM大鼠体重、摄食等的调控中发挥更重要的作用,这与本实验结果一致。NPY mRNA表达同时增加,Lee等[29]曾通过针刺足三里以降低DM大鼠下丘脑中NPY以尝试调控摄食和控制血糖,NPY/AGRP神经元通路作为众多神经肽的作用位点,在DM时摄食和胃肠道的调控中更多是作为非特异性的通路。食欲素在正常大鼠体内参与调控能量平衡、睡眠周期和情绪学习等,Cai等[30]研究发现在肥胖大鼠中食欲素变化显著,但在DM大鼠体内无明显不同。本实验中DM大鼠下丘脑内食欲素mRNA表达无显著变化,与其研究结果相同。但Adeghate等[31]发现DM大鼠胰腺内食欲素受体增加,从而参与血糖的调控,提示食欲素也可能通过受体变化从而在DM大鼠中枢神经系统中发挥作用。
[1]Stevens JE,Jones KL,Rayner CK,et al.Pathophysiology and pharmacotherapy of gastroparesis:current and future perspectives[J].Expert Opin Pharmacother,2013,14 (9):1171-1186.
[2]Thazhath SS,Jones KL,Horowitz M,et al.Diabetic gastroparesis:recent insights into pathophysiology and impli-cations for management[J].Expert Rev Gastroenterol Hepatol,2013,7(2):127-139.
[3]Soulié ML,Cros G,Serrano JJ,et al.Impairment of contractile response to carbachol and muscarinic receptor coupling in gastric antral smooth muscle cells isolated from diabetic streptozotocin-treated rats and db/db mice[J].Mol Cell Biochem,1992,109(2):185-188.
[4]Lin S,Kajimura M,Takeuchi K,et al.Alterations of GTP-binding proteins(Gsα and Gq/11α) in gastric smooth muscle cellsfrom streptozotocin-induced and WBN/Kob diabetic rats[J].Dig Dis Sci,2000,45(8): 1517-1524.
[5]Wei M,Ong L,Smith MT,et al.The streptozotocin-diabetic rat as a model of the chronic complications of human diabetes[J].Heart Lung Circ,2003,12(1):44-50.
[6]Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].6th ed.New York:Academic Press,2007:5-10.
[7]Xu L,Sun X,Lu J,et al.Effects of gastric electric stimulation on gastric distention responsive neurons and expressions of CCK in rodent hippocampus[J].Obesity(Silver Spring),2008,16(5):951-957.
[8]Avetisyan EA,Adamyan FA,Petrosyan AA.The role of the septal nuclei in controlling the activity of vagosensitive neurons in the solitary tract nucleus in cats[J].Neurosci Behav Physiol,2004,34(5):473-478.
[9]van Kuyck K,Gabriels L,Cosyns P,et al.Behavioural and physiological effects of electrical stimulation in the nucleus accumbens:a review[J].Acta Neurochir Suppl,2007,97(Pt 2):375-391.
[10]Yang CG,Wang WG,Yan J,et al.Gastric motility in ghrelin receptor knockout mice[J].Mol Med Rep,2013,7 (1):83-88.
[11]Kojima M,Hosoda H,Date Y,et al.Ghrelin is a growthhormone-releasing acylated peptide from stomach[J].Nature,1999,402(6762):656-660.
[12]Gnanapavan S,Kola B,Bustin SA,et al.The tissue distribution of the mRNA of ghrelin and subtypes of its receptor,GHS-R,in humans[J].J Clin Endocrinol Metab,2002,87(6):2988-2991.
[13]Cowley MA,Smith RG,Diano S,et al.The distribution and mechanism of action of ghrelin in the CNS demonstrates a novel hypothalamic circuit regulating energy homeostasis[J].Neuron,2003,37(4):649-661.
[14]Zigman JM,Jones JE,Lee CE,et al.Expression of ghrelin receptor mRNA in the rat and the mouse brain[J].J Comp Neurol,2006,494(3):528-548.
[15]Brown LM,Benoit SC,Woods SC,et al.Intraventricular (i3vt)ghrelin increases food intake in fatty Zucker rats[J].Peptides,2007,28(3):612-616.
[16] Nahata M,Muto S,Oridate N,et al.Impaired ghrelin signaling is associated with gastrointestinal dysmotility in rats with gastroesophageal reflux disease[J].Am J Physiol Gastrointest Liver Physiol,2012,303(1):G42-G53.
[17]Scopinho AA,Resstel LB,Corrêa FM.α1-Adrenoceptors in the lateral septal area modulate food intake behaviour in rats[J].Br J Pharmacol,2008,155(5):752-756.
[18]Wren AM,Small CJ,Abbott CR,et al.Ghrelin causes hyperphagia and obesity in rats[J].Diabetes,2001,50 (11):2540-2547.
[19]Hosseini-Sharifabad A,Mohammadi-Eraghi S,Tabrizian K,et al.Effects of training in the Morris water maze on the spatial learning acquisition and VAChT expression in male rats[J].Daru,2011,19(2):166-172.
[20]Pavan de Arruda Camargo GM,de Arruda Camargo LA,Abrão Saad W.Medial septal area ANG II receptor subtypes in the regulation of urine and sodium excretion induced by vasopressin[J].J Renin Angiotensin Aldosterone Syst,2011,12(1):23-28.
[21]Chrobak JJ,Napier TC.Intraseptal administration of bicuculline produces working memory impairments in the rat[J].Behav Neural Biol,1991,55(2):247-254.
[22]Trent NL,Menard JL.Infusions of neuropeptide Y into the lateral septum reduce anxiety-related behaviors in the rat[J].Pharmacol Biochem Behav,2011,99(4):580-590.
[23] Singewald GM,Rjabokon A,Singewald N,et al.The modulatory role of the lateral septum on neuroendocrine and behavioral stress responses[J].Neuropsychopharmacology,2011,36(4):793-804.
[24] Luo AH,Tahsili-Fahadan P,Wise RA,et al.Linking context with reward:a functional circuit from hippocampal CA3 to ventral tegmental area[J].Science,2011,333 (6040):353-357.
[25]Thomas E,Pernar L,Lucki I,et al.Corticotropin-releasing factor in the dorsal raphe nucleus regulates activity of lateral septal neurons[J].Brain Res,2003,960(1-2): 201-208.
[26]Suyama S,Takano E,Iwasaki Y,et al.Roles and functional interplay of the gut,brain stem,hypothalamus and limbic system in regulation of feeding[J].Nihon Rinsho,2009,67(2):277-286.
[27]徐 珞,郭菲菲,孙向荣,等.Ghrelin对糖尿病大鼠下丘脑弓状核胃牵张敏感神经元放电活动及胃运动的调控[J].中国病理生理杂志,2013,29(1):28-35.
[28]Gelling RW,Overduin J,Morrison CD,et al.Effect of uncontrolled diabetes on plasma ghrelin concentrations and ghrelin-induced feeding[J].Endocrinology,2004,145 (10):4575-4582.
[29]Lee JD,Jang MH,Kim EH,et al.Acupuncture decreases neuropeptide Y expression in the hypothalamus of rats with Streptozotocin-induced diabetes[J].Acupunct Electrother Res,2004,29(1-2):73-82.
[30]Cai XJ,Lister CA,Buckingham RE,et al.Down-regulation of orexin gene expression by severe obesity in the rats: studies in Zucker fatty and zucker diabetic fatty rats and effects of rosiglitazone[J].Brain Res Mol Brain Res,2000,77(1):131-137.
[31]Adeghate E,Fernandez-Cabezudo M,Hameed R,et al.Orexin-1 receptor co-localizes with pancreatic hormones in islet cells and modulates the outcome of streptozotocin-induced diabetes mellitus[J].PLoS One,2010,5(1): e8587.
Effect of ghrelin in septal nucleus on gastric motility of diabetic gastroparesis rats and its potential mechanism regulated by hypothalamic arcuate nucleus
YAN Chang-hong1,2,XU Luo1,GAO Sheng-li1,GUO Fei-fei1,SUN Xiang-rong1,GONG Yan-ling3
(1Department of Pathophysiology,Medical College of Qingdao University,Qingdao 266021,China;2Heze Medical College,Heze 274000,China;3College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042,China.E-mail:xu.luo@163.com)
AIM:To study the effect of ghrelin in septal nucleus on the gastric motility of the rats with diabetes mellitus(DM)and to investigate the regulation of ghrelin pathway between arcuate and septal nucleus nuclei on gastric motility.METHODS:Streptozotocin was injected intraperitoneally to establish a DM rat model.Fluorescence immunohistochemistry and real-time PCR were used to detect the expression of ghrelin receptor GHS-R1a.The gastric motility was evaluated by implantation of a force transducer on the surface of rats'stomachs and the motility index was also calculated.The neural connections between arcuate and septal nuclei were analyzed by the technique of fluorogold tracing.The neural control pathway of gastric motility was determined by central drug injection,nucleus lesion or nucleus electrical stimulation.RESULTS:The expression of GHS-R1a in the septal nucleus of DM rats was lower than that in normal rats(P<0.05).The amplitude and frequency of gastric motility in the DM rats were lower than those in the normal rats(P<0.05).The gastric motility of normal and DM rats were increased by injection of ghrelin into the septal nucleus in a dose-dependent manner.Seven days after injection of fluorogold into the septal nucleus,some neurons in arcuate nucleus were labeled by fluorogold and part of the labeled neurons were ghrelin immunopositive.No effect of nucleus lesion or nucleus electrical stimulation on the gastric motility in the normal rats was observed.In DM rats,the lesion of septal nucleus decreased the gastric motility(P<0.05).In the normal rats,the change of gastric motility caused by electrical stimulation in arcuate nucleus was not affected by the lesion of septal nucleus(P>0.05),while the change was attenuated in DM rats(P<0.05).The ghrelin receptor antagonist[D-Lys-3]-GHRP-6 had no significant effect on the gastric motility induced by electrical stimulation in arcuate nucleus of the normal rats(P>0.05),but it reduced the change in the DM rats(P<0.05).CONCLUSION:Ghrelin in septal nucleus and the ghrelinergic pathway between arcuate and septal nuclei play an important role in the modulation of gastric motility in DM rats.
Diabetes Mellitus;Septal nuclei;Hypothalamus;Gastric motility;Ghrelin
R363
A
10.3969/j.issn.1000-4718.2014.03.018
1000-4718(2014)03-0486-08
2013-10-21
2014-02-12
国家自然科学基金资助项目(No.30670780;No.31071014;No.81100260;No.81270460;No.81300281);山东省科技攻关项目(No.2008GG10002006);山东省卫生厅项目(No.2007HZ026);青岛市科技局项目(No.11-2-3-3-(2)-nsh;No.13-1-4-170-jch)
△通讯作者Tel:0532-82991713;E-mail:xu.luo@163.com
