人β-NGF基因修饰的骨髓间充质干细胞对帕金森病大鼠行为学的影响*
2014-05-16林晓滨李晓莉施镇江黄桂琴王廷华
毕 涌, 洪 娟, 林晓滨, 李晓莉, 魏 鹏, 施镇江, 黄桂琴, 王廷华, 张 旭△
(温州医科大学1神经生物学重点学科,2附属第一医院神经内科,3附属第一医院耳鼻咽喉科,浙江温州 325000;4昆明医学院神经科学研究所,云南昆明 650031)
人β-NGF基因修饰的骨髓间充质干细胞对帕金森病大鼠行为学的影响*
毕 涌1,2, 洪 娟3, 林晓滨2, 李晓莉2, 魏 鹏4, 施镇江4, 黄桂琴4, 王廷华4, 张 旭1,2△
(温州医科大学1神经生物学重点学科,2附属第一医院神经内科,3附属第一医院耳鼻咽喉科,浙江温州 325000;4昆明医学院神经科学研究所,云南昆明 650031)
目的:探讨脑内移植人β-神经生长因子(β-NGF)基因修饰的骨髓间充质干细胞(MSCs)对帕金森病(PD)模型大鼠行为学的影响。方法:将成功制备的PD大鼠模型按随机数字法分为β-NGF基因修饰的MSCs移植组(β-NGF-MSCs组)、MSCs移植组(MSCs组)、DMEM/F12培养液纹状体内注射组(DMEM/F12组)和非移植组(PD模型组)。细胞移植后,动态观察PD模型大鼠行为学变化及脑组织形态学的变化。结果:β-NGF基因修饰的MSCs脑内移植能有效改善PD模型大鼠的行为学表现。细胞移植术后第2周、第4周和第6周,β-NGF-MSCs组在阿朴吗啡诱发下30 min内的平均旋转圈数均明显低于MSCs组和PD模型组(P<0.05)。DMEM/F12组和PD模型组的旋转行为手术前后比较无明显变化(P>0.05)。免疫组织化学染色结果显示,移植细胞在PD模型大鼠脑内均能存活,并能够与宿主组织产生整合,具有良好的组织相容性;宿主的脑组织结构无破坏,无胶质瘢痕形成。PD模型大鼠纹状体内移植β-NGF基因修饰的MSCs后,可持续稳定表达β-NGF,其对PD模型大鼠旋转行为的改善明显优于单纯应用MSCs移植治疗。结论:β-NGF基因修饰的MSCs脑内移植能明显改善PD模型大鼠行为学症状,具有潜在的临床应用价值。
帕金森病;神经生长因子;骨髓间充质干细胞;基因治疗
中枢神经系统损伤在帕金森病(Parkinson disease,PD)的进展过程中持续不断地发生,对PD的治疗关键在于防止病情进展、修复和延缓多巴胺(dopamine,DA)能神经元的损害,细胞和基因治疗是实现这一目标的最佳途径之一[1-2]。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,MSCs)具有免疫原性弱、体外基因转染率高、能稳定高效表达外源基因等优点,是作为细胞和基因治疗种子细胞的理想选择[3]。绿色荧光蛋白(green fluorescent protein,GFP)转基因小鼠的MSCs能稳定表达GFP,是MSCs研究中良好的示踪工具[4]。
神经生长因子(nerve growth factor,NGF)是一类对神经元存活、生长发育和损伤修复有重要作用的多肽小分子蛋白质,并且参与维系神经、免疫和内分泌系统之间的平衡[2,5]。然而,由于其受体分布广泛,半衰期短,不能有效通过血脑屏障,在脑内很快降解,需要持续给药维持效果,使其在临床的应用受到明显限制[6]。近来,将神经营养因子基因修饰的干细胞用于移植治疗的转基因技术,为NGF临床治疗提供了可能[7-9]。β亚单位是NGF完整的生物活性单位,分子量较小,相对于完整的NGF分子更易于透过血脑屏障。因此,本研究将重组β-NGF质粒转染的GFP转基因小鼠的MSCs,再进行脑内移植治疗PD模型大鼠,观察其行为学及脑组织形态学的变化,为PD的基因治疗探索一种新的方法。
材料和方法
1 动物和试剂
GFP转基因小鼠和pcDNA3-β-NGF质粒重组体由昆明医学院神经科学研究所提供。DMEM/F12培养基、胰蛋白酶购自Gibco;胎牛血清(fetal bovine serum,FBS)购自HyClone。G418和β-NGF抗体购自Sigma;脂质体LipofectamineTM2000购自Gibco;二步法免疫组化试剂盒购自北京中山生物技术有限公司。
2 GFP转基因小鼠MSCs的体外培养和生物学鉴定
获取GFP转基因小鼠骨髓,分离MSCs进行原代培养。传代培养后,CD44、CD54和CD45抗体分别对原代培养3 d及传代培养至第5代的MSCs进行免疫细胞化学染色鉴定[10]。
3 方法
3.1 重组β-NGF质粒转染GFP转基因小鼠MSCs用脂质体 LipofectamineTM2000将重组质粒 pcDNA3-β-NGF转染到 GFP转基因小鼠 MSCs,通过GF418进行筛选,以β-NGF抗体进行免疫细胞化学染色检测β-NGF的表达。先用4%多聚甲醛固定细胞20 min,再用0.01 mol/L PBS液洗去固定液,DAB显色后光镜下观察。其中I抗稀释度为1∶1 000,阴性对照组以0.01 mol/L PBS液代替I抗。
3.2 β-NGF基因修饰MSCs表达产物的生物学活性鉴定 将新生小鼠海马神经元按1×106个细胞密度接种在涂有多聚赖氨酸的35 mm培养皿中,用含10%胎牛血清的DMEM/F12培养液培养。2 d后将已收集备用的各组转染细胞上清液与含10%胎牛血清的DMEM/F12培养液按1∶1的比例分别加入新生小鼠海马神经细胞培养皿中,观察各组细胞生长情况。
3.3 PD大鼠模型的制备 通过随机数表将68只SD大鼠(2~3个月龄,180~230 g,雌雄不限)随机分为2组,其中6-羟基多巴胺(6-hydroxydopamine,6-OHDA;Sigma)实验组62只,对照组6只。参照大鼠立体定位图谱,采用单侧纹状体内两点注射6-OHDA法制作PD大鼠模型,对照组6只注射生理盐水。分别在术后1、2、4、6、8和10周于颈部皮下注射0.1%阿朴吗啡(apomorphine,APO;Sigma,1 mL/kg),诱发大鼠向健侧的单向旋转行为,PD模型旋转检测仪记录动物向对侧旋转情况,旋转360°为1次,每次记录30 min。一般认为,平均旋转次数≥7 turns/min为成功的PD大鼠模型。
3.4 PD模型大鼠脑内的细胞移植 47只成功复制PD模型的大鼠按随机数表分为4组:重组β-NGF质粒转染的MSCs移植组(β-NGF-MSCs组)和MSCs移植组(MSCs组),每组17只;DMEM/F12培养液纹状体内注射组(DMEM/F12组)7只;非移植组(PD模型组)6只。向β-NGF-MSCs组和MSCs组的大鼠右侧纹状体分别注入5 μL细胞悬液,每点植入的MSCs细胞数约5×105个。DMEM/F12组以等体积DMEM/F12培养液代替细胞同法注入右侧纹状体,PD模型组麻醉后不作任何移植处理。
3.5 移植后的行为学检测 移植后的1、2、4和6周,各组动物均予颈部皮下注射0.1%阿朴吗啡1 mL/kg,诱发大鼠向健侧的单向旋转行为。阿朴吗啡注射后30 min开始计数旋转行为,旋转360°为1次,并对统计数据进行分析。
3.6 移植细胞的荧光及免疫组织化学染色观察
利用免疫组织化学染色技术及移植细胞自身能发出荧光的特点于术后不同时段观察移植细胞在 β-NGF-MSCs组动物脑内存活及表达β-NGF的情况。每次从每组动物中随机选出2只大鼠,分别于移植后的1 d、2周、4周及6周在腹腔麻醉下灌注,取纹状体和黑质部分脑片进行观察。用4%多聚甲醛灌注固定,取脑后将其置于同样固定液中固定6 h,然后移入含20%蔗糖的溶液内,-20℃恒温连续冠状切片,片厚20 μm。将细胞移植组切片置于荧光显微镜下观察并予以摄片记录。GFP转基因小鼠MSCs自身可发出荧光,观察到的荧光细胞即是植入后存活的细胞。于移植后4周及6周取移植区脑组织切片进行β-NGF免疫组化染色,DAB显色后荧光显微镜下观察β-NGF阳性细胞的组织分布。
4 统计学处理
数据以均数 ±标准差(mean±SD)表示,采用SPSS 17.0软件进行单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 PD模型大鼠行为学评价
实验组62只SD大鼠中共47只成为PD大鼠模型,成功率75.8%,主要表现为运动迟缓、少动、竖毛、躬身、尾僵、头偏斜、嗅探等;术后1周可观察到偶发的旋转行为,但不超过3 turns/min。术后4周共有47只大鼠出现稳定的超过7 turns/min的旋转行为,3只未出现旋转行为,10只旋转行为<7 turns/ min,2只术后死亡。对照组术后一直未诱发出旋转行为。
2 β-NGF在GFP转基因小鼠MSCs中的表达
G418筛选的重组β-NGF质粒转染的阳性克隆细胞经DAB显色后,在光镜下观察均呈棕色的阳性反应,其余细胞未见阳性反应,见图1A、B。重组β-NGF质粒转染的MSCs上清液与新生小鼠海马神经元培养3 d后,在倒置相差显微镜下观察显示细胞存活良好,胞体长出明显的突起;pcDNA3质粒转染的MSCs组及其它各组上清液与新生小鼠海马神经元共培养后,神经元胞体呈圆形,没有明显的突起,见图1C、D。这表明重组β-NGF质粒转染的MSCs培养上清液中的产物可促进新生小鼠海马神经元的突起生长,具有明显的生物学活性。
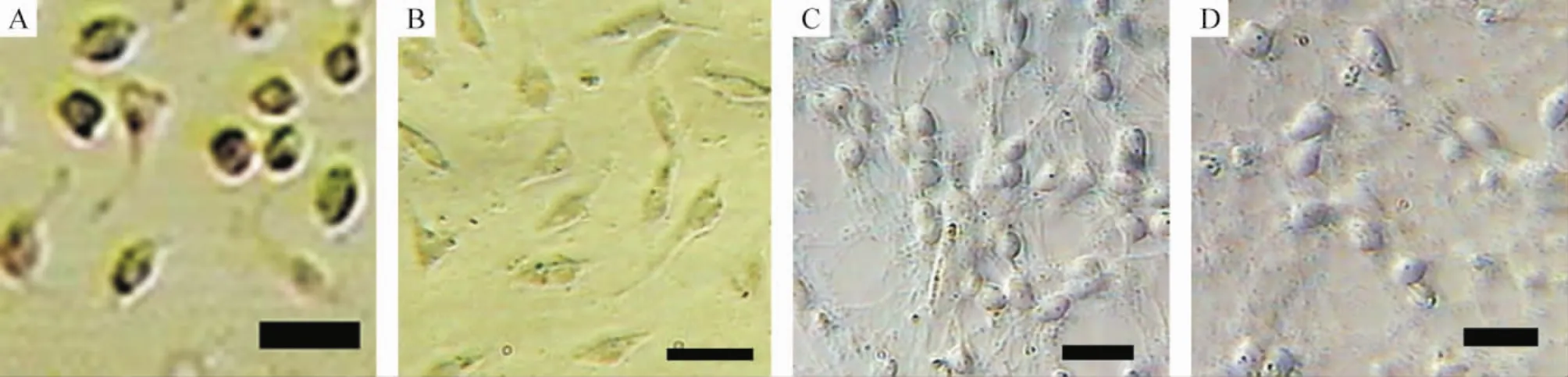
Figure 1.Biological characteristics of MSCs modified by human β-nerve growth factor(β-NGF)gene.A:immunopositive expression of β-NGF in genetically modified MSCs;B:negative expression of β-NGF in MSCs without genetic modification;C:neonatal mouse hippocampal neurons cultured with the cultural supernatant of MSCs transfected with pcDNA3-β-NGF;D:neonatal mouse hippocampal neurons cultured with the cultural supernatant of MSCs transfected with pcDNA3.Scale bar=100 μm.图1 重组β-NGF质粒转染的MSCs的生物学活性鉴定
3 移植细胞在脑内的分布与存活
β-NGF-MSCs组大鼠于移植点及邻近部位均可观察到荧光细胞,并可看到针道周围组织内有明显的细胞迁移。移植后4周可见针道已大部分愈合,针道周围及充填的组织内均可见大量的荧光细胞。移植后6周见针道完全愈合,移植点及周围组织仍可见荧光细胞,未见明显胶质瘢痕形成,表明外源性MSCs能在PD大鼠纹状体内存活并与周围组织建立良好的整合,见图2。
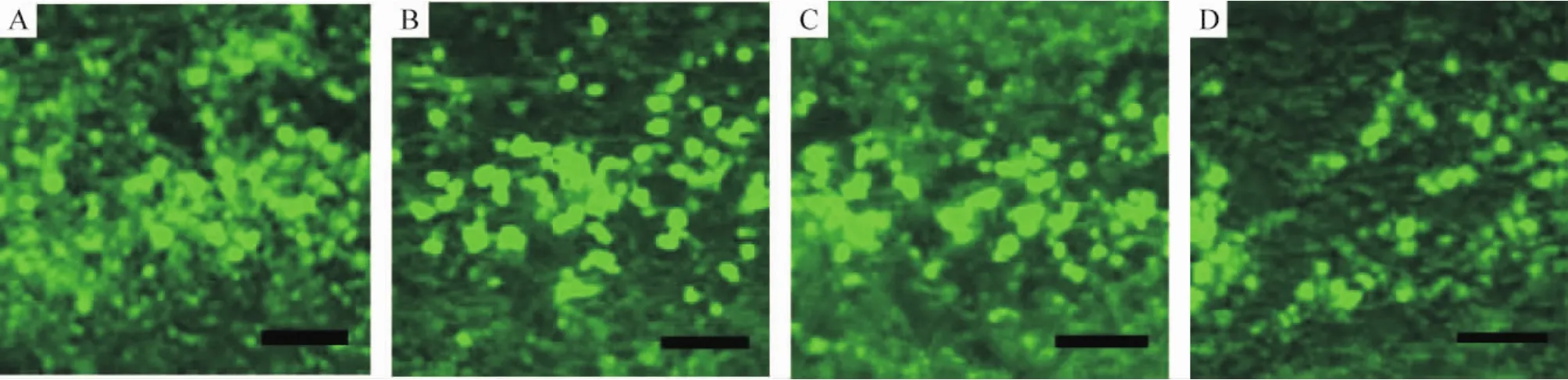
Figure 2.The distribution and survival of β-NGF gene-modified MSCs 1 day(A),1 week(B),4 weeks(C)and 6 weeks(D)after transplantation.Scale bar=100 μm.图2 重组β-NGF质粒转染的MSCs移植后在PD大鼠脑内的分布和存活
4 脑内移植细胞β-NGF的表达
β-NGF免疫组织化学染色结果显示,在重组β-NGF质粒转染的MSCs移植侧黑质纹状体区域内有明显呈弥漫分布的蓝黑色阳性染色,可见较多 β-NGF免疫阳性细胞围绕移植注射位置周围,分布在移植侧纹状体内,见图3。离移植位置越近,阳性细胞密度越高,较远位置则比较稀疏,与移植干细胞的迁移规律相吻合。在移植后4周及6周均可见β-NGF染色阳性的荧光细胞,表明重组β-NGF质粒转染的MSCs在PD模型大鼠纹状体内存活并持续表达β-NGF,见图3B、D。
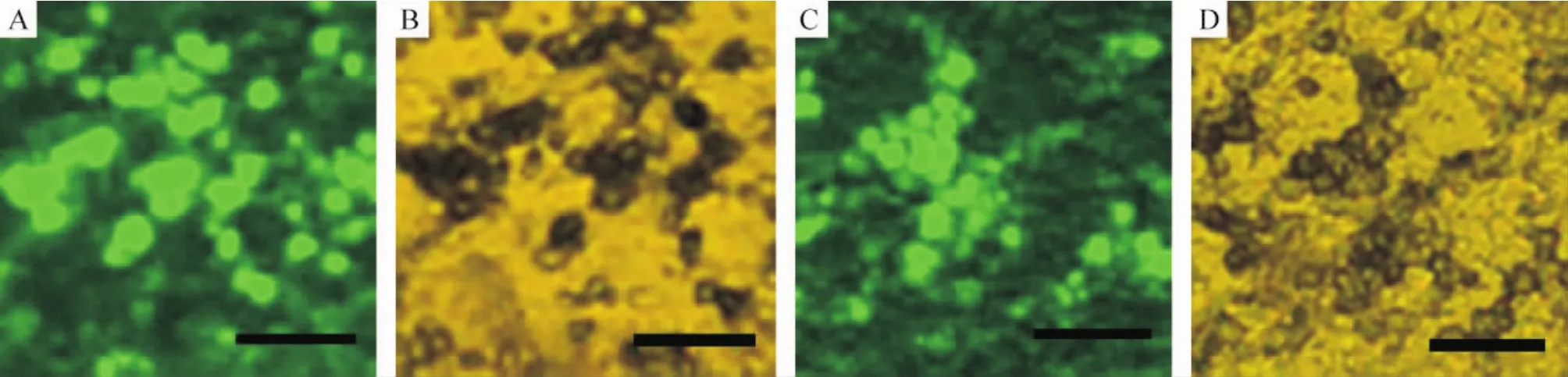
Figure 3.Immunohistochemical staining of β-NGF in PD rat brain tissues after transplantation of β-NGF gene-modified MSCs.A,B: 4 weeks after transplantation;C,D:6 weeks after transplantation.A,C:fluorescence microscopy;B,D:bright-field microscopy.Scale bar=100 μm.图3 重组β-NGF质粒转染的MSCs在PD大鼠脑内移植后β-NGF免疫组织化学染色结果
5 表达β-NGF的MSCs移植对PD模型动物行为学的影响
β-NGF-MSCs组和MSCs组在移植后2周,活跃程度、范围和自主觅食能力均较DMEM/F12组和PD模型组增加,移植后4周达到最佳状态。移植的2组PD大鼠在APO诱发后出现恒定左向旋转,移植术前平均旋转圈数差异无统计学意义(P>0.05);而术后4周及6周,2组的平均旋转圈数较DMEM/F12组和PD模型组明显减少,差异有统计学意义(P<0.05)。β-NGF-MSCs组和MSCs组间比较,平均旋转圈数减少,差异有统计学意义(P<0.05)。DMEM/F12组和PD模型组的旋转行为手术前后比较无明显变化(P>0.05),见表1。
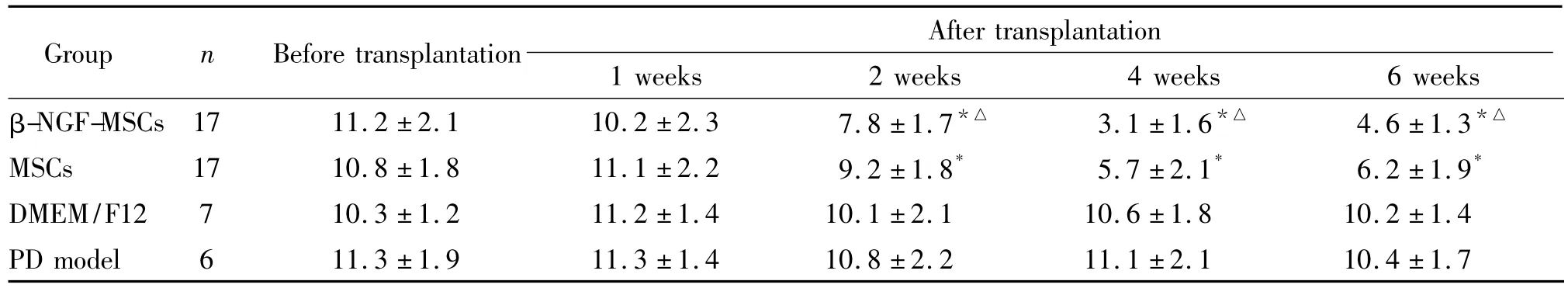
表1 阿朴吗啡诱发各组大鼠旋转行为的实验结果Table 1.The results of apomorphine-induced rotation(turns/min.Mean±SD)
讨论
治疗PD的关键是防止病情进展,修复已损害的DA能神经元,延缓不可逆损害的发生。目前临床以左旋多巴进行递质替代治疗,只能部分改善帕金森病的早期症状,不能阻止DA能神经元的持续变性。新兴的基因治疗和干细胞移植方法在临床前动物实验中显示出良好的治疗效果,已进行的少数临床实验也显示一定的疗效,这为PD的治疗带来新的希望[1-3]。
NGF主要由α、β和γ亚单位组成,不仅对神经细胞的生长、发育、分化起着重要的调节作用,还能提高损伤部位的神经递质酶活性,对PD、老年性痴呆、脊髓损伤等中枢神经系统疾病具有治疗作用[2]。汪军兵等[11]研究显示,NGF可通过抑制c-Jun氨基端激酶通路的活化,拮抗6-羟基多巴胺所诱导的PD模型大鼠肾上腺嗜铬细胞瘤细胞的凋亡。然而,NGF不能有效通过血脑屏障,在脑内很快降解,需要持续给药维持效果,且由于人体广泛存在NGF受体,易出现明显副作用[6]。因此,选择合适的给药方式向靶部位持续给药显得十分重要。将细胞替代治疗和NGF的神经营养能力联合应用可能是比较理想的给药方式。
研究显示,MSCs脑内移植可与损伤的细胞融合,替代受损细胞重建神经功能区和传导通路,减轻PD大鼠模型的运动功能障碍,缓解和逆转病情[1,3]。β亚单位是NGF完整的生物活性单位,不仅对神经细胞分化和生长具有有效的神经营养作用,还可诱导MSCs向神经元分化和生长[7]。因此,将重组β-NGF质粒转染的MSCs移植治疗PD,不仅可持续表达β-NGF发挥神经营养作用,还有助于增加移植细胞的存活率,提高移植的效率,可能对PD的治疗更加有益。
GFP转基因小鼠MSCs表达绿色荧光蛋白,较好地解决了细胞标记问题,便于观察生物学变化。本研究显示,重组β-NGF质粒转染的GFP转基因小鼠MSCs培养上清液中的产物可促进新生小鼠海马神经元的突起生长,具有明显的生物学活性,其效果优于单独使用MSCs对神经元的生长作用。丁洁等[7]的研究显示,NGF转染MSCs不仅可高效表达目的蛋白,还可促进MSCs向神经元方向分化。由此可见,β-NGF转染MSCs后移植治疗 PD可能具有协同作用。
本研究中,在移植后2周,动物行为学检测发现β-NGF-MSCs组和MSCs组的平均旋转圈数比PD模型组明显降低,说明MSCs的移植可在短时间内缓解PD症状,与黄月等[8]的研究一致。移植后4和6周的研究结果显示,β-NGF-MSCs组和MSCs组的平均旋转圈数较PD对照组明显减少,说明MSCs能够长期改善PD症状;2组间比较结果显示重组质粒β-NGF转染MSCs移植治疗PD的作用优于单独应用MSCs移植治疗,提示β-NGF转染MSCs后移植治疗可协同改善PD临床症状。
Blandini等[12]的研究显示,MSCs脑内移植后可与损伤细胞融合,替代受损细胞,重建DA能神经元功能区。Cova等[13]和Kim等[14]研究发现MSCs还可通过分泌神经营养因子和抗炎等机制对DA能神经元产生保护作用。另一些研究则发现VEGF和GDNF基因修饰的MSCs移植治疗PD的效果优于单纯应用 MSCs治疗[15-16]。因此,MSCs具有作为PD细胞和基因治疗种子细胞的独特优势,移植的MSCs可在体内分化为神经细胞,分泌具有免疫调节功能的因子,使变性的DA能神经元得到一定程度的再生和修复。
Isao等[17]的研究表明,表达 β-NGF的细胞在PD模型鼠脑内的移植能够提供良好的治疗效果。本研究结果显示,不仅外源性的MSCs能在PD大鼠纹状体内存活并与周围组织建立良好的整合,而且重组β-NGF质粒转染的MSCs在PD模型大鼠纹状体内存活并持续表达β-NGF,两者共同的保护作用改善了PD模型大鼠的症状。这可能是因为β-NGF转染MSCs后能够持续、稳定表达,并对DA能神经元产生营养、支持和保护作用,同时也可能使一些具有分化潜能的前体细胞在β-NGF和MSCs分泌的细胞因子的共同作用下诱导、分化成新的 DA能神经元。
近来,流行病学和遗传学研究显示炎症在PD的病理机制中具有重要作用,临床前动物实验也证实:炎症可能是引起多种病理机制级联反应最终导致多巴胺能神经元变性缺失的主要因素[18-19]。研究显示,NGF可调节中枢神经系统微环境,通过下调浸润T淋巴细胞IFN-γ分泌和促进神经胶质细胞中IL-10的表达,诱导抗炎作用[5]。这也可能与β-NGF转染MSCs后移植治疗可改善PD临床症状的作用相关,未来可对此作进一步深入研究。
本研究结果显示,重组β-NGF质粒转染的MSCs移植治疗后,PD模型动物的行为学得到显著改善,同时移植的细胞6周后在纹状体内仍然存活并表达β-NGF蛋白,为今后从转基因技术应用NGF治疗PD提供了重要的实验依据。应用转基因技术在PD脑内持续表达β-NGF来治疗PD是一种重要的转基因细胞移植治疗策略,通过这种崭新的治疗方法可以有效控制PD的病理进程,改善患者的临床症状,恢复受损脑区的功能,从而更彻底地解除患者的痛苦。
[1]Glavaski-Joksimovic A,Bohn MC.Mesenchymal stem cells and neuroregeneration in Parkinson's disease[J].Exp Neurol,2013,247:25-38.
[2]Allen SJ,Watson JJ,Shoemark DK.GDNF,NGF and BDNF as therapeutic options for neurodegeneration[J].Pharmacol Ther,2013,138(2):155-175.
[3]Uccelli A,Laroni A,Freedman MS.Mesenchymal stem cells for the treatment of multiple sclerosis and other neurological diseases[J].Lancet Neurol,2011,10(7): 649-656.
[4]Remy S,Tesson L,Usal C,et al.New lines of GFP transgenic rats relevant for regenerative medicine and gene therapy[J].Transgenic Res,2010,19(5):745-763.
[5]Colafrancesco V,Villoslada P.Targeting NGF pathway for developing neuroprotective therapies for multiple sclerosis and other neurological diseases[J].Arch Ital Biol,2011,149(2):183-192.
[6]Saragovi HU,Gehring K.Development of pharmacological agents for targeting neurotrophins and their receptors[J].Trends Pharmacol Sci,2000,21(3):93-98.
[7]丁 洁,高 山,程 焱,等.神经生长因子、Noggin基因转染对骨髓间充质干细胞分化的影响[J].中华神经医学杂志,2010,9(6):553-557.
[8]黄 月,常 成,张杰文,等.TH-NTN基因修饰的骨髓间充质干细胞对帕金森病模型大鼠脑内相关蛋白表达的影响[J].中华医学杂志,2012,92(33):2353-2356.
[9]李杏肖,李晓红,林秋雄,等.转染isl1基因促进骨髓间充质干细胞向心肌样细胞分化[J].中国病理生理杂志,2012,28(1):131-135.
[10]毕 涌,洪 娟,李力群,等.重组质粒pcDNA3-β-NGF的构建及其转染小鼠骨髓间充质干细胞生物学活性的研究[J].中国病理生理杂志,2013,29(11): 2082-2087.
[11]汪军兵,胡景鑫.JNK信号转导通路在NGF抗6-OHDA诱导PC12细胞凋亡中的作用[J].中国病理生理杂志,2010,26(2):277-281.
[12]Blandini F,Cova L,Armentero MT,et al.Transplantation of undifferentiated human mesenchymal stem cells protects against 6-hydroxydopamine neurotoxicity in the rat[J].Cell Transplant,2010,19(2):203-217.
[13]Cova L,Armentero MT,Zennaro E,et al.Multiple neurogenic and neurorescue effects of human mesenchymal stem cell after transplantation in an experimental model of Parkinson's disease[J].Brain Res,2010,1311:12-27.
[14]Kim YJ,Park HJ,Lee G,et al.Neuroprotective effects of human mesenchymal stem cells on dopaminergic neurons through anti-inflammatory action[J].Glia,2009,57(1): 13-23.
[15]Xiong N,Zhang Z,Huang J,et al.VEGF-expressing human umbilical cord mesenchymal stem cells,an improved therapy strategy for Parkinson's disease[J].Gene Ther,2011,18(4):394-402.
[16]Wu J,Yu W,Chen Y,et al.Intrastriatal transplantation of GDNF-engineered BMSCs and its neuroprotection in lactacystin-induced Parkinsonian rat model[J].Neurochem Res,2010,35(3):495-502.
[17]Isao D,Takashi O,Takashi I,et al.Congrafting with polymer-encapsulated human nerve growth factor-secreting cells and chromaffin cell survival and behavioral recovery in hemiparkinsonian rats[J].J Neurosurg,1996,84(6): 1006-1012.
[18]Glass CK,Saijo K,Winner B,et al.Mechanisms underlying inflammation in neurodegeneration[J].Cell,2010,140(6):918-934.
[19]毕 涌,洪 娟,李 佳,等.调节性T细胞缓解帕金森病中多巴胺神经元炎性损伤[J].国际神经病学神经外科学杂志,2013,40(4):341-345.
Effect of human β-NGF gene-modified bone marrow-derived mesenchymal stem cells on rotational behavior of rats with Parkinson disease
BI Yong1,2,HONG Juan3,LIN Xiao-bin2,LI Xiao-li2,WEI Peng4,SHI Zhen-jiang4,HUANG Gui-qin4,WANG Ting-hua4,ZHANG Xu1,2
(1Department of Neurobiology,2Department of Neurology,The First Affiliated Hospital,3Department of Otolaryngology,The First Affiliated Hospital,Wenzhou Medical University,Wenzhou 325000,China;4Institute of Neuroscience,Kunming Medical College,Kunming 650031,China.E-mail:drzhangxu@live.cn)
AIM:To investigate the effect of human β-nerve growth factor(β-NGF)gene-modified bone marrow-derived mesenchymal stem cells(MSCs)transplantation on the rotational behavior improvement in a rat model of Parkinson disease(PD).METHODS:The rat model of PD was established successfully and the animals were divided into 4 groups:β-NGF-MSCs group(transplanted with 5×105β-NGF-engineered MSCs),MSCs group(transplanted with 5×105MSCs),DMEM/F12 group(5 μL transplantation medium was injected in the right striatum of the rats)and PD model group(without transplantation).The rotational scores were assessed 2 weeks,4 weeks and 6 weeks after transplantation.At different time points after transplantation,the rats were tested for apomorphine(APO)-induced rotational behavior and the brains of the PD model rats were examined by fluorescence microscopy and immunohistochemical staining.RESULTS:Transplantation of human β-NGF gene-modified MSCs effectively improved the behavioral performance in the rats.At the 2nd,4th and 6th weeks after cell transplantation,the rotational frequencies after injection of APO decreased significantly in β-NGF-MSCs group compared with MSCs group and PD group(P<0.05).Both β-NGF gene-modified MSCs and MSCs survived in the brains of PD model rats,had good compatibility with the host cells,and showed no signs of destroying thehost and the glial cicatrisation.The β-NGF gene-modified MSCs expressed β-NGF stablely in the brains of PD model rats,and showed obvious improvement of the rotational behavior in the PD model rats induced by APO compared with MSCs group.CONCLUSION:The behavior of the rats with PD is significantly improved by transplanting β-NGF-modified MSCs in right striatum,and β-NGF gene therapy has potential clinical value.
Parkinson disease;Nerve growth factor;Bone marrow-derived mesenchymal stem cells;Gene therapy
R363
A
10.3969/j.issn.1000-4718.2014.03.016
1000-4718(2014)03-0473-06
2013-08-20
2014-01-14
浙江省高校“十二五”神经生物学重点学科(No.204-071006);浙江省自然科学基金资助项目(No.Y2101091);
温州市科技计划项目(No.Y20100275;No.Y20130223)
△通讯作者Tel:0577-55579371;E-mail:drzhangxu@live.cn
