柚皮苷通过抑制瘦素通路对抗高糖引起的心肌细胞损伤*
2014-05-16刘付贞陈景福潘德茂田丽红郭润民
刘付贞, 陈景福, 潘德茂, 田丽红, 郭润民, 游 琼, 吴 铿△
(广东医学院附属医院1内分泌科,2心内科,广东湛江524001;3中山大学附属第一医院黄埔院区内科,广东广州 510700)
柚皮苷通过抑制瘦素通路对抗高糖引起的心肌细胞损伤*
刘付贞1, 陈景福2, 潘德茂3, 田丽红2, 郭润民2, 游 琼2, 吴 铿2△
(广东医学院附属医院1内分泌科,2心内科,广东湛江524001;3中山大学附属第一医院黄埔院区内科,广东广州 510700)
目的:探讨柚皮苷能否通过抑制瘦素通路保护H9c2心肌细胞,对抗高糖HG引起的损伤。方法:应用Western blotting法检测瘦素及瘦素受体(LEPR)的表达水平;细胞计数盒(CCK-8)测定细胞存活率;Hoechst 33258核染色荧光显微镜照相测定凋亡细胞的形态及数量的变化;双氯荧光素(DCFH-DA)染色荧光显微镜照相法检测胞内活性氧(ROS)水平;罗丹明123染色法测定线粒体膜电位(MMP)。结果:应用35 mmol/L葡萄糖(HG)处理H9c2心肌细胞6~24 h能上调瘦素表达,其中9 h时表达最多;HG处理心肌细胞1~24 h也能促进LEPR表达,其中12 h时表达最多;在HG处理心肌细胞前,80 μmol/L柚皮苷预处理2 h能明显抑制HG对瘦素及LEPR表达的上调作用;柚皮苷预处理2 h、瘦素拮抗剂预处理24 h或瘦素受体拮抗剂预处理2 h均能抑制HG引起的心肌细胞损伤,使细胞存活率增多,凋亡细胞数量和胞内ROS生成减少,MMP回升。结论:柚皮苷可通过抑制瘦素通路保护H9c2心肌细胞,对抗HG引起的损伤。
柚皮苷;瘦素;受体,瘦素;高血糖;心肌细胞
柚皮苷(naringin,NRG),又称柚甙、柑橘甙、异橙皮甙,是一种双氢黄酮类化合物,主要存在于葡萄柚和酸橙等的果皮和果实中。此外,柚皮苷也是中药化橘红、骨碎补等的主要有效成份。越来越多的研究证实,柚皮苷具有涉及面较广的药理和治疗作用,例如,抗氧化[1-2]、抗凋亡[3]、抗炎症[1-2,4]和降血脂[2]等。此外,柚皮苷还具有心肌保护作用[3]及降血糖作用[5]。最近,我们证实,柚皮苷可通过抑制p38丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)通路保护心肌细胞对抗高糖引起的损伤[3]。另方面,有报道指出,p38 MAPK的上游信号分子瘦素(leptin)参与糖尿病引起的心肌细胞肥厚的发生[6]。但是,瘦素是否参与高糖引起的心肌细胞损伤(包括细胞毒性、凋亡、氧化应激、线粒体损伤)以及柚皮苷能否通过调控瘦素通路对抗高糖引起的心肌细胞损伤尚未明了。
瘦素是一种由脂肪细胞和其它细胞(如心肌细胞)释放的分子量为16 kD的多肽,参与食欲与能量代谢的调节[7-8]。近年,不少的报道指出,瘦素也参与高血压内稳态调节及心血管病患的发生[6,9-10]。瘦素是通过瘦素受体而产生生理与病理生理作用。瘦素受体有广泛的组织分布,包括肾、胰腺、肺和心脏等[6,11]。但是,高糖及柚皮苷对瘦素受体表达有何影响迄今未见报道。
为了探讨上述问题,本研究应用35 mmol/L葡萄糖处理H9c2心肌细胞以建立高糖损伤心肌细胞模型[12],旨在探讨:(1)高糖处理心肌细胞不同时间对瘦素及其受体表达的影响;(2)柚皮苷对高糖诱导瘦素及其受体表达改变的影响;(3)柚皮苷能否通过调控瘦素-瘦素受体通路对抗高糖引起的心肌细胞损伤,为深入阐明高糖的心肌细胞损伤机制及柚皮苷的心肌保护机制提供新颖的实验依据。
材料和方法
1 材料
Naringin、DCFH-DA、Hoechst 33258、罗丹明123 (rhodamine 123,Rh123)、瘦素拮抗剂(leptin antagonist,LA)和瘦素受体拮抗剂[leptin receptor(LEPR) antagonist,ObRa]购自Sigma-Aldrich;细胞计数试剂盒8(cell counter kit-8,CCK-8)购自Dojindo Lab(日本);DMEM-F12培养基购于Hyclone;特级胎牛血清(FBS)购自Gibco;抗leptin抗体和抗LEPR抗体购自Cell Signaling technology Inc;H9c2心肌细胞由中山大学实验动物中心提供。
2 方法
2.1 细胞培养 H9c2心肌细胞来源于大鼠胚胎期心脏组织,培养于含10%胎牛血清的DMEM-F12培养基,置于5%CO2、37℃的温箱中培养。
2.2 实验分组 实验分为8组:(1)正常对照(control)组;(2)高糖(high glucose,HG)损伤组;(3) NRG预处理+高糖损伤组:80 μmol/L NRG作用于H9c2心肌细胞2 h,撤去,用PBS洗2次,接着用35 mmol/L葡萄糖作用24 h;(4)LA预处理+高糖损伤组:50 μg/L LA作用于H9c2心肌细胞24 h,撤去,用PBS洗2次,接着35 mmol/L葡萄糖作用24 h;(5) ObRa预处理+高糖损伤组:25 μg/L ObRa作用于H9c2心肌细胞2 h,撤去,用PBS洗2次,接着用35 mmol/L葡萄糖作用24 h;(6)NRG组:80 μmol/L NRG作用于H9c2心肌细胞2 h;(7)LA组:50 μg/L的LA作用于H9c2心肌细胞24 h;(8)ObRa组:25 μg/L ObRa作用于H9c2心肌细胞2 h。
2.3 Western blotting法检测瘦素和瘦素受体蛋白的表达水平 将H9c2心肌细胞接种于35 mm培养皿中,培养至80%面积时,各实验组给予不同的处理因素后,用预冷的PBS洗3次,加入裂解液,4℃静置30 min,12 000 r/min离心10 min,取上清,然后采用BCA法进行蛋白定量。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移到PVDF膜上。用5%脱脂奶粉封闭60 min,随后分别加入抗 p-瘦素抗体(1∶1 000)和抗瘦素受体抗体(1∶1 000),4℃过夜,然后用TBST洗3次(每次5 min)。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。实验重复5次。
2.4 细胞存活率的测定 将H9c2心肌细胞接种于96孔培养板中,心肌细胞生长到占培养孔面积大约80%时,上述各实验组经不同的处理因素作用后,于每孔中加入10 μL CCK-8和90 μL DMEM-F12,轻摇,37℃孵育2.5 h,用酶标仪(λ=450 nm)记录各孔吸光度(A)。取5孔A值的平均数,按下列公式计算细胞存活率:细胞存活率(%)=处理组A/对照组A×100%。实验重复5次。
2.5 Hoechst 33258核染色法测定细胞凋亡 将H9c2心肌细胞接种于24孔培养板中,在细胞生长到占培养孔面积大约80%时,上述各实验组经不同的处理因素作用后,弃去培养基,PBS冲洗3次,然后用4%多聚甲醛于4℃环境中固定10 min,PBS冲洗3次,加入含5 mg/L Hoechst 33258试剂,于37℃温箱孵育30 min,然后用PBS冲洗3次。在荧光显微镜下(TE-2000;Nikon)摄片,染色质呈均匀分布,核被染成均匀蓝色的细胞被认为是正常的心肌细胞,如细胞核呈浓缩、碎裂的明亮蓝色,细胞则被认为是凋亡的心肌细胞,随机选取视野在荧光显微镜下摄片。实验重复5次。
2.6 细胞内活性氧(reactive oxygen species,ROS)的检测 将H9c2心肌细胞接种于24孔培养板中,当细胞生长到培养孔面积大约80%时,上述各实验组经不同的处理因素后,PBS冲洗 3次,用含 10 μmol/L的DCFH-DA染液于37℃温箱中孵育30 min,然后用PBS冲洗3次。在荧光显微镜下随机选取5个不重复区摄片,用ImageJ 1.41软件分析5个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。实验重复5次。
2.7 线粒体膜电位(mitochondrial membrane potential,MMP)的测定 Rh123是一种能够被线粒体所吸收的荧光染料,线粒体对其摄取能力取决于其跨膜电位。根据荧光强度可以间接反映MMP的高低。将H9c2心肌细胞接种于24孔培养板中,当细胞生长到培养孔面积大约80%时,上述各实验组经不同的处理因素作用后,用PBS冲洗3次,用10 μg/L Rh123的无血清培养基于37℃温箱中孵育45 min,然后用PBS冲洗3次。在荧光显微镜下随机选取5个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh123的线粒体。用ImageJ 1.41软件分析5个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。实验重复5次。
3 统计学处理
实验数据用SPSS 16.0软件进行统计分析,数据以均数±标准误(mean±SEM)表示,组间比较采用单因素方差分析(One-way ANOVA),用LSD-t检验进行两两比较,以P<0.05为差异有统计学意义。
结果
1 高糖上调心肌细胞瘦素及其受体的表达水平
图1A显示,应用35 mmol/L葡萄糖(高糖,high glucose,HG)处理6~24 h均能明显促进H9c2心肌细胞瘦素的表达(P<0.01),其中处理9 h时,瘦素的表达达到最高峰。
图1B显示,应用HG处理H9c2心肌细胞1~24 h也能明显促进瘦素受体的表达(均P<0.01),其中处理12 h时,瘦素受体的表达增加最多。
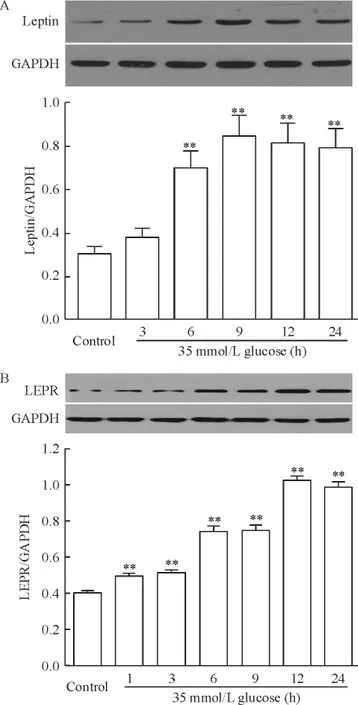
Figure 1.High glucose(35 mmol/L,HG)up-regulated the expression levels of leptin(A) and leptin receptor (LEPR;B)in H9c2 cardiac cells.Mean±SEM.n= 5.**P<0.01 vs control group.图1 高糖促进H9c2心肌细胞瘦素及其受体的表达水平
2 柚皮苷抑制高糖对心肌细胞瘦素及其受体表达的上调作用
图2A显示,应用HG处理H9c2心肌细胞9 h能促进瘦素的表达水平,与正常对照组比较,差异有统计学意义(P<0.01)。在HG处理心肌细胞前,应用80 μmol/L柚皮苷预处理2 h能明显地抑制HG对瘦素表达的促进作用,与HG处理组比较,差异非常显著(P<0.01)。单独应用80 μmol/L柚皮苷处理心肌细胞2 h,对瘦素的基础表达无明显影响(P>0.05)。
另外,由图2B可见,HG处理H9c2心肌细胞12 h能显著促进瘦素受体的表达(P<0.01),应用80 μmol/L柚皮苷预处理2 h也能明显阻断HG对瘦素表达的上调作用,与HG处理组比较,差异非常显著(P<0.01)。柚皮苷处理本身对H9c2心肌细胞对瘦素的基础表达无明显作用(P>0.05)。
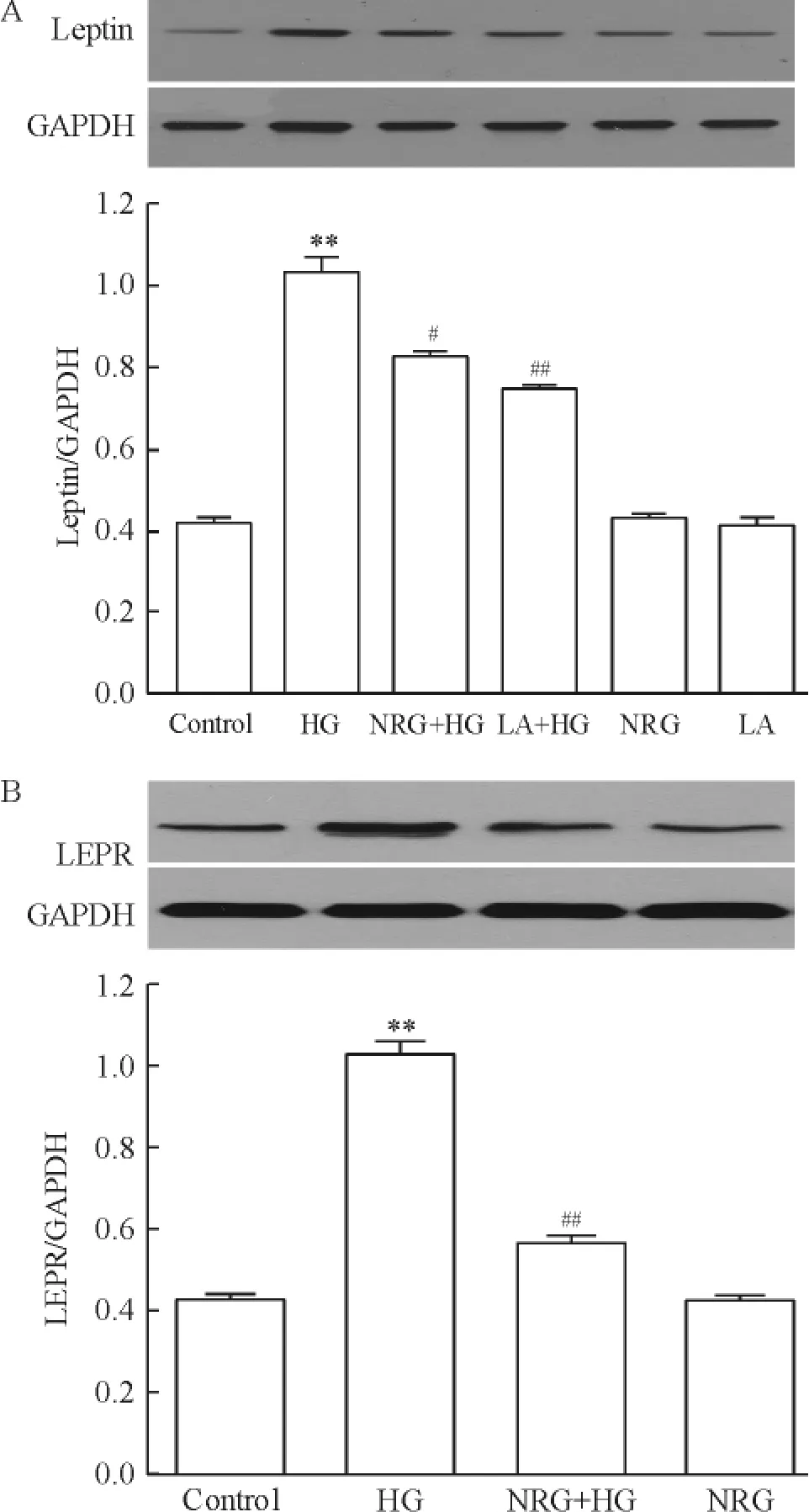
Figure 2.Naringin(NRG)inhibited high glucose(HG)-induced up-regulation of expression of leptin(A)and leptin receptor(LEPR;B)in H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;#P<0.05,##P<0.01 vs HG group.图2 柚皮苷抑制高糖对心肌细胞瘦素及其受体表达的促进作用
3 柚皮苷和瘦素通路抑制剂抑制高糖引起的心肌细胞毒性
图3显示,HG处理H9c2心肌细胞24 h产生明显的细胞毒性,使细胞存活率降低至(51.60± 0.23)%,与正常对照组比较,差异有统计学意义(P<0.01)。但是,在HG处理心肌细胞前,应用80 μmol/L柚皮苷预处理2 h能显著对抗HG引起的细胞毒性,使细胞存活率升高至(72.50±1.20)%,与HG处理组比较,差异明显(P<0.05)。另一方面,与柚皮苷的抗HG心肌细胞毒性的作用相似,在HG处理心肌细胞前,分别应用50 μg/L LA预处理24 h或25 μg/L ObRa预处理2 h也能抑制HG引起的细胞毒性,使心肌细胞存活率分别升高(78.50±1.90)%和(81.60±2.10)%,与HG处理组比较,差异均有统计学意义(均P<0.05)。单独LA或ObRa预处理本身对H9c2心肌细胞不产生细胞毒性(P>0.05)。
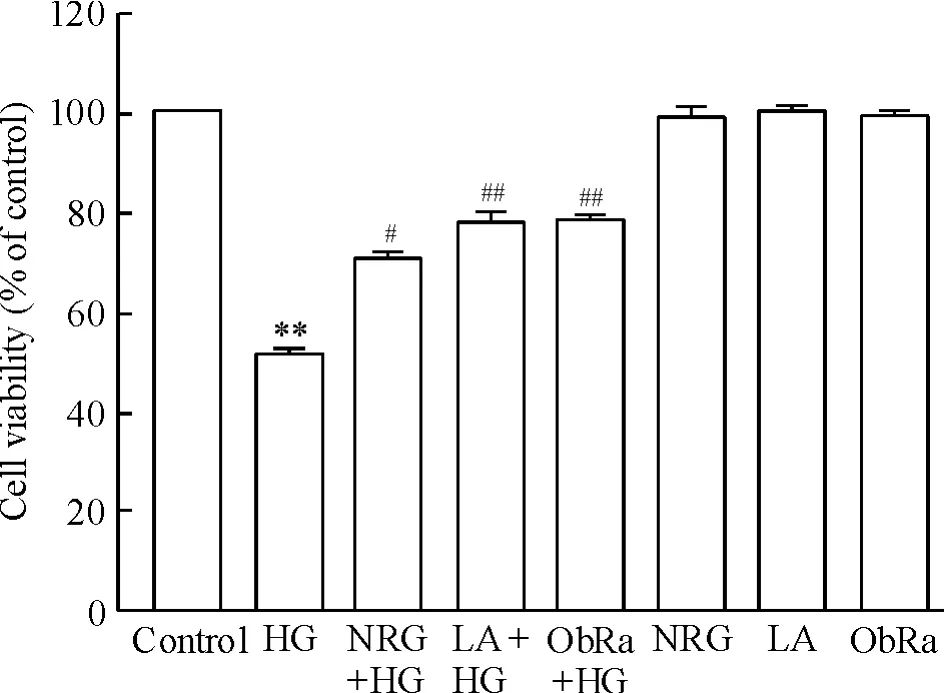
Figure 3.Both naringin(NRG)and the inhibitors of leptin pathway attenuated high glucose(HG)-induced cytotoxicity in H9c2 cardiac cells.LA:leptin antagonist; ObRa:leptin receptor antagonist.Mean±SEM.n=5.**P<0.01 vs control group;#P<0.05,##P<0.01 vs HG-treat group.图3 柚皮苷及瘦素通路抑制剂对抗高糖引起的心肌细胞毒性
4 柚皮苷和瘦素通路抑制剂抑制高糖的致心肌细胞凋亡作用
Hoechst 33258核染色的测定结果(图4)显示,正常的H9c2心肌细胞染色质均匀分布,表现为弥散均匀的低密度荧光。然而,应用HG处理H9c2心肌细胞24 h后,细胞呈现明显的凋亡特征,即细胞核呈现浓缩致密的固缩形态或颗粒荧光。但是,在HG处理心肌细胞前,应用80 μmol/L柚皮苷预处理2 h则能明显抑制HG对心肌细胞的致凋亡作用,使细胞凋亡率从(42.2±1.1)%(HG处理组)降低至(18.1±1.2)%,差异有统计学意义(P<0.01)。与柚皮苷的抗凋亡作用相似,50 μg/L LA预处理24 h或25 μg/L ObRa预处理2 h也分别使心肌细胞凋亡率降低至(17.3±0.9)%和(19.5±1.7)%(P<0.01)。单独用柚皮苷、LA或ObRa预处理本身不引起H9c2心肌细胞凋亡。

Figure 4.Both naringin(NRG)and the inhibitors of leptin pathway antagonized high glucose(HG)-induced apoptosis of H9c2 cardiac cells.LA:leptin antagonist;ObRa: leptin receptor antagonist.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图4 柚皮苷及瘦素通路抑制剂减轻高糖引起的心肌细胞凋亡
5 柚皮苷和瘦素通路抑制剂减轻高糖诱导的心肌细胞内活性氧堆积
图5显示,HG作用于H9c2心肌细胞24 h可使胞内DCFH的平均荧光强度(mean fluorescence intensity,MFI;能间接反映ROS水平)明显增强,与正常对照组相比,差异显著(P<0.01)。但是,80 μmol/L柚皮苷预处理2 h可使胞内ROS堆积减少,MFI从(31.9± 1.0)%(HG处理组)减少至(14.3±1.5)%(P<0.01)。与柚皮苷对ROS生成的抑制作用相似,50 μg/L LA预处理24 h或25 μg/L ObRa预处理2 h也能分别使 MFI减少至(15.7±2.1)%和(12.9± 1.8)%(均P<0.01)。单独柚皮苷、LA或ObRa预处理本身对胞内ROS生成无明显作用(P>0.05)。
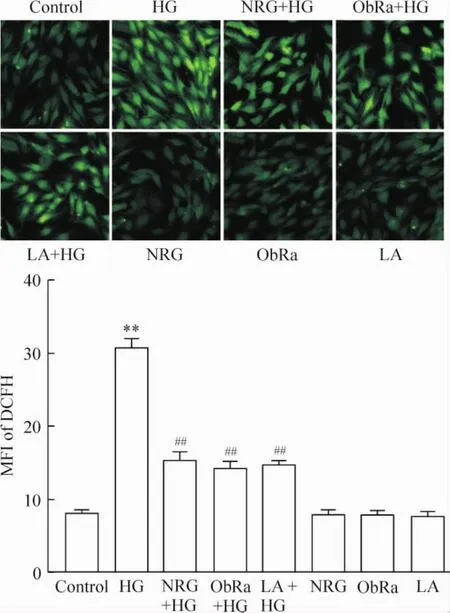
6 柚皮苷和瘦素通路抑制剂减轻高糖引起的心肌细胞线粒体膜电位下降
图6显示,HG作用H9c2心肌细胞24 h使胞内Rh123的MFI(反映MMP大小的指标)从(18.5± 2.2)%(正常对照组)降低至(4.8±0.9)%,2组差异非常显著(P<0.01)。然而,80 μmol/L柚皮苷预处理2 h可使MFI升高至(9.2±2.1)%,与HG处理组比较,差异非常显著(P<0.01)。与柚皮苷对MMP保护作用相似,50 μg/L LA预处理24 h或25 μg/L ObRa预处理2 h也能分别对抗HG对心肌细胞线粒体的损伤,使MFI分别增加至(8.7±1.7)%和(9.5±1.1)%(均P<0.01)。单独柚皮苷、LA或ObRa预处理本身对H9c2心肌细胞的MMP大小无显著作用。
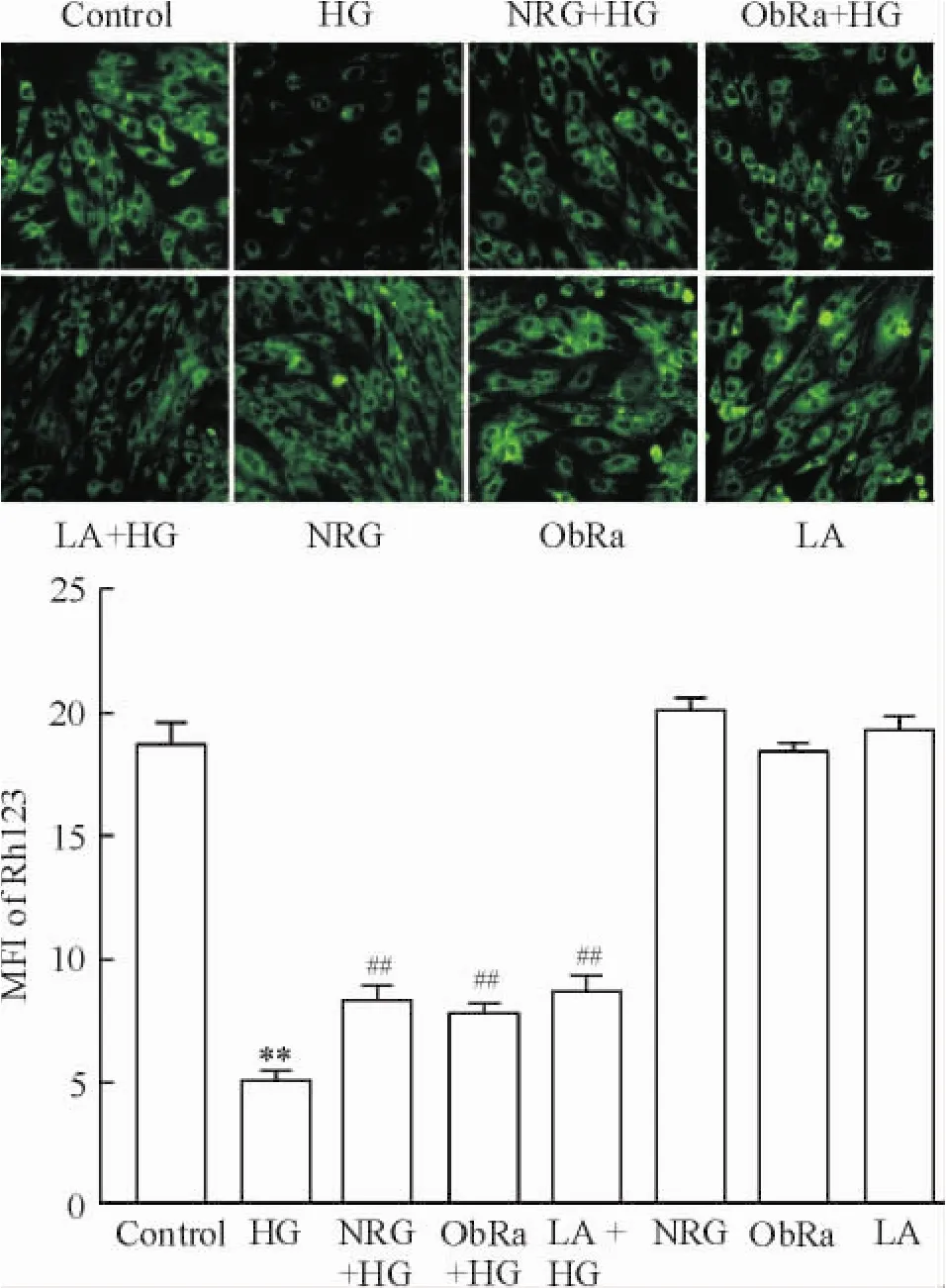
Figure 6.Both naringin(NRG)and the inhibitors of leptin pathway attenuated high glucose(HG)-induced decline in mitochondrial member potential(MMP)in H9c2 cardiac cells.LA:leptin antagonist;ObRa:leptin receptor antagonist.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图6 柚皮苷和瘦素通路抑制剂减轻高糖引起的心肌细胞线粒体膜电位下降
讨论
高血糖被认为是糖尿病的一个重要特征,是导致糖尿病慢性并发症的关键因素之一,如糖尿病心肌病(diabetic cardiomyopathy)。但是,迄今有关高糖引起心肌细胞损伤的病理生理机制尚未明了。本研究利用高糖损伤H9c2心肌细胞模型[12]再次证实,高糖对心肌细胞有明显损伤作用,表现为使细胞存活率降低、凋亡细胞增多、ROS生成增多及线粒体损伤(MMP丢失),这与前文的报道[3,12]相一致。
值得注意的是,本研究证实,高糖能明显促进心肌细胞瘦素的表达。瘦素最初主要被认为调节肥胖或体重。但是,近年有研究报道,瘦素参与心血管疾病的发生,如心肌细胞肥大[6]。Majumdar等[6]证实,高糖能增加新生大鼠心肌细胞表达瘦素和内皮素1,支持本研究的结果。由于瘦素的功能通过激活瘦素受体实现,本研究进一步观察高糖对H9c2心肌细胞瘦素受体表达的影响。研究结果表明,高糖在促进心肌细胞瘦素表达的同时,也能上调瘦素受体的表达,提示高糖能激活瘦素-瘦素受体通路。
为了证实瘦素-瘦素受体通路在高糖损伤心肌细胞中的作用,本研究观察了LA和ObRa对高糖损伤心肌细胞作用的影响,结果表明,瘦素拮抗剂和瘦素受体抑制剂均能明显抑制高糖引起的损伤,使细胞存活率升高,凋亡细胞数量和ROS生成减少,MMP回升,提示瘦素-瘦素受体通路的激活可能是高糖引起心肌细胞损伤的重要机制之一,这条通路的激活可能参与高糖引起的细胞毒性、凋亡、氧化应激及线粒体损伤等多种损伤作用。本研究为深入阐明高糖对心肌细胞的损伤机制提供了新颖的实验依据。
柚皮苷是一种双氢黄酮类化合物,除存在葡萄、葡萄柚等果实及果皮中外,还是中药化橘红、骨碎补等的主要有效成分,已被证实具有多方面的药理学作用,如抗凋亡[3]、抗氧化[1-2]、降血脂[2]和降血糖[5]等。最近,我们证实,柚皮苷可通过抑制p38 MAPK通路对抗高糖引起的心肌细胞损伤作用[3,12]。本研究进一步证实柚皮柑也能明显抑制高糖对心肌细胞瘦素和瘦素受体表达的上调作用,这为阐明柚皮苷抗高糖引起的心肌细胞损伤的机制提供了新的实验材料,也为应用食疗法或中药防治糖尿病引起的心血管损伤提供了新思路。由于p38 MAPK通路已被证实参与糖尿病的发生发展[13-15],在多种细胞实验模型,瘦素可激活p38 MAPK通路[16],因此,深入探讨瘦素-p38 MAPK通路在高糖损伤心肌细胞中的作用及柚皮苷的心肌保护作用有待今后进一步研究。
[1]Mahmoud AM,Ashour MB,Abdel-Moneim A,et al.Hesperidin and naringin attenuate hyperglycemia-mediated oxidative stress and proinflammatory cytokine production in high fat fed/streptozotocin-induced type 2 diabetic rats[J].J Diabetes Complicat,2012,26(6):483-490.
[2]Bodas R,Prieto N,López-Campos O,et al.Naringin and vitamin E influence the oxidative stability and lipid profile of plasma in lambs fed fish oil[J].Res Vet Sci,2011,91(1):98-102.
[3]Huang H,Wu K,You Q,et al.Naringin inhibits high glucose-induced cardiomyocyte apoptosis by attenuating mitochondrial dysfunction and modulating the activation of the p38 signaling pathway[J].Int J Mol Med,2013,32 (2):396-402.
[4]Nie YC,Wu H,Li PB,et al.Anti-inflammatory effects of naringin in chronic pulmonary neutrophilic inflammation in cigarette smoke-exposed rats[J].J Med Food,2012,15 (10):894-900.
[5]Adel AM,Mohamed BA,Ayman MM,et al.Insulin sensitizing effects of hesperidin and naringin in experimental kmodel of induced type 2 diabetes in rats:focus on tumor necrosis factor-alpha and resistin[J].Nat Sci,2011,7 (9):134-141.
[6]Majumdar P,Chen S,George B,et al.Leptin and endothelin-1 mediated increased extracellular matrix protein production and cardiomyocyte hypertrophy in diabetic heart disease[J].Diabetes Metab Res Rev,2009,25(5): 452-463.
[7]Tartaglia LA.The leptin receptor[J].J Biol Chem,1997,272(10):6093-6096.
[8]Murad A,Nath AK,Cha ST,et al.Leptin is an autocrine/paracrine regulator of wound healing[J].FASEB J,2003,17(13):1895-1897.
[9]Ren J.Leptin and hyperleptinemia:from friend to foe for cardiovascular function[J].J Endocrinol,2004,181 (1):1-10.
[10]Wallace AM,McMahon AD,Packard CJ,et al.Plasma leptin and the risk of cardiovascular disease in the west of Scotland coronary prevention study(WOSCOPS)[J].Circulation,2001,104(25):3052-3056.
[11]Lin J,Barb CR,Matteri RL,et al.Long form leptin receptor mRNA expression in the brain,pituitary,and other tissues in the pig[J].Domest Anim Endocrinol,2000,19(1):53-61.
[12]Chen J,Guo R,Yan H,et al.Naringin inhibits ROS-activated MAPK pathway in high glucose-induced injuries in H9c2 cardiac cells[J].Basic Clin Pharmacol Toxicol,2013,Oct 9[Epub ahead of print]
[13]Westermann D,Walther T,Savvatis K,et al.Gene deletion of the kinin receptor B1 attenuates cardiac inflammation and fibrosis during the development of experimental diabetic cardiomyopathy[J].Diabetes,2009,58(6): 1373-1381.
[14]Rajesh M,Mukhopadhyay P,Bátkai S,et al.Cannabidiol attenuates cardiac dysfunction,oxidative stress,fibrosis,and inflammatory and cell death signaling pathways in diabetic cardiomyopathy[J].J Am Coll Cardiol,2010,56 (25):2115-2125.
[15]庄晓东,廖新学.p38丝裂原活化蛋白激酶在糖尿病心肌病发病过程中的作用[J].中国病理生理杂志,2013,29(10):1859-1863.
[16] Zeidan A,Javadov S,Chakrabarti S,et al.Leptin-induced cardiomyocyte hypertrophy involves selective caveolae and RhoA/ROCK-dependent p38 MAPK translocation to nuclei[J].Cardiovasc Res,2008,77(1):64-72.
Naringin protects against high glucose-induced injury by inhibiting leptin pathway in H9c2 cardiac cells
LIU Fu-zhen1,CHEN Jing-fu2,PAN De-mao3,TIAN Li-hong2,GUO Run-min2,YOU Qiong2,WU Keng2
(1Department of Endocrinology,2Department of Cardiology,Affiliated Hospital,Guangdong Medical College,Zhanjiang 524001,China;3Department of Internal Medicine,Region of Huangpu,The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510700,China.E-mail:wukeng1245@hotmail.com)
AIM:To study whether naringin protects H9c2 cardiac cells against high glucose(HG)-induced injury by inhibiting the leptin pathway.METHODS:The expression levels of leptin and leptin receptor(LEPR)were detected by Western blotting.The cell viability was analyzed by CCK-8 assay.The changes of the morphology and the number of apoptotic cells were tested by Hoechst 33258 nuclear staining.The intracellular levels of reactive oxygen species(ROS) were measured by DCFH-DA staining.Mitochondrial membrane potential(MMP)was determined by rhodamine 123 staining.RESULTS:Treatment of the cells with 35 mmol/L glucose(HG)for 6~24 h up-regulated the expression of leptin in H9c2 cardiac cells with the peak value at 9 h.Treatment of the cells with HG for 1~24 h also enhanced the expression of LEPR,peaking at 12 h.Pretreatment with 80 μmol/L naringin for 2 h before exposure of the H9c2 cardiac cells to HG significantly inhibited the up-regulation of both leptin and LEPR induced by HG.Pretreatment of the cells with naringin for 2 h,leptin antagonist for 24 h,or leptin receptor antagonist for 2 h attenuated HG-induced injury in the cardiomyocytes,evidenced by an increase in cell viability,decreases in the number of apoptotic cells and intracellular ROS production as well as a recovery of MMP.CONCLUSION:Naringin may protect the cardiomyocytes against the HG-induced injury by inhibition of the leptin pathway.
Naringin;Leptin;Receptors,leptin;Hyperglycemia;Cardiomyocytes
R363
A
10.3969/j.issn.1000-4718.2014.03.008
1000-4718(2014)03-0423-07
2013-12-12
2014-01-28
湛江市财政资金科技专项竞争性分配项目(No.湛科[2011]79号);广东省重大科技专项(No.2012A080202020)
△通讯作者Tel:0759-2387412;E-mail:wukeng1245@hotmail.com
