鱼腥草挥发油和甲基正壬酮对LPS-TLR4/MD-2-TNF-α炎症通路的影响*
2014-05-15陈婧王文清施春阳侯小龙万进方建国
陈婧,王文清,施春阳,侯小龙,万进,方建国
(华中科技大学同济医学院附属同济医院药学部,武汉 430030)
鱼腥草挥发油和甲基正壬酮对LPS-TLR4/MD-2-TNF-α炎症通路的影响*
陈婧,王文清,施春阳,侯小龙,万进,方建国
(华中科技大学同济医学院附属同济医院药学部,武汉 430030)
目的 探讨鱼腥草挥发油及其单体甲基正壬酮对LPS-TLR4/MD-2-TNF-α炎症通路的影响。方法以TLR4/MD-2阻断剂封闭TLR4/MD-2位点,分别运用蛋白免疫印迹法(Western blot)和酶联免疫吸附测定法(ELISA)对鱼腥草挥发油和甲基正壬酮干预后细胞中TLR4蛋白和炎症因子肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素10(IL-10)的表达进行检测。同时建立二甲苯致小鼠耳肿胀炎症模型,对鱼腥草挥发油和甲基正壬酮的体内抗炎药效进行比较。结果在1~10 μg·mL-1浓度范围内短时干预时,鱼腥草挥发油对LPS诱导的RAW264.7细胞中TLR4蛋白的抑制作用优于甲基正壬酮,对炎症因子的作用与甲基正壬酮有一定差异。LPS+TLR4/MD-2阻断剂+药物干预组与LPS+TLR4/MD-2阻断剂组比较,以挥发油干预后细胞中TLR4蛋白的表达差异无统计学意义(P>0.05),而以甲基正壬酮干预后细胞中TLR4蛋白的表达明显减少。表明鱼腥草挥发油通过LPS-TLR4/MD-2-TNF-α通路发挥其抗炎作用,而甲基正壬酮可能通过其他途径发挥其抗炎作用。在相同剂量下鱼腥草挥发油的体内抗炎活性优于甲基正壬酮。结论鱼腥草挥发油与甲基正壬酮存在抗炎作用及机制的差异性,应是挥发油中多成分协同作用的结果。
鱼腥草;挥发油;甲基正壬酮;TLR4/MD-2;炎症通路
现有国内外文献报道鱼腥草抗炎作用机制的研究以对炎症递质尤其是细胞因子的影响居多,也涉及细胞信号通路、环氧化酶、基因转录、下丘脑-垂体-肾上腺轴和某些特定蛋白等方面[1]。尽管目前关于鱼腥草抗炎作用机制的研究已达到细胞和分子水平,但在基因水平和受体方面的研究仍然不足。有关挥发油中活性单体甲基正壬酮作用机制的研究也较少[2]。TLR4作为Toll样受体(Toll-like receptors,TLRs)家族中最早发现的亚型之一,可介导针对脂多糖(lipopolysaccharide,LPS)的免疫应答。在LPS-TLR4信号通路中,LPS与髓样分化蛋白-2(myeloid differentiation protein,MD-2)结合后,引起TLR4/MD-2复合物中TLR4的低聚活化,诱导TLR4的信号转导[3-5],随后分别激活下游MAPK等通路,作用于不同环节,从而影响TNF-α、IL-1β等炎症细胞因子的分泌。
鱼腥草挥发油作为一种多成分的复合物,其抗炎作用是否优于其活性单体,它们发挥抗炎作用的机制是否存在不同?本研究首先通过TLR4/MD-2阻断剂封闭TLR4/MD-2位点,研究鱼腥草挥发油和甲基正壬酮对TLR4蛋白表达的影响;结合它们对LPS诱导的炎症细胞因子如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-10分泌的影响,探讨它们作用于LPS-TLR4/MD-2-TNF-α通路的途径,同时采用二甲苯致小鼠耳肿胀急性炎症模型对两者的体内抗炎活性进行评价。通过对鱼腥草挥发油及其活性单体甲基正壬酮在受体方面作用机制的探讨,以期发现它们是否存在作用靶点的不同,有望为进一步研究与开发以鱼腥草为原料的抗炎新药提供信息。
1 材料与方法
1.1 动物 雄性清洁级昆明小鼠,体质量20~25 g,购自华中科技大学同济医学院实验动物中心,动物生产许可证号:SCXK(鄂)2010-0009,动物合格证号: 4209800221/231。小鼠饲养于控制环境条件中,温度(25±2)℃;相对湿度(70±5)%,以标准饲料喂养,使其自由饮水。实验开始前,小鼠禁食12 h,不禁水。所有动物实验均按照实验动物医学伦理审查委员会批准的动物协议和指南进行。
1.2 试药与细胞 TLR4/MD-2阻断剂(美国ebioscience公司,批号:E06992-1630),兔抗鼠TLR4抗体(英国Abcam公司,批号:GR23135-1),辣根过氧化物酶(horseradish peroxidase,HRP)标记的内参抗体试剂盒(美国Cell Signaling公司,批号:11/16/12),Marker(美国Thermo公司,批号:00124777);柯达X-OMATBT医用X射线胶片(批号:031802701),化学发光剂(美国Thermo公司,批号:OC182128);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Roche公司,批号:KZMA8338HK),BCA蛋白测定试剂盒(武汉启动子生物科技有限公司),RIPA(Radio-Immunoprecipitation Assay)裂解液(美国Sigma公司,批号:SLBD5707),显影液、定影液(武汉谷歌生物科技有限公司,批号: 20131203);RPMI 1640细胞培养液(南京凯基生物科技发展有限公司,批号:20130315);胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液(南京凯基生物科技发展有限公司,批号:20130131);LPS(Sigma-Aldrich Biotechnology生产,批号:111M4035V),胎牛血清(fetal bovine serum,FBS,HyClone公司,批号: NXC0583);TNF-α、IL-10、IL-1β的酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)试剂盒(美国eBioscience公司,批号依次为E09479-1641, E09382-1637,E09323-1639)。甲基正壬酮(美国ALORICH chemistry,含量99%,批号:MKBJ5580V),聚山梨酯-20,二甲亚砜(dimethyl sulfoxide,DMSO)和噻唑蓝(methyl thiazolyl diphenyl-tetrazolium bromide,MTT)均购自武汉启动子生物科技有限公司。鱼腥草挥发油为宜昌产鱼腥草药材以水蒸气蒸馏法自提所得,鱼腥草药材经华中科技大学同济医学院附属同济医院药学部方建国教授鉴定为三白草科植物蕺菜的新鲜全草。RAW264.7细胞由武汉博士德生物科技有限公司购得。
1.3 仪器 二氧化碳细胞恒温培养箱(3111型)、超高速冷冻离心机(Heraeus Multifuge X1R centifuge)、酶标仪(1510型)均为美国Thermo公司生产,倒置光学显微镜(CKX41型,日本OLYMPUS公司),超净工作台(SW-CJ-1D型,苏州净化设备有限公司),电泳仪电源(美国Bio-rad公司,PowerPacTMUniversal Power Supply),电泳槽(JY-SCZ2+型)、转移槽(北京君意东方电泳设备有限公司),脱色摇床(TS-8型,海门市其林贝尔仪器制造有限公司),分析天平(日本SHIMADZU公司,AUW220D型),塑料薄膜封口机(FS-200型,永康市特力包装机械有限公司),X射线摄影暗匣(广东粤华医疗器械有限公司)。
1.4 Western blot检测TLR4蛋白的表达
1.4.1 细胞培养与分组 以10%FBS 1640培养基培养RAW264.7细胞,待细胞生长至铺满培养瓶底(25 cm2)的90%时,以胰酶-EDTA消化,调整细胞浓度为5×105个·mL-1,将细胞接种于6孔板中(每孔2 mL),于恒温二氧化碳(CO2)细胞培养箱中培养24 h (37℃,5%CO2)。继以0.5%FBS 1640培养基进行细胞同步化处理24 h后分组,正常对照组:加新鲜0.5% FBS 1640培养基;LPS模型对照组:加含LPS 1 μg·mL-1的新鲜0.5%FBS 1640培养基;LPS+药物干预组:分别以含1,10 μg·mL-1的鱼腥草挥发油、甲基正壬酮的新鲜0.5%FBS 1640培养基培养1 h,弃去含药物培养基,加含LPS 1 μg·mL-1的新鲜0.5%FBS 1640培养基;LPS+TLR4/MD-2阻断剂组:以含10 μg·mL-1的TLR4/MD-2阻断剂的新鲜0.5%FBS 1640培养基预处理1 h,弃去阻断剂,加含LPS的新鲜0.5%FBS 1640培养基(LPS浓度为1 μg·mL-1); LPS+TLR4/MD-2阻断剂+药物干预组:以含10 μg·mL-1的TLR4/MD-2阻断剂的新鲜0.5%FBS 1640培养基预处理1h,弃去阻断剂,加含10 μg·mL-1鱼腥草挥发油、甲基正壬酮的新鲜0.5% FBS 1640培养基培养1 h,弃去含药物培养基,加含LPS 1 μg·mL-1新鲜0.5%FBS 1640培养基。
1.4.2 细胞总蛋白提取与测定 照上述分组处理完毕2 h后,用预冷的磷酸盐缓冲液(phosphate buffered solution,PBS)润洗培养板3次。将培养板于4℃倾斜放置0.5 h,吸去残余PBS,收集细胞。于冰上加RIPA裂解液,每孔50 μL,4℃平置0.5 h,将细胞刮下,转移至预冷的EP管中。以超高速低温离心机离心15 min, 4℃,12 000 r·min-1(有效离心半径9.64 cm),取上清液至新的预冷EP管中,-20℃保存。
照BCA蛋白测定试剂盒操作,绘制蛋白标准曲线,将样品的A562值扣去空白,代入标准曲线计算蛋白浓度。
1.4.3 聚丙烯酰胺凝胶电泳 根据样品的蛋白浓度和上样量确定合适上样体积,分别加5%的5×SDS和适量DDH2O,95~100℃水浴5 min使其变性,冷却后放置于冰上。上样后以恒定电压80 V电泳3~3.5 h,至溴酚蓝条带到达下部胶底部时停止电泳。以恒定电流300 mA,4℃条件下转膜2 h。将膜取出后置封闭液(含3%血清的TBST)中室温振摇封闭1 h。根据目标蛋白分子量将PVDF膜分段剪下,以TLR4抗体(1∶1 000)封膜,小心赶走气泡,于4℃放置过夜。次日将膜取出后以TBST洗脱5或6次,每次6~8 min,置加有适量HRP标记的二抗(1∶5 000)的培养皿中室温振摇孵育2 h,以TBST洗膜5或6次,每次6~8 min。加电化学发光剂(electrochemiluminescence, ECL)后压片,显影定影后运用IamgeJ软件以灰度值进行半定量分析。
1.5 TNF-α等细胞因子检测 以ELISA法检测药物干预后对细胞因子分泌水平的影响。RAW264.7细胞以1×106个·mL-1密度接种于96孔板,每孔200 μL,于37℃培养过夜。按照试剂盒说明进行抗体包被,配制清洗缓冲液(含0.5%聚山梨酯20的PBS溶液)。以PBS配制LPS溶液,使其终浓度为1 μg·mL-1。配制药物储备液浓度为50 mg·mL-1,以PBS逐级稀释,使其终浓度分别为0.1,1,10,20 μg·mL-1。分为正常对照组(培养液40 μL)、LPS模型对照组(培养液、LPS各20 μL)、药物干预组(不同浓度的药液、LPS各20 μL),培养过夜。次日取细胞上清液以PBS稀释20倍,每孔100 μL加入已包被抗体的96孔板,每组4个复孔。余操作按照试剂盒说明。
1.6 体内抗炎药效实验 分别将鱼腥草挥发油和甲基正壬酮给小鼠灌胃(灌胃量100 mg·kg-1),正常对照组给予同等体积的聚山梨酯-80(2%,灌胃样品溶剂),阳性对照组灌胃给予阿司匹林100 mg·kg-1,每组10只。末次给药后1 h,于小鼠右耳正反两面均匀涂布二甲苯20 μL。左耳不做任何处理。30 min后将小鼠脱颈椎处死,用电子耳肿打孔器在左右双耳相同位置处打下圆片(直径8 mm)。及时称定质量,以双耳的质量差异来衡量耳肿胀的程度。耳肿胀抑制率(%)=(正常对照组耳肿胀度-药物组耳肿胀度)/正常对照组耳肿胀度×100%。
1.7 统计学方法 应用SPSS17.0版软件进行数据处理,实验数据以均数±标准差(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 对TLR4蛋白表达的影响 在LPS诱导后, RAW264.7细胞中TLR4蛋白的表达显著高于正常对照组(P<0.01),LPS+药物干预组中TLR4蛋白的表达均低于LPS模型组(P<0.05),鱼腥草挥发油和甲基正壬酮在高浓度(10 μg·mL-1)时对TLR4蛋白表达的影响较低浓度(1 μg·mL-1)时明显,同时高于正常对照组(P<0.05)。在1~10 μg·mL-1浓度范围内短时干预时,鱼腥草挥发油对TLR4蛋白的抑制作用优于甲基正壬酮。以TLR4/MD-2阻断剂阻断TLR4/MD-2位点后,显著抑制LPS诱导的RAW264.7细胞中TLR4蛋白的表达(P<0.01);在阻断TLR4/MD-2位点的基础上再加药物干预后,TLR4蛋白的表达与LPS+ TLR4/MD-2阻断剂组、LPS+药物干预组相比均有所下降,同时均低于LPS模型对照组中TLR4蛋白的表达(P<0.01)。LPS+TLR4/MD-2阻断剂+药物干预组与LPS+TLR4/MD-2阻断剂组比较,以挥发油干预后细胞中TLR4蛋白的表达差异无统计学意义(P>0.05),而以甲基正壬酮干预后细胞中TLR4蛋白的表达明显减少。结果表明,鱼腥草挥发油和甲基正壬酮可抑制LPS诱导的RAW264.7细胞中TLR4蛋白的表达,挥发油的这种作用可能是通过阻断TLR4/MD-2靶点而实现的,且呈一定的剂量依赖性。而甲基正壬酮可能通过其他途径发挥其抗炎作用。结果见图1。
2.2 对TNF-α、IL-1β、IL-10分泌的影响 与正常对照组比较,LPS刺激RAW264.7细胞后,TNF-α、IL-1β、IL-10的分泌显著增加(P<0.05),鱼腥草挥发油和甲基正壬酮在0.1~20.0 μg·mL-1范围内均能抑制LPS诱导的RAW264.7细胞中TNF-α、IL-1β的分泌(P<0.01或P<0.05),同时增加IL-10的分泌(P<0.05),且与浓度呈正相关。在0.1~10.0 μg·mL-1范围内,鱼腥草挥发油对IL-1β分泌的抑制作用略优于甲基正壬酮,对TNF-α的抑制作用不及甲基正壬酮,而对IL-10的作用和甲基正壬酮相当(P>0.05)。以20 μg·mL-1浓度作用于细胞时,鱼腥草挥发油对TNF-α的抑制作用显著优于甲基正壬酮(P<0.05)。结果见图2。
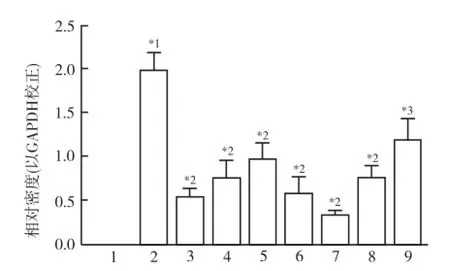
1.正常对照组;2.LPS模型对照组;3.LPS+鱼腥草挥发油(10 μg·mL-1)组;4.LPS+甲基正壬酮(10 μg·mL-1)组;5. LPS+TLR4/MD-2组;6.LPS+TLR4/MD-2+鱼腥草挥发油(10 μg·mL-1)组;7.LPS+TLR4/MD-2+甲基正壬酮(10 μg·mL-1)组;8.LPS+鱼腥草挥发油(1 μg·mL-1)组;9. LPS+甲基正壬酮(1 μg·mL-1)组;与正常对照组比较,*1P<0.01;与LPS模型对照组比较,*2P<0.01,*3P<0.05图1 鱼腥草挥发油和甲基正壬酮对LPS诱导的RAW264.7细胞中TLR4蛋白表达的影响1.Normal control group;2.LPS model group;3.LPS plus volatile oil from Houttuynia Cordata Thunb.(10 μg·mL-1) group;4.LPS plus 2-undecanone(10 μg·mL-1)group;5.LPS plus TLR4/MD-2 group;6.LPS plus TLR4/MD-2 and volatile oil from Houttuynia Cordata Thunb.(10 μg·mL-1)group;7.LPS plus TLR4/MD-2 and 2-undecanone(10 μg·mL-1)group;8.LPS plus volatile oil from Houttuynia Cordata Thunb.(1 μg·mL-1) group;9.LPS plus 2-undecanone(1 μg·mL-1)group.Compared with normal control group,*1P<0.01;Compared with LPS model group,*2P<0.01,*3P<0.05Fig.1 Effects of volatile oil and 2-Undecanone from Houttuynia Cordata Thunb.on TLR4 protein expression in LPS-induced RAW264.7 cells
2.3 体内抗炎药效实验结果 灌胃量同为100 mg·kg-1时,尽管给药组小鼠的耳肿胀抑制率均低于阳性对照组(36.4%),鱼腥草挥发油对小鼠耳肿胀的抑制率(23.3%)高于甲基正壬酮(17.9%),其差异有统计学意义(P<0.05)。
3 讨论
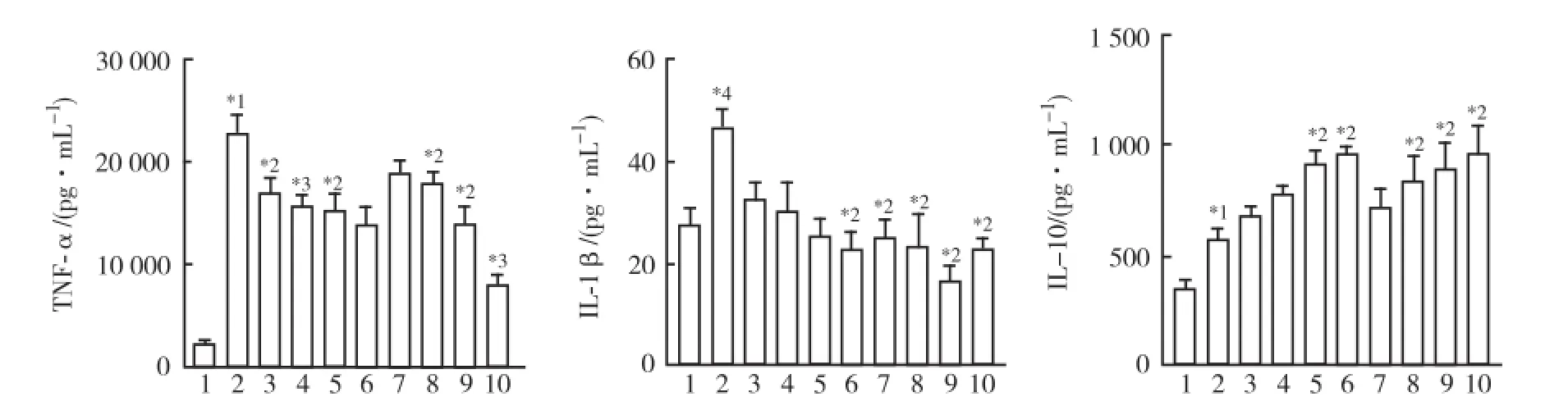
1.正常对照组;2.LPS模型对照组;3.LPS+甲基正壬酮(0.1 μg·mL-1)组;4.LPS+甲基正壬酮(1 μg·mL-1)组;5.LPS+甲基正壬酮(10 μg·mL-1)组;6.LPS+甲基正壬酮(20 μg·mL-1)组;7.LPS+鱼腥草挥发油(0.1 μg·mL-1)组;8.LPS+鱼腥草挥发油(1 μg·mL-1)组;9.LPS+鱼腥草挥发油(10 μg·mL-1)组;10.LPS+鱼腥草挥发油(20 μg·mL-1)组;与正常对照组比较,*1P<0.01,*4P<0.05;与LPS模型对照组比较,*2P<0.05,*3P<0.01图2 鱼腥草挥发油和甲基正壬酮对LPS诱导的RAW264.7细胞中细胞因子表达的影响1.Normal control group;2.LPS model group;3.LPS plus 2-undecanone(0.1 μg·mL-1)group;4.LPS plus 2-undecanone (1 μg·mL-1)group;5.LPS plus 2-undecanone(10 μg·mL-1)group;6.LPS plus 2-undecanone(20 μg·mL-1)group;7.LPS plus volatile oil from Houttuynia Cordata Thunb.(0.1 μg·mL-1)group;8.LPS plus volatile oil from Houttuynia Cordata Thunb. (1 μg·mL-1)group;9.LPS plus volatile oil from Houttuynia Cordata Thunb.(10 μg·mL-1)group;10.LPS plus volatile oil from Houttuynia Cordata Thunb.(20 μg·mL-1)group;Compared with normal control group,*1P<0.01,*4P<0.05;Compared with LPS model group,*2P<0.01,*3P<0.01Fig.2 Effects of volatile oil and 2-Undecanone from Houttuynia Cordata Thunb.on cytokine production in LPS-induced RAW264.7 cells
体内抗炎药效实验及其体外细胞实验结果表明,鱼腥草挥发油和甲基正壬酮均可抑制LPS诱导的RAW264.7细胞中TLR4蛋白的表达,并影响下游TNF-α、IL-1β、IL-10等细胞因子的分泌,从而发挥其抗炎作用。在1~10 μg·mL-1浓度范围内短时干预时,鱼腥草挥发油对细胞中TLR4蛋白的抑制作用优于甲基正壬酮,且鱼腥草挥发油在相同剂量下的体内抗炎活性也优于后者;但对细胞因子的作用并不绝对优于甲基正壬酮,在中低浓度时对IL-1β等炎症因子的影响与甲基正壬酮比较略优或相当,而在高浓度时对TNF-α分泌的抑制作用显著优于甲基正壬酮,应与其作用浓度与时间均相关。对LPS-TLR4/MD-2通路的研究结果表明,鱼腥草挥发油通过阻断TLR4/MD-2位点发挥其抗炎作用,而甲基正壬酮可能通过其他途径发挥其作用。经检测,鱼腥草挥发油中所含甲基正壬酮仅为330.5 mg·g-1[6],在同等给药剂量下,即给予100 mg·kg-1挥发油灌胃后,进入动物体内的甲基正壬酮仅为33.05 mg·kg-1,但挥发油的体内抗炎活性优于甲基正壬酮,表明鱼腥草挥发油发挥体内抗炎药效及其对LPS诱导的TLR4信号转导的影响是多成分协同作用的结果。
目前鱼腥草抗炎作用机制研究的对象主要集中在不同的溶剂提取物,如水提物、乙醇提取物等。中药提取物为多种成分的粗制剂,含有一些特定成分和其他生物活性物质,使其发挥药理作用分子机制的研究与开发应用受到较大的限制。开展中药及其单体成分的抗炎药效物质基础、作用特点、作用机制等系统、深入的综合性研究工作,可以为成分明确的新型抗炎药物的研发开辟新途径。因此,通过对鱼腥草提取物尤其是其有效单体抗炎作用机制的研究,有望为进一步研究与开发以鱼腥草为原料的抗炎新药提供依据。
[1] 陈婧,方建国,吴方建,等.鱼腥草抗炎药理作用机制的研究进展[J].中草药,2014,45(2):284-289.
[2] LI W F,NIU X F,ZHOU P,et al.A combined peritoneal macrophage/cell membrane chromatography and offline GCMS method for screening anti-inflammatory components from Chinese traditional medicineHouttuynia cordataThunb.[J]. Chromatographia,2011,73(7-8):673-680.
[3] PARK B S,SONG D H,KIM H M,et al.The structural basis oflipopolysacchariderecognitionbytheTLR4-MD-2 complex[J].Nature,2009,458(7242):1191-1195.
[4] ADEREM A,ULEVITCH R J.Toll-like receptors in the induction of the innate immune response[J].Nature,2000, 406(6797):782-787.
[5] FITZGERALD K A,ROWE D C,GOLENBOCK D T. Endotoxin recognition and signal transduction by the TLR4/MD2-complex[J].Microbes Infect,2004,6(15):1361-1367.
[6] CHEN J,WANG W Q,SHI C Y,et al.Determination of four volatile compounds with anti-inflammatory biological activity inHouttuynia cordataThunb.by gas chromatography and gas chromatography-mass spectrometry[J].Anal Lett,2014,47 (5):730-741.
DOI 10.3870/yydb.2014.10.007
Effects of Volatile Oil and 2-Undecanone from Houttuynia Cordata Thunb.on LPS-TLR4/MD-2-TNF-α Inflammation Signaling Pathway
CHEN Jing,WANG Wen-qing,SHI Chun-yang,HOU Xiao-long,WAN Jin,FANG Jian-guo
(Department of Pharmacy,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Houttuynia cordataThunb.;Volatile oil;2-Undecanone;TLR4/MD-2;Inflammation signal pathway
R285
A
1004-0781(2014)10-1283-06
2014-04-05
2014-06-10
*湖北省卫生厅中医药、中西医结合科研重点项目(2012Z-Z05)。
陈婧(1980-),女,湖北武汉人,主管药师,博士,研究方向:中药药效物质基础及其作用机制。电话:027-83649095,E-mail:cj8004@163.com。
方建国(1965-),男,主任药师,博士生导师,研究方向:中药药效物质基础及其作用机制。电话:027-83649095,E-mail:fjg3560@sina.com。
ABSTRACT ObjectiveTo explore the effects of volatile oil and 2-undecanone fromHouttuynia CordataThunb.(H. cordata)on LPS-TLR4/MD-2-TNF-α signaling pathway.MethodsTLR4/MD-2 blocking agent was used to mask the TLR4/ MD-2 site,then protein expression levels of TLR4 in cells treated with volatile oil and 2-undecanone were analyzed by western blot.ELISA was used to detect the secretion of the inflammatory cytokines such as TNF-α,IL-1β and IL-10.Comparison analysis was then performed from the results of cell experimentsin vitroand anti-inflammatory effects through xylene-induced ear edema testin vivo.ResultsIn concentrations between 1 to 10 μg·mL-1,Houttuynia volatile oil showed better effect than 2-undecanone on inhibition of TLR4 protein in LPS-induced RAW264.7 cells,and had some differences in the effects on inflammatory factors.Compared with the LPS+TLR4/MD-2 group,the LPS+TLR4/MD-2+volatile oil group had no significant difference in the expression of TLR4 protein(P>0.05),but the LPS+TLR4/MD-2+2-undecanone group reduced the expression of TLR4 protein obviously.It appeared that volatile oil exerts its anti-inflammatory effect through LPS-TLR4/MD-2-TNF-α pathway,but 2-undecanone may exert its anti-inflammatory effect by other means.Houttuynia volatile oil showed better antiinflammatory activity than 2-undecanonein vivoat the same dose.ConclusionThere are some differences in anti-inflammatory effects and related mechanisms between volatile oil and 2-undecanone,probably owing to the synergistic effects of multiingredients in the volatile oil.
