温度和CO2浓度升高下转Bt水稻种植对土壤活性碳氮和线虫群落的短期影响
2014-05-14陈法军刘满强党志浩李辉信
陈 婧,陈法军,刘满强,*,冯 运,党志浩,李辉信,胡 锋
(1.南京农业大学资源与环境科学学院土壤生态实验室,南京 210095;2.南京农业大学植物保护学院,南京 210095)
全球范围内的CO2浓度([CO2])和温度升高对农业生态系统产生日益严重的影响[1]。作物生长及其化学组成对[CO2]升高的反应非常敏感[2],大量研究表明了[CO2]升高导致作物对碳的吸收和同化增加,刺激植物根系生长和淀积物,从而提高土壤活性有机质的数量,并进一步激发土壤食物网结构和功能的改变[3,5]。土壤可溶性有机物作为土壤生态系统中最活跃的有机质组分,是土壤微生物可利用的主要物质和能量来源[6];相对于土壤有机质对温室气体和温度升高的响应更为敏感[5],土壤可溶性碳氮已成为气候变化下土壤生态系统响应的预警指标[8]。土壤生物作为土壤生态功能的关键驱动者,其群落结构的变化在农业生态系统服务功能中占据重要的地位[9]。大气[CO2]和温度升高不仅影响土壤活性碳氮及土壤微生物性质,而且进一步影响土壤食物网的结构和复杂性[10]。例如,线虫作为土壤食物网的重要组成部分,营养类群多样,能够灵敏反映环境变化下土壤生态系统的综合状况[11]。前人研究表明了线虫群落分析有助于了解全球气候变化下土壤食物网结构和功能的变化[12]。
水稻在农业生产中占据重要地位,虫害造成的水稻产量损失每年却高达一千万吨以上[6]。转Bt水稻的种植能够为降低水稻虫害损失提供一种有效手段[13],但转Bt水稻有可能对土壤理化性质和生物群落产生不利影响,进而对土壤生态系统的功能服务带来一定风险[14-15]。因此,加强转Bt作物对土壤生态系统的生态风险监测是其商业化推广的迫切需要。有关转Bt水稻对土壤可溶性碳氮及土壤线虫群落的评价研究逐渐增多[13-14],但对于全球气候变化条件下种植转Bt水稻对土壤生态系统的影响仍未见报道。因此,开展温度和[CO2]升高后转Bt水稻种植对土壤活性碳氮和线虫群落的影响研究,将有助于科学评价种植转Bt水稻在未来气候变化条件下对土壤生态系统的潜在生态风险。
1 材料与方法
1.1 试验材料
供试土壤采自山东省德州市宁津县(37.64°N,116.8°E),该地区之前主要种植棉花、玉米等旱地作物,土壤类型为蒙淤砂白土,系统分类属于潮土亚类潮砂土土属,耕作层(0—20 cm)土壤pH值体积分数为8.5,土壤有机碳(高温外热重铬酸钾氧化法)、全氮(开氏消煮法)、碱解氮(碱解扩散法)、速效磷(钼蓝比色法)和速效钾(火焰光度计法)含量分别为 6.6 g/kg、0.4 g/kg、7.9 g/kg、14.4 mg/kg 和 96 mg/kg。土壤基本性质的分析方法参见文献[16]。土壤取样深度0—20 cm,鲜土采集后剔除大中型土壤动物及根茬等。采用Φ24 cm×h32 cm的塑料盆钵,每盆放置土壤10 kg,水稻盆栽直播。出苗后每盆定植12株水稻。播种前底肥施入量为N(尿素)30 kg/hm2、(NH4)2HPO415 kg/hm2、KCl 15 kg/hm2。水稻生长期间的水分管理同大田,保持间歇性淹水状态。
1.2 试验方法
1.2.1 OTC气室管理与试验设计
试验地点位于在山东省德州市宁津县(37.64°N,116.8°E)气候变化与生物多样性和控害减排(联合)创新研究基地。开顶式气室(OTC)由CO2气源、CO2浓度控制系统和开顶式气室3部分组成。由红外 CO2测控仪 (Ventostat 8102,Telfaire Company,USA)自动监测和控制气室内CO2浓度。气室框架为铁结构,正八边形,高2.56 m,每边长为1.61 m,相当于直径4.20 m的柱体结构,整个气室体积约为21 m3。测控仪的控制参数:CO2浓度测定范围为0—10000 μL/L,控制范围为0—2000 μL/L;测控仪分辨率为 1 μL/L,反应时间 <60 s,年度漂移 ≤ 10 μL·L-1[17]。通过气室底部设施换气扇的个数多少控制温度。
本研究采用裂区(Split-plot)试验设计,以[CO2]和温度作为主区因子,以水稻品种作为裂区因子。主区中设置OTC气室内的[CO2]和温度各两个水平:正常浓度(实际测定值为 Ambient(382±6.6)μL/L)和高浓度(Elevated(657±10.7)μL/L)CO2;正常温度为(年平均温度测定值25.57±3.27℃)和较高温度(26.14±3.32℃)。每天6:00—20:00通入CO2以模拟环境[CO2]升高和气候变暖的气候变化环境,即正常温度(AT)和正常[CO2](AC)处理、正常温度(AT)和高[CO2](EC)处理、高温(ET)和正常[CO2](AC)处理以及高温(ET)和高[CO2](EC)处理,每个处理分别设3个重复,共计12个OTC气室。每一个OTC气室(面积17.6 m2)内种植的不同品种水稻盆钵为裂区。供试两个品种的水稻种植在塑料盆钵内,放置在不同处理的OTC气室内,每个气室内各品种重复3次。试验进行的时间为一个完整的水稻生长季节,2009年9月种植,2010年11月采样。在试验期内,同一OTC气室内的各盆钵随机排列,定期更换位置。
转Bt水稻选择华恢1号(HH1;转Cry1Ab/Ac基因抗虫恢复系)及相应的非转 Bt亲本明恢 63(MH63)。HH1由MH63为受体,通过基因枪介导的遗传转化方法将目的基因Cry1Ab/Ac转入受体细胞后所得的转基因株系TT51-1而来,该品系能专一且有效地控制水稻二化螟、三化螟和稻纵卷叶螟等靶标型鳞翅目害虫的发生。清水浸种12 h后用过氧化氢消毒20 min,再用清水冲洗干净,置于35℃阴处催芽,待露出胚根后以20株每盆的密度在盆栽容器中播种,最终每盆定株12株。采集土壤时进行破坏性采样,由于根系几乎分布于整个土体,因此盆钵内所有土壤均可视为根际土,采样时弃去靠近盆栽容器内壁的土壤,以减少边际影响。
1.2.2 土壤活性碳氮分析
土壤微生物生物量采用氯仿熏蒸-硫酸钾溶液浸提法[16],具体步骤为:称取相当于 10 g干土(105℃下24 h)的待测土样,加入1 mL氯仿搅匀,于25℃黑暗条件下密闭培养24 h,然后抽尽土壤残留氯仿,用0.5 moL/L K2SO4溶液浸提,体积分数为1∶4。280 r/min振荡30 min,定量滤纸过滤。熏蒸培养的同时,称取等量土样按照上述方法振荡浸提得对照滤液。吸取10 mL滤液,用K2Cr2O4容量法测定溶液中的有机碳含量。另取15 mL滤液,用半微量开氏法测定氮含量。熏蒸土样与未熏蒸土样的有机碳氮差值分别除以转换系数(KC0.38、KN0.54),计算土壤微生物生物量碳和氮的含量。
可溶性有机碳氮的测定采用蒸馏水浸提法,具体步骤为:称取相当于10 g干土的土壤样品,去离子水浸提,体积分数为1∶5,200 r/min振荡1 h,在 8000 g下离心10 min,上清液过孔径0.45 μm的醋酸纤维素滤膜,滤液碳氮含量的测定同微生物生物量碳氮测定方法。
土壤无机氮采用2 moL/L KCl溶液浸提[16],体积分数为1∶5,振荡30 min后用定量滤纸过滤,流动分析仪(Bran Luebbe,德国)测定滤液中的铵态氮和硝态氮含量。
1.2.3 线虫群落分析
采用蔗糖浮选离心法分离线虫[11]。线虫在立体显微镜下计数,在生物显微镜下鉴定到属,并划分不同营养类群(植食性线虫、食细菌线虫、食真菌线虫和捕/杂食线虫)和生活史c-p值[15]。线虫群落生态指数的计算:(1)线虫通道指数(NCR)为食细菌和食微(食细菌+食真菌)线虫数量之比。(2)富集指数(EI)主要用于评估食物网对可利用资源的响应。根据线虫功能团分别计算富集指数EI:EI=100×e/(e+b);其中,e代表食物网中的富集成分,主要指食细菌线虫中c-p值为1和食真菌线虫中c-p值为2的类群,b代表食物网中的基础成分,主要指食细菌线虫c-p值为2和食真菌线虫中c-p值为2的这两个类群[19]。
1.2.3 数据统计分析
数据分析采用 SPSS16.0软件,分析前利用Kolmogorov-Smirnov和Levene法检验数据的正态分布及方差齐性,并在必要时利用对数转换和反正弦平方根转换以满足中数据的正态分布假设。利用一般线性模型(General linear models,GLM)进行方差分析,以[CO2]和温度作为主区因子,以水稻品种作为裂区因子,各因子均为2水平。对于每个气室内的各水稻品种而言,数据取3个盆钵的平均值进行统计分析,以避免假重复问题。[CO2]、温度和水稻品种组合处理的均值显著性差异采用LSD方法进行检验(P<0.05)。
2 结果分析
2.1 土壤活性碳氮
温度和[CO2]升高对土壤可溶性碳(DOC)无显著影响,但转Bt水稻种植显著降低了DOC含量,并且受到温度和[CO2]的交互影响(表1,图1A)。温度和[CO2]升高显著影响转Bt水稻土壤可溶性氮(DON)和硝态氮(-N)含量(P<0.05,表 1)。不论转Bt水稻品种,温度和[CO2]升高都显著降低了DON(P<0.05,图 1)。正常温度和[CO2]条件下,转基因水稻(HH1)对DON产生显著影响;但在仅升高温度或[CO2]条件下,转Bt水稻显著降低了DON(P<0.05,图1)。土壤硝态氮含量与DON的变化趋势大体相反,但差异程度减少(图1)。所有处理中土壤铵态氮含量在 3.4—4.2 mg/kg范围,温度、[CO2]和水稻品种对其均无显著性影响(数据未列出)。

表1 温度、[CO2]和转基因水稻品种对土壤可溶性碳(DOC)、可溶性氮(DON)、硝态氮(NO-3-N)、微生物量碳(MBC)和微生物量氮(MBN)影响的方差分析结果(F值和显著水平)Table 1 ANOVAs results(F values and Probability level)on the effects of temperature(T),[CO2]and transgenic Bt treatment on soil dissolved organic C(DOC),dissolved organic N(DON),NO-3-N,microbial biomass C(MBC)and microbial biomass N(MBN)
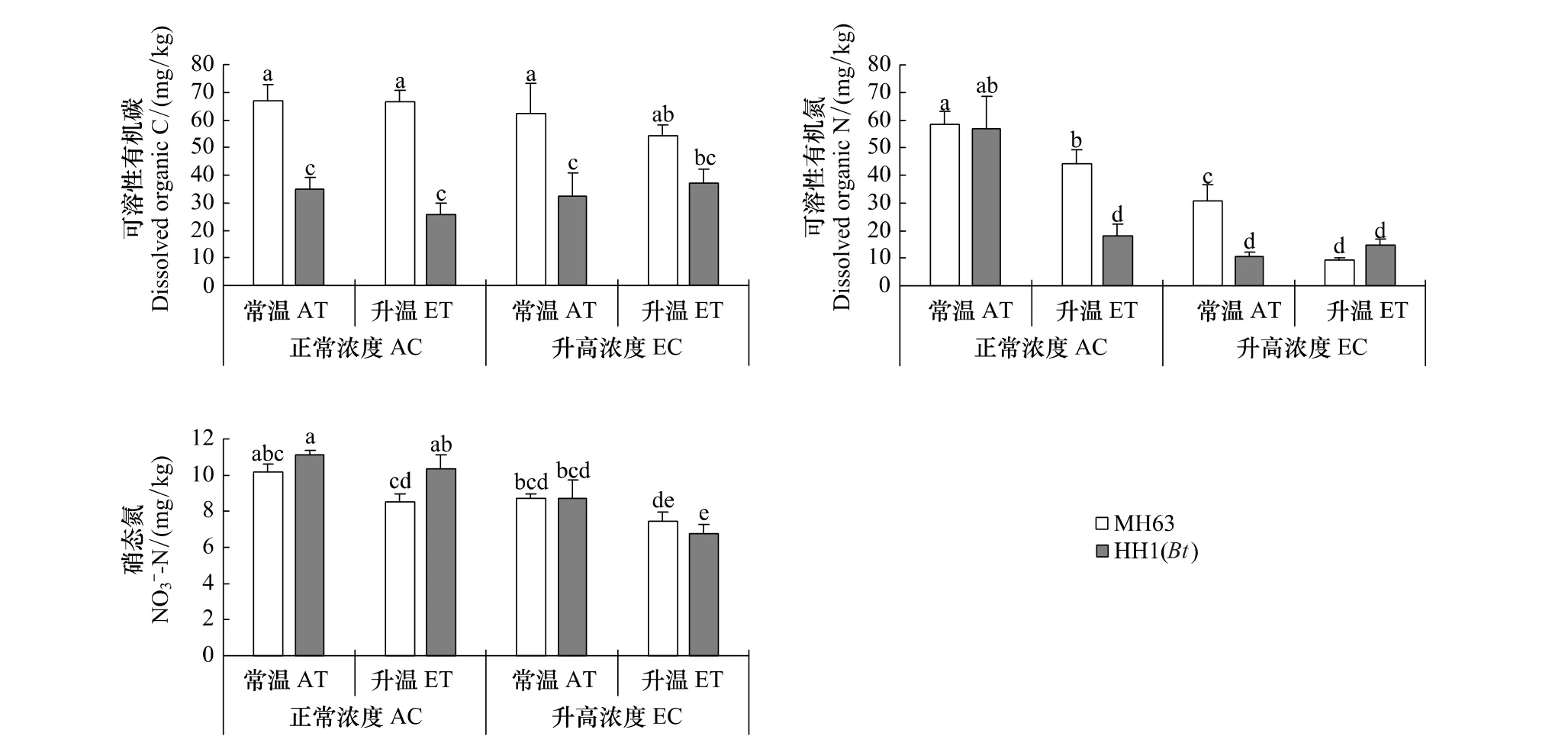
图1 非转Bt(MH63)和转Bt(HH1)水稻在常温(AT)、升温(ET)及正常CO2浓度(AC)和升高CO2浓度(EC)条件下对土壤可溶性碳氮和硝态氮(平均值±标准差)的影响Fig.1 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil dissolved organic carbon and nitrogen and nitrate nitrogen(Mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
2.2 土壤微生物量碳氮
温度、[CO2]和转 Bt水稻对土壤微生物量碳(MBC)和氮(MBN)有不同程度的影响(表1)。升温和[CO2]增高显著影响MBC和MBN,并且分别与水稻品种之间存在显著交互作用(P<0.05,表1)。在正常温度和[CO2]条件下,HH1种植后MBC显著低于MH63(图2)。不论[CO2]升高与否,升温后MH63种植下的MBC显著降低,但在HH1下显著增加(P<0.05),从而导致升温条件下HH1的MBC显著高于 MH63(P<0.05,图 2)。不论升温与否,[CO2]升高均增加MBN,且与转基因水稻有显著交互作用(表1)。在正常[CO2]下,转Bt水稻对MBN没有影响,而在[CO2]升高条件下,常温下HH1的MBN显著高于MH63(图2)。

图2 非转Bt(MH63)和转Bt(HH1)水稻在常温(AT)、升温(ET)及正常CO2浓度(AC)和升高(EC)条件下对土壤微生物生物量碳和氮(平均值±标准差)的影响Fig.2 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil microbial biomass carbon and nitrogen(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
2.3 土壤线虫群落
温度、[CO2]和转Bt水稻对土壤线虫总数均有显著影响,且温度与水稻品种之间存在显著交互作用(P<0.05,表 2)。在正常温度和[CO2]下,HH1与MH63处理间土壤线虫总数差异未达到显著差异(图3);但不论[CO2]升高与否,升温使得MH63下土壤线虫总数显著低于HH1(P<0.05,图3)。

表2 温度、[CO2]和转基因水稻品种对土壤线虫的总数、不同营养类群百分比及生态指数影响的方差分析结果(F值和显著水平)Table 2 ANOVAs results(F values and Probability level)of the effects of temperature(T),[CO2]and transgenic rice variety(Bt)on the abundance,the proportions of trophic groups and ecological indices of soil nematode community

图3 非转Bt(MH63)和转Bt(HH1)水稻在常温(AT)、升温(ET)及正常CO2浓度(AC)和升高(EC)条件下对土壤线虫总数(平均值±标准差)的影响Fig.3 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil nematode abundance(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
植食线虫比例没有受到转基因水稻的影响,但在温度和[CO2]升高条件下植食线虫比例发生显著变化(P<0.05,表 2)。例如,升高[CO2]后 MH63和HH1的植食者比例分别从12.0%和17.1%提高到34.4%和37.1%,但未达到显著差异(图4)。食细菌和食真菌线虫比例分别受到温度、[CO2]和转基因水稻不同程度的影响(P<0.05,表2),不论水稻品种如何,食细菌线虫在温度和[CO2]升高后显著降低(P<0.05,图4)。在正常温度和[CO2]下,转 Bt水稻显著增加了食细菌线虫比例,但其差异在温度和[CO2]升高下未达显著水平(图4)。不论温度和[CO2]升高与否,转Bt水稻种植降低了土壤食真菌线虫比例,但未达到显著差异水平(图4)。由于均值变异较大,没有检测到捕杂食线虫比例对温度、[CO2]及水稻品种变化的显著响应(图4)。

图4 非转Bt(MH63)和转Bt(HH1)水稻在常温(AT)、升温(ET)及正常CO2浓度(AC)和升高(EC)条件下对土壤线虫营养类群百分比(平均值±标准差)的影响Fig.4 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on the proportion of nematode trophic groups(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
温度、[CO2]和转 Bt水稻分别对通道指数(NCR)及富集指数(EI)产生不同程度的影响(表2)。[CO2]升高对 NCR没有影响,但在正常[CO2]下升温显著降低NCR;不论升温与否,转Bt水稻种植呈增加NCR的趋势,尤其在[CO2]升高下趋势明显(表3)。升温对EI没有显著影响,而在常温下[CO2]升高却降低EI。转Bt水稻在常温下及温度和[CO2]共同升高下呈增高EI的趋势(表3)。
3 讨论
全球气候变化能够通过根系影响进入土壤中的有机碳数量和质量[10],同时转Bt作物可以通过改变植物生长性状及Bt毒素释放而改变作物根系分泌物数量和组成[21],本研究利用野外开顶式气室(OTC)模拟气候变化,研究温度和[CO2]升高条件下转Bt水稻对土壤活性碳氮水平和线虫群落的影响。

表3 非转Bt(MH63)和转Bt(HH1)水稻对常温(AT)、升温(ET)及正常(AC)和升高(EC)CO2浓度条件下线虫群落生态指数的影响Table 3 Ecological indices of soil nematode community as affected by non-Bt(MH63)and transgenic Bt(HH1)rice varieties under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
研究表明,不论温度及[CO2]改变与否,转Bt水稻显著降低了DOC含量。李修强等[13]基于大田实验发现转Bt水稻对DOC和DON影响不明显。由于土壤可溶性有机物本身组成复杂,并受到根系分泌物及其刺激的微生物生长利用等的双向影响,因此不同研究间的差异可能与实验环境条件、土壤肥力、土壤生物群落及植物生长状况等有关[22]。本研究中温度和[CO2]升高条件下,亲本水稻下 DOC和DON呈降低趋势,但转Bt水稻种植下DOC呈升高趋势;在仅升高温度或[CO2]条件下,转Bt水稻显著降低了DON。一般而言,[CO2]升高可以导致更多的碳通过根系生长及分泌物分配到地下部土壤中[23]。Guo J等[23]利用 FACE 系统对稻田系统土壤可溶性碳氮的变化进行观测,也发现[CO2]升高显著增高了土壤DOC的含量,但DON没有显著变化。除了上述提到的原因外,由于土壤可溶性有机物组成的复杂性和微生物对温度的敏感性,土壤微生物群落的不同也会产生明显的影响[10]。DON的减少可能归因于[CO2]和温度升高刺激土壤生物群落驱动的氮素矿化过程。升高温度和[CO2]使土壤硝态氮含量显著降低可能源于植物生长量的增加对土壤养分的吸收。
有室内盆栽试验表明,转Bt水稻的种植降低土壤微生物量碳氮,这与田间条件下转Bt水稻对土壤微生物学性质的影响不完全一致[13]。然而,也有研究发现转Bt水稻在试验前期对土壤微生物学性质产生的短暂性影响,可能是由于Bt基因的插入导致作物农艺性状和生理特性(如水稻根系分泌物及根系化学组成)发生改变[24]。与种植其亲本的土壤相比,种植转Bt水稻后土壤微生物量碳氮对温度和[CO2]升高变化的响应趋势相反;温度和[CO2]升高使亲本水稻土壤中微生物量碳含量有降低的趋势,而温度和[CO2]升高条件下,转Bt水稻土壤中的微生物量碳氮呈升高趋势。转Bt水稻土壤中微生物量碳氮含量升高的可能原因,推测由于转Bt水稻对非靶标生物的生长可能有促进作用并且温度和大气[CO2]升高导致作物对C的吸收和同化增加,刺激植物根系生长和分泌物,从而提高土壤活性有机质的数量[23],并进一步通过土壤食物网影响土壤的微生物学性质。前人研究表明了[CO2]和温度升高对土壤微生物可以产生积极的、中立的和消极的影响[5,25-26]。此外,转 Bt克螟稻对土壤微生物学性质没有产生持续的负面影响,在某些采样时间甚至会表现出促进作用[13]。在模拟气候变化条件下,外源抗虫基因的导入使转Bt水稻对土壤微生物学性质的影响发生明显改变,并可朝不同的方向演变。因此,基于田间的模拟全球气候变化的长期动态监测实验将会有助于明确转Bt水稻的潜在生态风险。
温度和[CO2]升高均导致亲本水稻土壤线虫总数显著减少,却使转Bt水稻土壤线虫总数增加。亲本和转Bt水稻线虫总数的差异是由于转Bt蛋白的作用还是水稻生长的不同,目前还没有定论。并未发现转Bt水稻种植导致土壤Bt毒素的显著增加,因此推测影响线虫数量的主要因素是作物品种在农艺性状上的差异,而不是Bt毒素的影响[23]。前期的研究也证明了植物基因型的差异通过改变根系分泌物的质量、数量及释放进而影响土壤食物网中的植食者和分解者[11,13]。不论温度是否升高,[CO2]升高显著增加了土壤线虫总数,与前人的结果一致[27]。气候变化通过改变输入土壤的根系分泌物数量和质量影响土壤线虫群落结构[10]。与土壤微生物生物量的变化趋势相对应,温度和[CO2]升高导致HH1和MH63之间土壤线虫总数的变化趋势相反。土壤线虫的营养类群是反映土壤食物网营养级关系及能流途径的重要指标。大气[CO2]升高对土壤线虫不同营养类群产生的影响还没有定论[28],但本实验中植食性线虫的比例随[CO2]和温度升高而体现出升高的趋势。虽然未达到显著差异水平,但转Bt水稻对地下部非靶标植食者的影响及其生态学意义迫切需要进一步确认。
温度、[CO2]和转Bt水稻对土壤线虫能流通道指数和富集指数均有影响。温度和[CO2]升高使土壤线虫能流通道转向由真菌主导[30],这与最近Pritchard在综述中获得的结论一致[3]。转 Bt水稻对能流通道指数和及富集指数的影响在多数情况下表现出促进作用,说明不论气候变化与否,转Bt水稻能使土壤生态系统的能流通道偏向于真菌占主导地位,而土壤有效资源相对富集。由于实验进程相对较短及线虫生活史分类的不确定性[31],导致结果未达到显著差异,但是能流通道及土壤资源的改变必将对对土壤生态过程产生深远的影响[10],今后应加强全球气候变化条件下转基因作物对土壤食物网结构影响的研究。
4 结论
温度和[CO2]升高条件下,对转Bt水稻种植后土壤活性碳氮和线虫群落的响应格局表现出复杂的趋势。在正常温度和[CO2]条件下,转Bt水稻种植显著降低了土壤可溶性碳、微生物生物量碳及土壤线虫总数含量,但在温度和[CO2]升高后趋势相反。在升温和正常[CO2]下转Bt水稻降低了土壤可溶性氮含量,但增加了硝态氮含量。此外,温度和转Bt水稻显著影响土壤线虫能流通道指数,而[CO2]和转Bt水稻对线虫富集指数有显著影响。在正常温度和[CO2]条件下转Bt水稻对促进非靶标植食者增加的趋势值得关注。总之,模拟气候变化的短期盆栽实验并未发现转Bt水稻对土壤生态系统的不利影响。今后应结合水稻生长、水稻地上和地下部的碳氮分配过程及长期尺度的监测,以深入了解土壤生态系统结构和功能的响应机制,为系统评估转Bt水稻种植在未来气候变化条件下的潜在土壤生态风险提供依据。
致谢:英国作物与土壤系统研究组(SRUC)Bryan Griffiths教授润色英文摘要。
[1]Intergovernmental Panel on Climate Change.Report prepared for IPCC by Working Group III Mitigation of Climate Change.Cambridge University Press,2007,USA.
[2]Drigo B,Pijl A S,Duyts H,Kielak A M,Gamper H A,Houtekamer M J,Boschker H T S,Bodelier P L E,Whiteley A S,Van Veen J A,Kowalchuk G A.Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2.Proceedings of the National Academy of the Sciences ofthe United StatesofAmerica, 2010, 107:10938-10942.
[3]Pritchard S G.Soil organisms and global climate change.Plant Pathology,2011,60:82-99.
[4]Moore J C,McCann K,Setälä H,DeRuiter P C.Top-down is bottom-up:Does predation in the rhizosphere regulate aboveground dynamics?Ecology,2003,84:846-857.
[5]Eisenhauer N,Cesarz S,Koller R,Worm K,Reich P B.Global change belowground:impacts of elevated CO2,nitrogen,and summer drought on soil food webs and biodiversity.Global Change Biology,2012,18:435-447.
[6]Zhang L,Zhu Z.Effect of transgenic insect-resistant rice on biodiversity.Hereditas,2011,33(5):414-421.
[7]Davidson E A,Janssens I A.Temperature sensitivity of soil carbon decomposition and feedbacks to climate change.Nature,2006,440:165-173.
[8]Inubushi K,Cheng W,Mizuno T,Lou Y,Hasegawa T,Sakai H,Kobayashi K.Microbial biomass carbon and methane oxidation influenced by rice cultivars and elevated CO2in a Japanese paddy soil.European Journal of Soil Science,2011,62:69-73.
[9]Brussaard L,de Ruiter P C,Brown G G.Soil biodiversity for agricultural sustainability. Agriculture, Ecosystems&Environment,2007,121:233-244.
[10]Bardgett R D,Wardle D A.Aboveground-belowground linkages:biotic interactions, ecosystem processes, and global change.Oxford University Press,New York,USA,2010.
[11]Li X Q,Chen F J,Liu M Q,Chen X Y,Hu F.Effects of two years planting transgenic Bt rice(BtSY63)on soil nematode community.Chinese Journal of Applied Ecology,2012,23(11):3065-3071.
[12]Liang W J,Li Q,Chen L J,Huang G H,Zhu J G.Effects of elevated atmospheric CO2on nematode trophic groups in a Chinese paddy-fild ecosystem.Chinese Journal of Applied Ecology,2002,13(10):1269-1272.
[13]Li X Q,Chen F J,Liu M Q,Hu F.Effects of transgenic Bt rice on soil dissolved organic carbon and nitrogen contents and microbiological properties.Chinese Journal of Applied Ecology,2012,23(1):96-102.
[14]Yuan Y Y,Ge F.Effects of transgenic Bt crops on non-target soil animals.Chinese Journal of Applied Ecology,2010,21(5):1339-1345.
[15]Yeates G W,Bongers T,de Goede R G M,Freckman D W,Georgieva S.Feeding habits in soil nematode families and generaan outline for soil ecologists.Journal of Nematology,1993,25:315-331.
[16]Lu R K.SoilandAgro-chemicalAnalyticalMethods(In Chinese).Beijing:China Agricultural Science and Technology Press.2000.
[17]Chen F J,Ge F,Su J W.An improved top-open chamber for research on effects of elevated CO2on agricultural pests in field.Chinese Journal of Ecology,2005,24(5):585-590.
[18]Joergensen R G.Microbial biomass//Alef K,Nannipierri P.Methods in Applied Soil Microbiology and Biochemistry.New York:Academic Press,1995:375-417.
[19]Ferris H,Bongers T,De Goede R G M.A framework for soil food web diagnostics:extension of the nematode faunal analysis concept.Applied Soil Ecology,2001,18:13-29.
[20]Tom B,Marina B.Functional diversity of nematodes.Applied Soil Ecology,1998,239-251.
[21]Saxena D,Neal C S,Illimar A,Shu Q Y,Stotzky G.Larvicidal Cry proteins from Bt are released in root exudates of transgenic Bt corn,potato,and rice but not of Bt canola,cotton and tobacco.Plant Physiology and Biochemistry,2004,42:383-387.
[22]Kalbitz K,Solinger S,Park J H,Michalzik B,Matzner E.Controls on the dynamics of dissolved organic matter in soils:a review.Soil Science,2000,165:277-304.
[23]Guo J,Zhang M Q,Zhang L,Deng A X,Bian X M,Zhu J G,Zhang W J.Responses of dissolved organic carbon and dissolved nitrogen in surface water and soil to CO2enrichment in paddy field.Agriculture, Ecosystems and Environment, 2011, 14:273-279.
[24]Jia Q T,Shi S P,Yang C J,Peng Y F.Changes of several important materials in transgenic Bt rice.Scientia Agricultura Sinica,2005,38(10):2002-2006.
[25]Wang Z H.Potential effects of Bt transgenic crops on soil microecosystem.Chinese Journal of Applied Ecology,2005,16(12):2469-2472.
[26]Stephane C,Angela S.Climate change effects on beneficial plantmicroorganism interactions.FEMS Microbiology Ecology,2010,73:197-214.
[27]Yeates G W,Newton P C D,Ross D J.Response of soil nematode fauna to naturally elevated CO2levels influenced by soil pattern.Nematol,1999,1:285-293.
[28]Li Q,Wang P.Current situation and prospect of elevated atmospheric CO2effects on soil nematodes.Chinese Journal of Applied Ecology,2002,13(10):1349-1351.
[29]Drigo B,Kowalchuk G A,Yergeau E,Bezemer T M,Boschker H T S,Vanveen J A.Impact of elevated carbon dioxide on the rhizosphere communities of Carex arenaria and Festuca rubra.Global Change Biology,2007,13:2396-410.
[30]Blagodatskaya E,Blagodatsky S,Dorodnikov M,Kuzyakov Y.Elevated atmospheric CO2increases microbial growth rates in soil:results of three CO2enrichment experiments.Global Change Biology,2010,16:836-848.
[31]Yeates G W,Newton P C D,Ross D J.Significant changes in soil microfauna in grazed pasture under elevated carbon dioxide.Biology and Fertility of Soils,2003,38:319-26.
[32]Rillig M C,Field C B.Arbuscular mycorrhizae respond to plants exposed to elevated atmospheric CO2as a function of soil depth.Plant Soil,2003,254:383-391.
[33]Treseder K K,Egerton-Warburton L M,Allen M F,Cheng Y F,Oechel W C.Alteration of soil carbon pools and communities of mycorrhizal fungi in chaparral exposed to elevated carbon dioxide.Ecosystems,2003,6:786-796.
[34]Griffiths B S,Heckmann L H,Caul S,Thompson J,Scrimgeour C,Krogh P H.Varietal effects of eight paired lines of transgenic Bt maize and near-isogenic non-Bt maize on soil microbial and nematode communitystructure.PlantBiotechnologyJournal,2007,5:60-68.
[35]Blankinship J C,Niklaus P A,Hungate B A.A meta analysis of responses of soil biota to global change.Oecologia,2011,165:553-565.
参考文献:
[6]张磊,朱祯.转基因抗虫水稻对生物多样性的影响.遗传,2011,33(5):414-421.
[11]李修强,陈法军,刘满强,陈小云,胡锋.转基因水稻Bt汕优63种植两年对土壤线虫群落的影响.应用生态学报,2012,23(11):3065-3071.
[12]梁文举,李琪,陈立杰,黄国宏,朱建国.开放式空气CO2浓度升高对中国稻田生态系统线虫营养类群产生的影响.应用生态学报,2002,13(10):1269-1272.
[13]李修强,陈法军,刘满强,胡锋.转Bt水稻对土壤可溶性有机碳氮及微生物学性质的影响.应用生态学报,2012,23(1):96-102.
[14]袁一杨,戈峰.转Bt基因作物对非靶标土壤动物的影响.应用生态学报,2010,21(5):1339-1345.
[15]杨保军,唐健,江云珠,彭于发.转cry1Ab基因克螟稻对根际可培养细菌类群的影响.生态学报,2009,29(6):3036-3043.
[16]鲁如坤.土壤农业化学常规分析方法.北京:中国农业科技出版社,2000.
[17]陈法军,戈峰,苏建伟.用于研究大气二氧化碳浓度升高对农田有害生物影响的田间试验装置—改良的开顶式气室.应用生态学报,2005,24(5):585-590.
[24]贾乾涛,石尚柏,杨长举,彭于发.转Bt基因水稻生长期几种重要成分含量的变化研究.中国农业科学,2005,38(10):2002-2006.
[25]王忠华.转Bt基因水稻对土壤微生态系统的潜在影响.应用生态学报,2005,16(12):2469-2472.
[28]李琪,王朋.开放式空气[CO2]增高对土壤线虫影响的研究现状与展望.应用生态学报,2002,13(10):1349-1351.
