前列地尔纳米乳冻干工艺研究
2014-05-14冉海东孙宁云张军东廉云飞房秋雨
冉海东,孙宁云,张军东,李 娟*,廉云飞,房秋雨
(1.中国药科大学,江苏 南京 210009;2.上海信谊药厂有限公司,上海 201206)
前列地尔(alprostadil)是天然前列腺素类物质[1]。前列地尔具有广泛的生物活性,在心脑血管疾病治疗中有着广泛应用[2-3]。前列地尔稳定性差,易水解。前列地尔纳米乳是将前列地尔溶于注射用油后再分散于水相中而形成的纳米乳注射液。前列地尔纳米乳在生物体内不稳定[4-5],常温放置会发生分层、絮凝及降解等。将纳米乳制成干乳剂能显著提高其常温放置稳定性,如丙泊酚干乳剂、紫杉醇干乳剂。本文采用冷冻干燥法[6]将前列地尔纳米乳制成干乳剂,并考察了冻干保护剂种类和冷冻干燥工艺,旨在确定最佳冻干工艺,提高前列地尔纳米乳稳定性。
1 仪器与材料
ZS90激光粒度仪(英国马尔文仪器有限公司);东富龙LYO-13冷冻干燥机(上海东富龙科技股份有限公司);IKAT25高速分散机(德国IKA公司);S-3400N扫描电子显微镜、H600透射电镜(株式会社日立制作所);DSC204F1型差示扫描量热仪(德国Netzsch公司)Ailgent 1100(美国安捷伦科技公司);FB-110Q均质机(上海励途机械设备有限公司);卡尔费休水分测定仪ZKF-1(上海超精科技有限公司)。
前列地尔原药(吉林英联生物制药股份有限公司,20120801);卵磷脂(德国Lipoid公司,EL12021);大豆油(铁岭北亚药用有限公司,121102003);油酸(上海东尚科技有限公司,520200);甘油(汕头紫光氨基酸有限公司,120516)海藻糖、麦芽糖(阿拉丁试剂公司,J1216051)甘露醇(药用级,法国罗盖特公司,E988G);乳糖、葡萄糖、蔗糖、山梨醇(药用级,国药集团化学试剂有限公司);其它试剂均为分析纯。
2 方法与结果
2.1 前列地尔纳米乳及冻干乳剂制备
按前列地尔纳米乳制备方法制备纳米乳液,灭菌罐装后得前列地尔纳米乳剂。将制得纳米乳液加入冻干保护剂后分装于10mL西林瓶中,每瓶装量2mL;最终优化的冻干工艺为:将样品放入-20℃冰箱预冻12h,然后放入冻干机,经-45℃快速预冻2h,抽真空0.34mbar;升温至-35℃保持36h,继续升温至-10℃保持4h,升温至15℃保持6h,无菌封装后即得冻干样品。
2.2 纳米乳粒径测定
将纳米乳液稀释5000倍,在25℃下,置于激光粒度仪的样品池中,测定乳液的粒径、多分散系数(冻干剂则加等量水复溶后再稀释相同倍数进行粒径测定)。如图1,所制得的纳米乳液平均粒径和PDI分别为(164.7±21.9)nm、0.066。
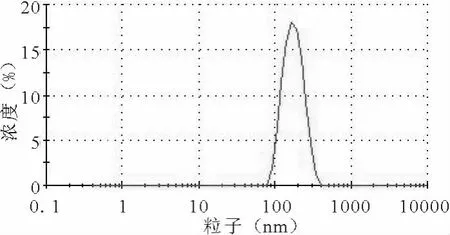
图1 前列地尔纳米乳平均粒径
2.3 纳米乳中前列地尔含量及杂质测定
2.3.1 色谱条件 色谱柱为 Waters Symmetry C18色谱柱,以0.0067mol/L磷酸盐缓冲液(pH为6.3)-乙腈(3∶1)为流动相;流速为1mL/min;柱后反应液为1mol/L氢氧化钾溶液,柱后反应管为聚四氟乙烯管(φ0.5mm×10m);柱温60℃;检测波长278nm。进样量:20μL。
2.3.2 含量测定 精密量取前列地尔纳米乳5mL,破乳后加1/1000磷酸定容,过预处理柱后用甲醇洗脱于蒸馏瓶中,减压蒸干溶解进样,以内标法计算得样品含量为:99.5%;杂质A1为0.1μg/mL。冻干剂则加等量水复溶后再进行测定。
2.4 冻干保护剂初筛
冻干过程是个复杂的相变过程,耗时长,耗电量大。冻融试验[7]是将样品放至低温冰箱进行预冻,而后置室温溶解。冻融试验耗时短,耗电量小,易筛选。因此本实验采用冻融试验进行保护剂初筛。
2.4.1 保护剂种类初筛 精密量取前列地尔纳米乳8份,每份2mL。于乳剂中分别加入甘露醇、乳糖使糖浓度为5%(W/V);加入山梨醇、麦芽糖、海藻糖、葡萄糖、蔗糖使其浓度为10%(W/V);另一份作为空白。轻轻振荡乳液,待其完全溶解并混合均匀后放入-20℃冰箱中预冻12h。待其完全冻实,观察外观;复溶后测定其平均粒径及PDI,比较与冻干前纳米乳液粒径区别。如表1所示,保护剂对冻干产品有明显保护效果;在相同试验条件下处方4、5、6、7平均粒径较冻干前无显著变化。因此初步筛选蔗糖、麦芽糖、葡萄糖、海藻糖作为冻干保护剂。
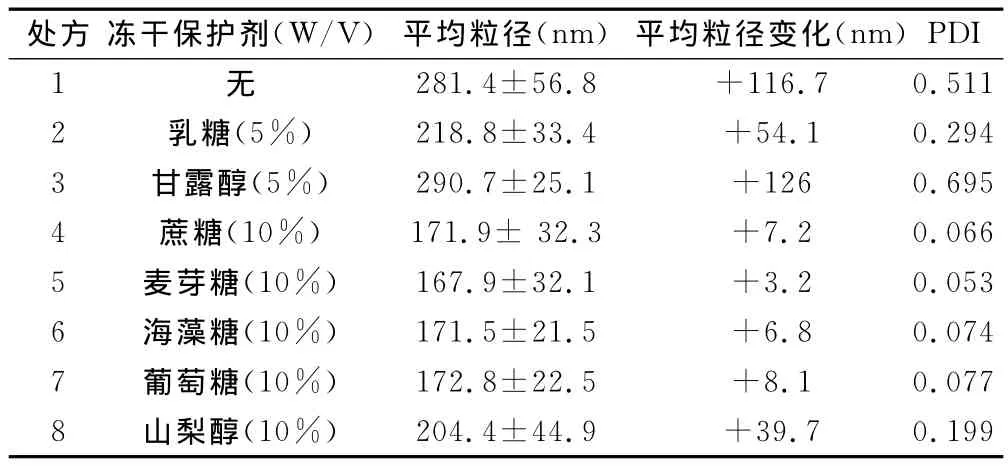
表1 加入不同冻干保护剂冻融后平均粒径及PDI
2.4.2 保护剂浓度初筛 精密量取前列地尔纳米乳20份,每份2mL。于乳剂中分别加入蔗糖、麦芽糖、葡萄糖、海藻糖,添加每种糖使其浓度分别为1%、5%、10%、15%、20%(W/V);处理方法同“2.4.1”。结果显示,1%和20%的糖预冻后粒径变化明显,因此初步选择5%、10%、15%(W/V)四种糖浓度进一步筛选。
2.5 冻干保护剂优化
精密量取纳米乳剂12份,每份2mL;于乳剂中分别加入葡萄糖、蔗糖、麦芽糖、海藻糖使其浓度分别为5%、10%、15%,轻轻振荡乳液,待其完全溶解并混合均匀后放入-20℃冰箱中预冻12h;而后进行冷冻干燥61h,以冻干乳剂的外观、复溶后外观、平均粒径、复溶速度为指标来筛选冻干保护剂种类及浓度(表2)。
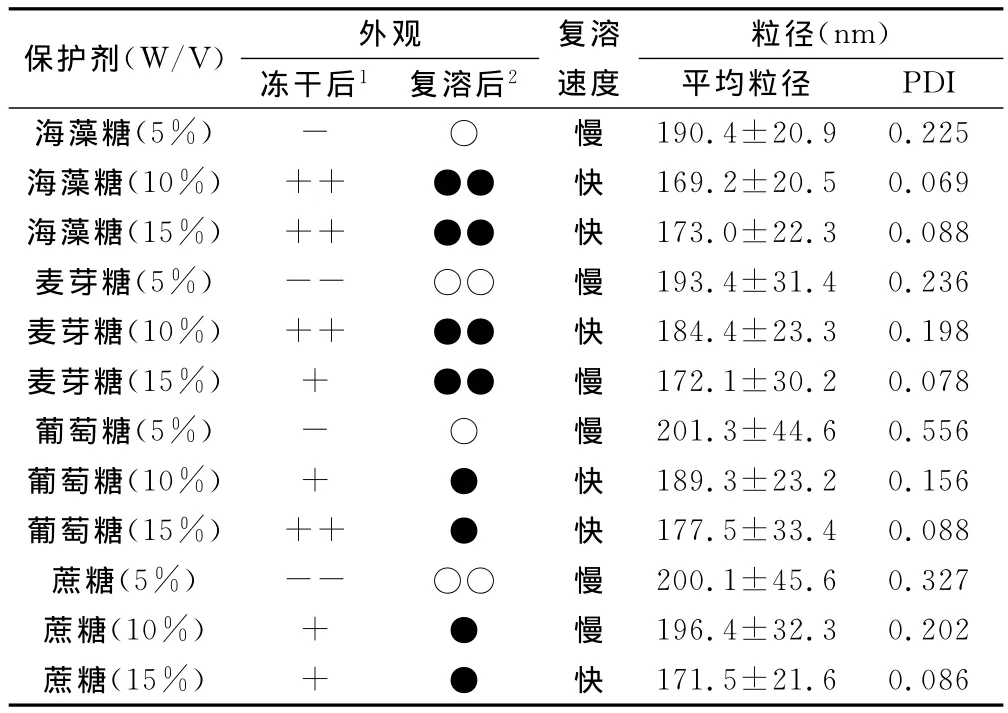
表2 不同种类及浓度冻干保护剂对前列地尔冻干纳米乳性质的影响
表2显示,10%海藻糖加入后,冻干复溶速度较快,冻干后外观平滑紧致,复溶后呈半透明状且粒径及PDI无显著性变化。这可能与海藻糖的特殊空间结构有关:它的椅式和船式构象间转变影响了干燥状态下的磷脂膜结构,进而维持无水状态时膜的稳定。同时通过调节其浓度能够抑制冰晶的生长,降低其对乳滴的挤压和机械损伤作用,保护乳滴的结构,从而达到非常好的冻干保护效果。因此筛选出最佳保护剂为10%海藻糖。
2.6 冻干工艺考察
冷冻干燥过程可分为预冻阶段、第一阶段干燥和第二阶段干燥。其过程中影响冻干效果和产品质量的因素较多,下面分别对预冻温度、速度、预冻时间以及干燥时间等因素分别进行考察。
2.6.1 预冻温度 预冻温度是冷冻干燥过程中的一个重要参数,对产品的质量影响较大。精密量取前列地尔纳米乳4份,每份1mL。于乳剂中分别加入10%(W/V)海藻糖1mL,轻微振荡至其完全溶解后,分别放入低温冰箱(-20℃,12h)、(-45℃ ,12h)、(-70℃,12h)中预冻,随后进行冷冻干燥除去水分。冻干结束后,将制得的冻干乳加入注射溶媒进行复溶,经水合振荡后还原成乳剂,观察外观,测定粒径变化。结果显示:三种预冻温度均能使冻干品表面呈光滑的玻璃状,复溶外观良好。粒径分别为(173.5±34.6)nm、(175.3±35.1)nm、(171.5±33.9)nm。三种预冻温度均能达到良好保护效果,为节约能源选取-20℃12h为最佳预冻温度。
2.6.2 冻干机初始温度 预冻就是将溶液中的自由水固化,赋予待干燥的产品于干燥前相同的形态,防止抽真空干燥时起泡、浓缩和溶质移动等不可逆变化的发生。因此冷冻干燥过程预冻温度必须低于样品最低共熔点10~20℃(图2)。本实验选择-45℃为冻干机预冻温度。
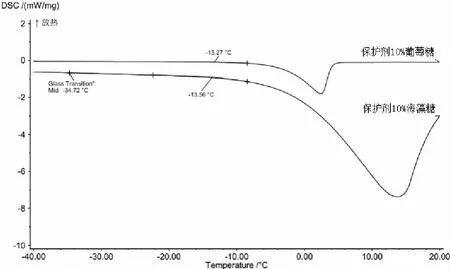
图2 冻干纳米乳最低共熔点和玻璃化转变温度
2.6.3 预冻时间 将加入海藻糖作为保护剂的样品平行制得3份,分别于-45℃冷阱中预冻1、2、4h时,而后进行冷冻干燥除去水分。通过产品质量,确定最佳预冻时间。试验结果显示,预冻1h样品平均粒径较大为(203.3±34.2)nm;预冻2h、4h平均粒径无显著差异,本实验确定预冻时间为2h。
2.6.4 干燥温度、时间 ①第一阶段干燥:按冻干保护剂加入比例精密量取样品9份,共18mL。于-20℃预冻12h,-45℃冷阱中预冻2h后进行干燥除去水分,将样品分别设置第一阶段干燥温度为-40℃、-35℃、-30℃。干燥时间分别为24、36、48h。通过产品质量确定第一阶段干燥温度和时间,平行做三组。由图3-B看出,干燥温度为30℃时产品平均粒径变化较大;干燥温度为40℃、35℃时粒径变化则不明显。干燥时间为24h时,产品平均粒径波动明显。干燥时间为36h、48h干燥温度为35℃、40℃产品质量较优。从能源节约方面考虑第一阶段干燥时间保持36h,温度保持-35℃;② 第二阶段干燥:按上述已确定条件处理样品,将样品第一阶段温度设置为-35℃干燥36h,而后第二阶段干燥温度设置为10℃、15℃、20℃,干燥时间分别为4h、6h、8h。通过产品含水量确定第二阶段干燥温度及时间。由图3-A看出,干燥时间为10℃时,含水量在4%以上,不利于冻干样品的保护;而干燥温度15℃、20℃时含水量差别不明显,且此时干燥时间基本无影响。含水量在1.5%以内时表示很难除去,但对样品稳定性影响不大;而温度越高对设备质量要求越高,干燥时间越长,能源消耗越大。综合考虑,第二阶段干燥时间为6h、温度为15℃。

图3 干燥时间及温度与平均粒径(A)、含水量(B)的关系
2.7 冻干乳的表征
2.7.1 扫描电镜 分别取海藻糖、麦芽糖做保护剂的冻干样品少量,快速放入两面的SEM样品盘后放入JFC-1600,调加速电压15kV进行喷金后放入S-3400N扫描电镜进行观察(图4-a,b)。加入海藻糖做保护剂,纳米乳能够完整的嵌入海藻糖基质中,形成多层次结构,有效保护纳米乳冻干过程免受破坏;而麦芽糖则不能形成有效保护结构。
2.7.2 透射电镜 取样品放入分析池,用纯化水分散稀释后,滴入铜网分析片,用2%的磷钨酸着色。在空气中干燥后,置于透射电镜观察(如图4-c,d)。可以看到纳米乳冻干前后乳粒呈球形,且分布均匀,无明显变化。

图4 前列地尔扫描电镜和透射电镜
2.8 冻干纳米乳稳定性
将纳米乳与冻干乳样品同时置于室温放置3个月测定其粒径及含量变化(如表4)。前列地尔纳米乳经冻干后放置3个月平均粒径、含量无显著变化,而未经冻干的纳米乳常温放置3个月后含量下降约7.3%,杂质A1增至3.4μg/mL,已超出其限度3.0μg/mL。前列地尔冻干纳米乳稳定性明显优于前列地尔纳米乳。

表4 前列地尔纳米乳及冻干乳常温放置3个月综合指标变化
3 讨论
纳米乳属于热力学不稳定体系,前列地尔纳米乳不能够常温保存,灭菌过程易加速降解,增加其杂质含量。将其制成冻干纳米乳后,室温长期放置能够保证其粒径及主药含量保持不变,同时减少灭菌过程对主药含量的影响,杂质A1能够有效控制在限量3μg/mL以内。因此将前列地尔制成冻干纳米乳剂有着广阔的应用前景。
冻干保护剂的选择或用量控制不好[8],冻干后的产品容易形成不易溶解的蜂窝状或粉状,最终导致纳米乳不能恢复原有性状。实验中15%的蔗糖出现喷瓶现象可能是由于产品浓度大,不均一,加热过程中造成制品上下温差过大,下部制品的结晶不是从固体到气体升华,而是从固体、液体到气体蒸发,形成喷瓶[9]。5%的糖类由于浓度过低没有能够有效降低制品的玻璃化转变温度,而达不到骨架支撑作用。10%海藻糖能起到很好的保护作用,但作为冻干保护剂,暴露在空气中时海藻糖较易吸潮。更优选择有待于进一步深入研究。
干燥过程分为升华干燥和解析干燥[10]。升华干燥过程不允许冰出现融化,水蒸气必须低于物料冻结点的饱和蒸汽压。本实验第一阶段干燥不能加热过快,否则制品的上下部位易出现不均匀。冻干产品易吸潮,尤其在含有少量水分时,因此本实验在第二阶段干燥时严格控制干燥温度,目的就是最大限度降低水分含量,当含水量在1.5%以下时,则对产品质量基本无影响。
[1]MICHEL G,CHANTAL T,JEAN FP,et al.Basal concentrations of free and esterified monohydroxylated fatty acids in human blood platelets[J].Clin Chem,1997,43(12):2403-2407.
[2]ABTULLAH MILCAN,EMRAH ARSLAN,OZLEN TUBAY BAGDATOGLU,et al.The effct of alprostadil on ischemiareperfusion injury of peripheral nerve in rats[J].Pharmacol Res,2003,49(2004):67-72.
[3]NICHLOAS M,PANTELIDES,SACHIN A ,et al.Erectile dysfunction following radical prostatectomy:a review[J].Br J Med Sur Urol,2011,4(6):227-242.
[4]姜赛平,田治科,卢晓阳.纳米结构脂质载体的制备及性质研究进展[J].中国医药工业杂志,2008,39(10):773-776.
[5]TAPAN KG,CHHATRAPAL C,AJAZUDDIN,et al.Prospects of pharmaceuticals and biopharmaceuticals loaded microparticles prepared by double emulsion technique for controlled delivery[J].Saudi Pharm J,2013,21(2):125-141.
[6]MATTHEW JB,ZHANG T,TANJA W,et al.Identification of ancient remains through genomic sequencing[J].Genome Res,2008,18(8):1347-1353.
[7]LI F,WANG T,HE HB,et al.The properties of bufadienolides-loaded nano-emulsion and submicro-emulsion during lyophilization[J].Int J Pharm,2008,349(1-2):291-299.
[8]邓礼荷,韦敏燕,汤晨懿,等.冻干工艺及保护剂对羟基喜树碱脂质体质量的影响[J].中国医药工业杂志,2012,43(1):30-34.
[9]郭树国.人参真空冷冻干燥工艺参数试验研究[D].沈阳:沈阳农业大学,2012.
[10]NARMELA A,MANSOUREH M.Effects of drying,packaging,and temperature on the quality of fried onion slices[J].J Food Sci,2010,75(5):251-254.
