连花清瘟胶囊抑制急性放射性肺损伤大鼠MCP-1的表达与效应*
2014-05-13雷章卢宏达董克臣卢驰陈卫群袁静萍孔庆志
雷章,卢宏达,董克臣,卢驰,陈卫群,袁静萍,3,孔庆志
(1.武汉市中心医院肿瘤科,武汉 430014;2.武汉市肿瘤研究所,武汉 430014;3.武汉市中心医院病理科,武汉 430014)
连花清瘟胶囊抑制急性放射性肺损伤大鼠MCP-1的表达与效应*
雷章1,2,卢宏达1,2,董克臣1,2,卢驰1,2,陈卫群2,袁静萍2,3,孔庆志1,2
(1.武汉市中心医院肿瘤科,武汉 430014;2.武汉市肿瘤研究所,武汉 430014;3.武汉市中心医院病理科,武汉 430014)
目的 研究连花清瘟胶囊对大鼠急性放射性肺损伤的抑制作用及可能机制。方法将大鼠随机分为对照组、照射组和照射加连花清瘟组,对照组和照射组给予0.9%氯化钠溶液,照射加连花清瘟组给予连花清瘟0.9%氯化钠溶液。苏木精-伊红(HE)染色观察连花清瘟胶囊对大鼠急性放射性肺损伤肺组织的影响;定量逆转录聚合酶链反应(RTPCR)与酶联免疫吸附(ELISA)法分别检测肺组织与血清白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白1(MCP-1)含量;免疫组化法检测肺组织中巨噬细胞的数量。结果对照组、照射组及照射加连花清瘟组肺组织IL-6 mRNA相对表达水平分别为(0.002 1±0.000 20),(0.006 6±0.000 32),(0.003 9±0.000 22),TNF-α mRNA相对表达水平分别为(0.003 7±0.000 16),(0.007 4±0.000 33),(0.005 5±0.000 24),MCP-1 mRNA相对表达水平分别为(0.001 4± 0.000 15),(0.005 4±0.000 72),(0.003 2±0.000 17);3组血清IL-6浓度分别为(35.2±10.9),(111.8±26.1),(68.2±15.2) pg·mL-1,TNF-α浓度分别为(229.3±28.5),(837.5±57.6),(566.9±39.8)pg·mL-1,MCP-1浓度分别为(96.85±8.20), (314.53±12.76),(191.32±10.97),每个高倍镜视野下巨噬细胞数目分别为(59.5±4.3),(503.9±25.8),(106.2±12.6)。连花清瘟胶囊能够减轻急性放射性肺损伤大鼠肺组织炎症反应,抑制巨噬细胞在肺组织中的聚集,减少炎症因子IL-6、TNF-α表达,降低MCP-1在大鼠肺组织与血清的含量,差异有统计学意义(P<0.05)。结论连花清瘟胶囊通过抑制MCP-1表达,从而抑制巨噬细胞向急性放射性肺损伤大鼠肺组织中的聚集,进而减轻炎症反应。
连花清瘟胶囊;损伤,肺,急性/放射性;大鼠;单核细胞趋化蛋白1
放射治疗是胸部肿瘤的主要治疗手段之一,在肺癌[1]、乳腺癌[2]、食管癌[3]等高发肿瘤的治疗中发挥着重要作用,并且其疗效在一定范围内与放疗剂量呈正相关[4]。肺是胸部放疗的主要危及器官,由于其对射线较敏感,放射性肺损伤在一定程度上限制了高剂量放疗在胸部肿瘤中的应用[5]。目前临床主要采用大剂量糖皮质激素、辐射防护药阿米福汀及抗氧化药等防治放射性肺损伤,但疗效仍有待进一步提高[6]。巨噬细胞是炎症反应的主要效应细胞,单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)是其主要的趋化因子[7]。笔者在本实验中将连花清瘟胶囊用于治疗大鼠急性放射性肺损伤,发现连花清瘟胶囊通过抑制MCP-1的表达减少巨噬细胞在损伤肺组织中的聚集而抑制炎症反应,取得了较好的治疗效果,为其临床应用奠定了实验基础。
1 材料与方法
1.1 动物 健康成年SPF雌性Wistar大鼠48只,体质量190~200 g,购自湖北省实验动物研究中心,合格证号:42000600000065,许可证号:SCXK(鄂)2008-0005,实验前在温度18~22℃、湿度50%~70%、正常供食供水的清洁动物房常规饲养7 d,观察无异常者入组实验。
1.2 试药 连花清瘟胶囊干膏粉(以岭药业股份有限公司,规格:200 g,批号:130232,批准文号:国药准字Z20040063。处方:连翘、金银花、炙麻黄、炒苦杏仁、石膏、板蓝根、绵马贯众、鱼腥草、广藿香、大黄、红景天、薄荷脑、甘草,1 g干膏粉相当于药材5.71 g), Trizol(invitrogen,批号:15596-026),ReverTra Ace q PCR RT-Kit逆转录试剂盒(TOYOBO,批号:FSQ-101),THUNDERBIRD SYBR qPCR Mix实时定量PCR试剂盒(TOYOBO,批号:QPS-201),小鼠抗大鼠CD68单克隆抗体(Santa Cruz,批号:sc-59103),辣根过氧化物酶标记的羊抗小鼠二抗(Earthox,批号:E030110),大鼠IL-6、TNF-α、MCP-1 ELISA试剂盒(PeproTech,批号分别为900-M86,900-K73,900-M59)。
1.3 PCR引物 大鼠β-actin、白细胞介素6 (interteukin-6,IL-6)、肿瘤坏死因子α(tumar necrosis foctor-α,TNF-α)及MCP-1引物经PubMed核酸数据库BLAST检索为基因特异性引物,由上海生工生物工程股份有限公司合成并纯化。其各自序列为:β-actin引物,上游:5'-CTTCCTGGG-CATGGAGTCCT-3',下游:5'-GGAGCAATGATCTT-GATCTT-3',产物大小202 bp;IL-6引物,上游:5'-AGCTCATTCTGTCTCGAGCCCACCA-3',下游:5'-AACTGGCTGGAAGTCTCTTGCGGAG-3',产物大小382 bp;TNF-α引物,上游:5'-CACCAAGGGACCAGCCAGGAGGGAG-3',下游:5'-CTCCCTCCTGGCTGGTCCCTTGGTG-3',产物大小145 bp;MCP-1引物,上游:5'-AGGAATGGGTCCAG-AAGTAC-3',下游:5'-AAGTGCTTGAGGTGGTTGTG-3',产物大小177 bp。
1.4 仪器 PRECISE直线加速器(瑞典Elekta公司),S IX51光学显微镜(日本OLYMPUS公司),BIORAD CFX96 PCR仪(美国BIO-RAD公司),VICTOR X2全波长多功能酶标仪(美国PerkinElmer公司)。
1.5 实验分组 将实验大鼠按随机数字表法分为3组,对照组、照射组和照射加连花清瘟组,每组16只。照射前3 d至照射后28 d对大鼠灌胃,对照组与照射组给予0.9%氯化钠溶液2 mL,照射加连花清瘟组给予连花清瘟/0.9%氯化钠溶液2 mL,给药量0.42 g·kg-1,每日1次。
1.6 模型的制备 将大鼠用水合氯醛(350 mg·kg-1)麻醉后仰卧位固定在木板上,模拟定位机(Varian Ximatron)透视下确定照射野范围为右侧全肺,照射野大小约2.8 cm×4.2 cm,在体表勾画出射野范围,之后在直线加速器(ELEKEA PRECISE)上摆位,射野外部用多叶光栏遮挡,6 MVX线固定源照射皮距100 cm,剂量率400 cGy·min-1,总剂量单次20 Gy[8]。
1.7 苏木精-伊红染色切片 将大鼠右侧肺组织于10%中性甲醛固定液中固定24 h,水洗20 min后梯度酒精脱水,二甲苯透明后石蜡包埋,切片5 μm,烤片后二甲苯脱蜡,脱苯水化后苏木精染色5 min,分化后伊红染色15 s,风干后树胶封片。
1.8 定量逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR) 将大鼠肺组织约20 mg在1 mL Trizol中匀浆,提取总RNA在紫外分光光度仪上测定纯度(A260/A280=1.8~2.0)并定量,取mRNA0.5 μg行逆转录反应,条件为37℃15 min, 98℃5 min;取逆转录产物1 μL行定量PCR反应,每个模板重复4次,条件为95℃预变性1 min,之后95℃10 s、60℃45 s共40个循环。将各模板所得的循环数阈值(Ct)减去相应内参β-actin的Ct值得到ΔCt值,采用2-ΔCt法计算各基因相对内参的表达量。
1.9 免疫组织化学法 将石蜡包埋的大鼠肺组织切片,烤片过夜后脱蜡,柠檬酸修复液中高压1 min,过氧化氢作用10 min后正常山羊血清封闭20 min,洗片后加1∶100稀释的一抗4℃孵育过夜,洗片后加1∶200稀释的二抗室温孵育30 min,洗片后二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色2.5 min,苏木精复染2 min,自来水冲洗后脱水、透明、封片。
1.10 酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)实验 将MCP-1、IL-6和TNF-α捕获抗体100 μL加入ELISA板中室温孵育过夜,洗板后封闭1 h,洗板后加入大鼠外周血血清100 μL,每个样品做复孔3个,同时分别加入试剂盒提供的标准品以绘制标准曲线,室温孵育3 h后洗板,加入相应酶标二抗室温孵育30 min后洗板,加入显色液后酶标仪在波长405 nm(Perkin elmer)读取吸光度,仪器自动计算出MCP-1、IL-6和TNF-α的浓度。
2 结果
2.1 大鼠急性放射性肺损伤的炎症反应 取实验4周后大鼠右侧肺组织切片,行苏木精-伊红染色。光镜下观察发现对照组肺泡组织结构清晰,未见炎症细胞浸润;照射组肺组织肺泡间隔水肿明显,伴大量炎症细胞浸润,大鼠表现出呼吸急促等症状;照射+连花清瘟组也可见肺组织水肿与炎症细胞浸润,伴有呼吸急促症状,但程度较照射组明显减轻,见图1。提示连花清瘟胶囊具有减轻大鼠急性放射性肺损伤炎症反应的作用。

A.对照组;B.照射组;C.照射+连花清瘟组图1 3组大鼠肺部炎症反应情况(×100)A.control group;B.radiation group;C.radiation plus lianhuaqingwen groupFig.1 Lung inflammatory response in three groups of rats(×100)
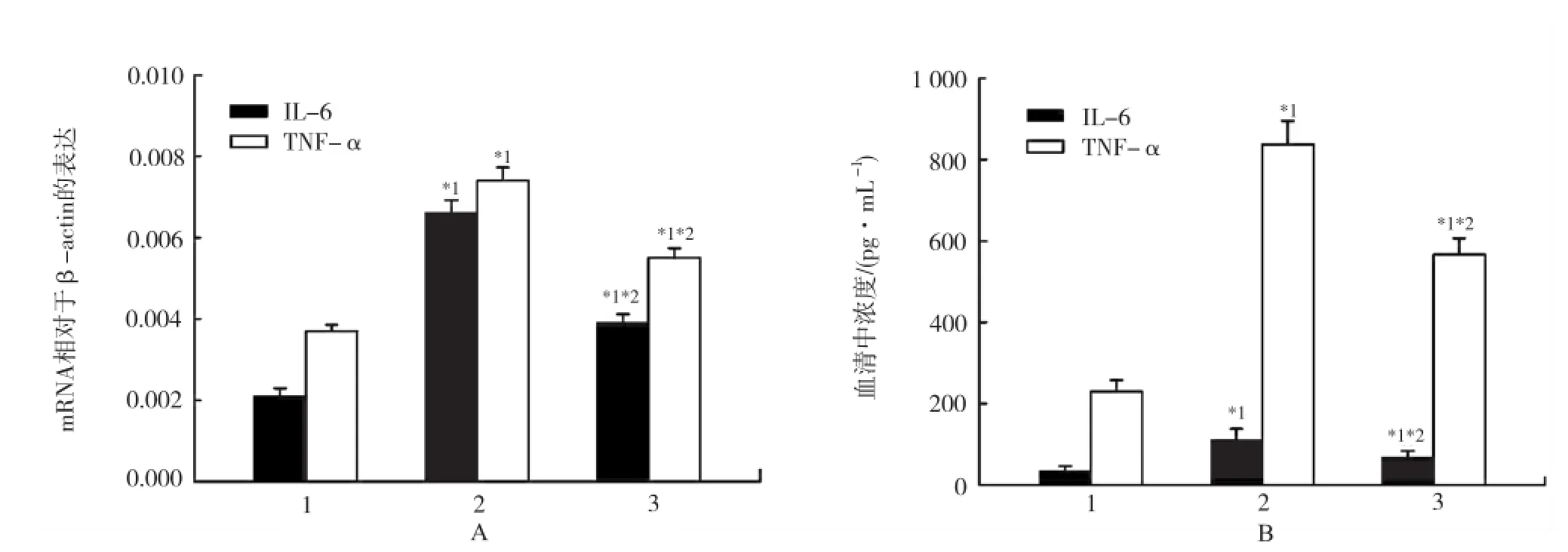
1.对照组;2.照射组;3.照射+连花清瘟组。与对照组比较,*1P<0.05;与照射组比较,*2P<0.05图2 3组大鼠肺组织(A)与血清(B)中IL-6和TNF-α表达情况1.Control group;2.Radiation group;3.Radiation plus lianhuaqingwen group;compared with control group,*1P<0.05;compared with radiation group,*2P<0.05Fig.2 Expression of IL-6 and TNF-α in lung(A)and serum(B)in three groups of rats
2.2 急性放射性肺损伤大鼠肺组织与血清IL-6和TNF-α表达 定量RT-PCR检测实验4周后大鼠肺组织IL-6和TNF-α mRNA表达,结果对照组、照射组、照射+连花清瘟组IL-6 mRNA相对于内参β-actin水平分别为(0.002 1±0.000 20),(0.006 6±0.000 32), (0.003 9±0.000 22);TNF-α mRNA水平分别为(0.003 7±0.000 16),(0.007 4±0.000 33), (0.005 5±0.000 24)(图2A)。血清IL-6与TNF-α浓度在对照组、照射组、照射+连花清瘟组中分别(35.2± 10.9),(111.8±26.1),(68.2±15.2)pg·mL-1与(229.3±28.5),(837.5±57.6),(566.9±39.8) pg·mL-1(图2B)。照射组、照射+连花清瘟组与对照组比较,以及照射+连花清瘟组与照射组比较,差异有统计学意义(P<0.05)。结果表明连花清瘟胶囊能够降低大鼠急性放射性肺损伤肺组织与血清炎症因子IL-6和TNF-α表达。
2.3 急性放射性肺损伤大鼠肺组织巨噬细胞聚集情况 免疫组织化学法检测实验4周后CD68阳性巨噬细胞在大鼠肺组织中的聚集(图3),棕色细胞为巨噬细胞,Image-Pro PLUS 6.0.0.260软件对切片进行分析。结果表明对照组、照射组、照射+连花清瘟组每个高倍镜视野(×200)下巨噬细胞数目分别为(59.5± 4.3),(503.9±25.8),(106.2±12.6)。与照射组比较,连花清瘟胶囊可降低巨噬细胞在急性放射性肺损伤大鼠肺组织中的聚集,差异有统计学意义(P<0.05)。
2.4 急性放射性肺损伤大鼠肺组织与血清MCP-1表达情况 定量RT-PCR与酶联免疫吸附实验分别检测实验4周后大鼠肺组织与血清MCP-1表达。对照组、照射组、照射+连花清瘟组肺组织MCP-1 mRNA相对于内参β-actin的水平分别为(0.001 4±0.000 15), (0.005 4±0.000 72),(0.003 2±0.000 17);相应血清MCP-1浓度分别为(96.85±8.20),(314.53±12.76), (191.32±10.97)pg·mL-1。连花清瘟胶囊降低了急性放射性肺损伤大鼠肺组织MCP-1 mRNA与血清MCP-1趋化因子水平,照射组、照射+连花清瘟组与对照组比较,以及照射+连花清瘟与照射组比较,差异有统计学意义(P<0.05),见图4。
3 讨论
放射诱导的肺损伤目前临床上治疗方法较多,但疗效仍需提高[9-10]。连花清瘟胶囊是具有清瘟解毒、宣肺泄热作用的广谱抗炎中成药[11],在急性上呼吸道感染、急性气管-支气管炎、社区获得性肺炎等感染性炎症以及肺癌伴发热、中风后脏腑闭证高热等非感染性炎症的治疗中均取得了确切而良好的疗效[12]。
巨噬细胞是急性放射性肺炎的始动细胞,在急性与慢性放射性肺损伤的发生与发展过程中均发挥重要作用[13]。黎建绪等[14]也观察到小鼠在照射72 h后肺组织中有大量巨噬细胞聚集。笔者在预实验中观察到在照射1,2,4,8周大鼠肺组织均有巨噬细胞聚集,但就肺组织中急性炎症而言,以照射后4周最为典型(结果未在本文中展示),RYU等[15]的研究同样观察到大鼠在照射4周后肺组织中出现明显的急性炎症,因此本实验中选择照射后4周作为急性放射性肺损伤的研究时间点。笔者在本实验中发现,连花清瘟胶囊在放射性肺损伤的急性阶段通过抑制巨噬细胞的主要趋化因子MCP-1的表达进而抑制巨噬细胞向损伤肺组织中聚集,抑制了急性放射性肺损伤大鼠肺组织与血清中主要炎症因子IL-6与TNF-α[16]的释放,从而减轻急性放射性肺损伤的炎症反应,缓解了大鼠急性放射性肺损伤的症状,在实验动物体内显示出了较好的疗效。

A.对照组;B.照射组;C.照射+连花清瘟组;与对照组比较,*1P<0.05;与照射组比较,*2P<0.05图3 3组大鼠肺组织中巨噬细胞免疫组化染色(A,B,C)与计数(D)(×200)A.Control group;B.Radiation group;C.Radiation plus lianhuaqingwen group;compared with control group,*1P<0.05;compared with radiation group,*2P<0.05Fig.3 Macrophage accumulation were stained by immunohistochemistry(A,B,C)and counted(D)in three groups of rats (×200)
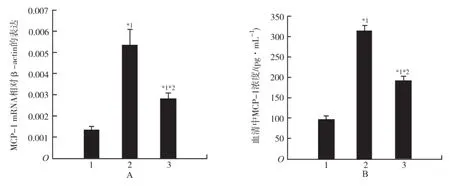
1.对照组;2.照射组;3.照射+连花清瘟组;与对照组比较,*1P<0.05;与照射组比较,*2P<0.05图4 3组大鼠肺组织(A)与血清(B)MCP-1表达情况1.Control group;2.Radiation group;3.Radiation plus lianhuaqingwen group;compared with control group,*1P<0.05;compared with radiation group,*2P<0.05Fig.4 MCP-1 expression of lung(A)and serum(B)in three groups of rats
[1] ZARIC B,STOJSIC V,TEPAVAC A,et al.Adjuvant chemotherapy and radiotherapy in the treatment of non-small cell lung cancer(NSCLC)[J].J Thorac Dis,2013,5(Suppl 4): S371-S377.
[2] MURPHY J O,SACCHINI V S.Newinnovative techniques in radiotherapy for breast cancer[J].Minerva Chir,2013, 68(2):139-154.
[3] FOKAS E,WEISS C,RODEL C.The role of radiotherapy in the multimodal management of esophageal cancer[J].Dig Dis,2013,31(1):30-37.
[4] FAY M,POOLE C M,PRATT G.Recent advances in radiotherapy for thoracic tumours[J].J Thorac Dis,2013,5 (Suppl 5):S551-S555.
[5] CANNON D M,MEHTA MP,ADKISON J B,et al.Doselimitingtoxicityafterhypofractionateddose-escalated radiotherapy in non-small-cell lung cancer[J].J Clin Oncol,2013,31(34):4343-4348.
[6] DING N H,LI J J,SUN L Q.Molecular mechanisms and treatment of radiation-induced lung fibrosis[J].Curr Drug Targets,2013,14(11):1347-1356.
[7] MARTINEZ C O,MCHALE MJ,WELLS J T,et al.Regulation of skeletal muscle regeneration by CCR2-activating chemokines is directly related to macrophage recruitment [J].AmJ Physiol Regul Integr Comp Physiol,2010,299 (3):R832-842.
[8] CHO Y J,YI C O,JEON B T,et al.Curcumin attenuates radiation-induced inflammation and fibrosis in rat lungs [J].Korean J Physiol Pharmacol,2013,17(4):267-274.
[9] LEPRIEUR E G,FERNANDE Z D,CHATELLIER G,et al. Acuteradiationpneumonitisafterconformational radiotherapyfornonsmallcelllungcancer:clinical, dosimetric,and associated-treatment risk factors[J].J Cancer Res Ther,2013,9(3):447-451.
[10] BENVENISTE MF,WELSH J,GODOY MC,et al.Newera of radiotherapy:an update in radiation-induced lung disease [J].Clin Radiol,2013,68(6):e275-290.
[11] 胡忆芬.连花清瘟胶囊的药理及临床疗效分析[J].现代诊断与治疗,2013,24(9):2012.
[12] 高永忠,赵娜,胡冰.连花清瘟胶囊治疗肺癌伴发热的临床疗效观察[J].临床医学,2013,33(9):122-123.
[13] ZHANG H,HAN G,LIU H,et al.The development of classically and alternatively activated macrophages has different effects on the varied stages of radiation-induced pulmonary injury in mice[J].J Radiat Res,2011,52(6):717-726.
[14] 黎建绪,郑雅梅,胡晓燕,等.艾迪注射液对小鼠放射性肺损伤的防治作用[J].医药导报,2014,23(2):184-188.
[15] RYU S Y,DO S H,CHUNG J Y,et al.Activation of MAP kinases during progression of radiation-induced pneumonitis in rats[J].HumExp Toxicol,2011,30(8):876-883.
[16] WANG J,XU H W,LI B S,et al.Preliminary study of protective effects of flavonoids against radiation-induced lung injury in mice[J].Asian Pac J Cancer Prev,2012,13 (12):6441-6446.
DOI 10.3870/yydb.2014.07.002
Lianhuaqingwen Capsules Inhibited the Expression and Effect of MCP-1 in Rats with Radiation-induced Acute Lung Injury
LEI Zhang1,2,LU Hong-da1,2,DONG Ke-chen1,2,LU Chi1,2,CHEN Wei-qun2,YUAN Jing-ping2,3,KONG Qing-zhi1,2
(1.Department of Oncology,the Central Hospital of Wuhan,Wuhan 430014,China;2.Wuhan Cancer Research Institute,Wuhan 430014,China;3.Department of Pathology,the Central Hospital of Wuhan, Wuhan 430014,China)
ObjectiveTo explore the inhibitory effect and possible mechanisms oflianhuaqingwencapsules on radiationinduced acute lung injury in rats.MethodsRats were randomly divided into control group,radiation group and radiation pluslianhuaqingwengroup,the control group and the radiation group rats were given 0.9%sodiumchloride solution,the radiation pluslianhuaqingwengroup rats were givenlianhuaqingwen0.9%chlorine sodiumsolution.HE staining was applied to test the lung tissue inflammation;quantitative RT-PCR and ELISA were used to measure the content of IL-6,TNF-α and MCP-1 in rats; immunohistochemical assay was taken to detect the infiltration of macrophage in lung tissues.ResultsThe relative mRNA expression of IL-6,TNF-α and MCP-1 in the control,radiation model control and radiation plusLianhuaqingwengroups were (0.002 1±0.000 20),(0.006 6±0.000 32),(0.003 9±0.000 22);(0.003 7±0.000 16),(0.007 4±0.000 33),(0.005 5± 0.000 24);(0.001 4±0.000 15),(0.005 4±0.000 72),(0.003 2±0.000 17),respectively;the concentration(pg·mL-1)of IL-6,TNF-α and MCP-1 in the serumwere(35.2±10.9),(111.8±26.1),(68.2±15.2);(229.3±28.5),(837.5±57.6), (566.9±39.8);(96.85±8.20),(314.53±12.76),(191.32±10.97),respectively;and the macrophages at high magnification field in each group were(59.5±4.3),(503.9±25.8)and(106.2±12.6),respectively.Lianhuaqingwencapsules significantly alleviated the lung inflammation in rats with radiation-induced acute lung injury,inhibited the accumulation of macrophage in lung tissue,reduced the expression of IL-6 and TNF-α,and decreased the content of MCP-1 in lung tissues and sera(P<0.05).ConclusionLianhuaqingwencapsules attenuated the lung inflammation developed in rats with radiation-induced acute lung injury through inhibiting the expression of MCP-1 and reducing the accumulation of macrophage in lung tissues.
Lianhuaqingwencapsule;Injury,lung,acute/radiation;Rat;Monocyte chemotactic protein-1
R286;R965
A
1004-0781(2014)07-0845-05
2014-03-22
2014-04-15
*国家自然科学基金资助项目(81372931, 81101550);湖北省自然科学基金资助项目(2012FFB05904);武汉市科技攻关计划项目(2013060602010253)
雷章(1981-),男,湖北公安人,博士,从事恶性肿瘤的诊治与研究。E-mail:leizhang003@126.com。
卢宏达(1971-),男,湖北武汉人,主任医师,副教授,博士,从事肿瘤分子生物学和肿瘤放疗、化疗及防护的研究。E-mail:phlonda@163.com。
