温度对铜绿微囊藻细胞浮力的调控机制
2014-05-13毕永红胡征宇中国科学院水生生物研究所淡水生态与生物技术国家重点实验室湖北武汉430072中国科学院大学北京00049
周 贝,毕永红,胡征宇(.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北 武汉430072;2.中国科学院大学,北京 00049)
温度对铜绿微囊藻细胞浮力的调控机制
周 贝1,2,毕永红1*,胡征宇1(1.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北 武汉430072;2.中国科学院大学,北京 100049)
为了探讨温度对铜绿微囊藻细胞浮力的调控机制,将铜绿微囊藻分别置于10、15、20、25、30℃条件下,利用改良的percoll密度梯度离心法测得细胞密度,计算出细胞浮力大小,同时测量细胞内比生长速率、光合活性、NAD(P)H依赖型氧化还原脱氢酶活性、糖含量、蛋白含量和漂浮细胞百分比.结果显示,在实验温度范围内(10~30℃),随着温度升高,铜绿微囊藻的漂浮细胞百分率增加,浮力变大;同时,细胞内糖含量减少,蛋白含量增加,光合作用和NAD(P)H 依赖型氧化还原脱氢酶活性增强.10、15℃条件培养7d,细胞的密度分别增加了2.7%和1.3%,糖含量分别增加了95.3%和65.5%,漂浮细胞百分比分别降低了23.8%和18.3, NAD(P)H依赖型氧化还原脱氢酶活性分别降低了23.8%和18.3%;而20、25和30℃条件培养7d,细胞的密度则分别减少了2.8%、3.8%和3.2%,糖含量分别减少了8.5%、2.9%和19.4%,漂浮细胞百分比分别增加了0%、7%和8.5%,NAD(P)H依赖型氧化还原脱氢酶活性分别增加了0%、7%和8.5%.研究结果显示:温度主要通过影响铜绿微囊藻细胞的光合速率、生长代谢速率和伪空胞含量来改变细胞密度实现浮力调节.低温下糖含量增加是浮力消失的主要原因,细胞漂浮与沉降的温度阈值在15~20℃之间.
温度;细胞浮力;调控机制;铜绿微囊藻
铜绿微囊藻是一种常见的蓝藻水华优势种[1-2],藻细胞所具备的浮力调节功能是其在不同水体中占据优势的主要因素之一[3-4],浮力调节功能既可以使藻细胞进入水体表层获得充足的光照和 CO2[5-6],也可以使之进入适宜的水体,获得充足的营养物质[7-9].研究表明,冬季蓝藻水华的消失、细胞沉降休眠及春季蓝藻复苏上浮与蓝藻对温度的响应有关,而夏季和初秋蓝藻水华暴发与蓝藻在高温下具有相对较高的生长速率有关[10-12],但关于温度对蓝藻的沉降、上浮的具体影响机制,仍缺乏清晰的认识.
蓝藻浮力调节存在3种机制:细胞内压载物含量的改变、伪空胞的产生和稀释、伪空胞的破裂[13-15].然而微囊藻伪空胞宽度窄小,强度大,细胞产生的膨胀压无法使之破裂[14],因此,微囊藻的浮力调节机制为前2种.
蓝藻细胞浮力调节研究已有大量的文献报道,涉及营养、光照和温度等诸多因子对浮力调节的影响.营养方面,藻细胞在营养富足时保持浮力;在氮限制时由于伪空胞破裂和碳水化合物的累积而失去浮力;但在磷限制条件下,即使细胞内伪空胞含量有所下降,细胞依然保持浮力[9].营养对细胞浮力的调控往往与光照结合在一起进行探讨,光强对细胞浮力的影响远远大于营养物质[16],不同光强和光暗周期决定了氮、磷和碳对藻细胞浮力的影响.藻细胞只在光照充足的水体中(表层和营养丰富的温跃层间)上下移动[16].
光对浮力调节的研究表明,藻细胞浮力对不同光强[17]和不同光周期的响应不同,细胞的响应时间、伪空胞的合成与稀释、伪空胞的破裂和碳水化合物的累积与消耗等过程均显著受到光的影响,导致在低光强下浮力增加,高光强下浮力降低.而且,研究表明,细胞浮力对光的具体响应还依赖于试验前细胞所处的营养和光照环境[18].
Thomas等[19]研究了微囊藻细胞浮力在不同温度下恢复的情况,结果表明,微囊藻细胞在高光强20℃或8℃失去浮力后,转移到20℃黑暗条件下细胞重新获得浮力,而转移到 8℃黑暗条件下细胞没有恢复浮力.适当的温度条件下细胞能恢复其浮力调控能力,与适当温度下细胞的碳水化合物利用能力和伪空胞的合成能力密切相关.金相灿也证实糖的积累使细胞密度增大是细胞在低温条件下浮力下降的主要原因[12].
目前,营养盐、光照等条件对蓝藻浮力调节的影响研究较多,而温度对蓝藻细胞浮力调节的机理研究相对较少.本文通过改良的percoll密度梯度离心法获得不同温度下铜绿微囊藻细胞的实际浮力,可避免借助其他工具和途径计算浮力带来的误差;同时结合对细胞内糖含量、蛋白含量、光合作用和呼吸代谢的分析,以期直观地揭示温度对铜绿微囊藻细胞浮力的调控机制,探索温度与浮力调节可能存在的内在关系,为认识和防控铜绿微囊藻水华提供理论依据.
1 材料与方法
1.1 藻种与培养基
铜绿微囊藻(Microcystis aeruginosa)由中国科学院水生生物研究所淡水藻种库(FACHB)提供,培养液为BG11培养液,其组成为1L去离子水中含有1.5g的NaNO3,40mg的K2HPO4,75mg的MgSO4⋅7H2O,36mg的CaCl2⋅2H2O,6mg柠檬酸,6mg柠檬酸铁,1mg EDTANa2,20mgNa2CO3,2.86g的H3BO3,1.86g的MnCl2⋅4H2O,0.22g的ZnSO4⋅7H2O, 0.39g的Na2MoO4⋅2H2O,0.08g的CuSO4⋅5H2O,0.05g的Co(NO3)2⋅6H2O,最后调节pH值至7.1.
1.2 扩大培养
取出保存的铜绿微囊藻藻种,将其转移到1000mL锥形瓶内(有500mLBG11培养液),在温度为 25℃,光照强度为 50µmol/(m·s),光暗比为12h:12h的条件下,进行 2~3次的扩大培养,当藻类生长进入对数期后,收集细胞用于接种.
1.3 实验设置
将铜绿微囊藻置于 500mL三角瓶中(300mLBG11培养液),分别在不同温度下(5个温度梯度,分别为10、15、20、25、30℃)进行培养,光照强度为50µmol/(m.s),光暗比为12h∶12h,接种量为5×104cells/mL,每组设置3个平行.
1.4 比生长速率的测定
测定完光合活性的样品取1mL用于测定细胞数量,采用血细胞计数法进行测定.然后根据下式计算比生长速率:
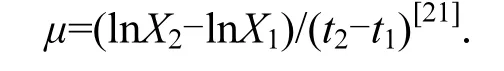
式中:X1为对数生长开始时细胞数量;X2为对数生长结束时的细胞数量;t2-t1为对数生长期时间.
1.5 光合活性测定
自接种后第1d起,每天取3mL藻样,使用浮游植物荧光仪(water-PAM 德国)检测铜绿微囊藻细胞光合系统Ⅱ(PSⅡ)在饱和脉冲光强下叶绿素荧光值的变化,得到PSⅡ的最大光化学效率Fv/Fm和电子传递速率ETR[20].
1.6 NAD(P)H依赖型氧化还原脱氢酶活性
活细胞的NAD(P)H依赖型氧化还原脱氢酶在代谢过程中将MTT还原为不溶于水的蓝紫色产物-甲臢晶体,晶体生成的量与活细胞数量和细胞活化状态呈正相关.而丧失 NAD(P)H依赖型氧化还原脱氢酶活性的死细胞不能转化MTT,因此MTT阳性细胞含量的多少可以反映细胞的死活和细胞中NAD(P)H依赖型氧化还原脱氢酶代谢活性的高低[22],而 NAD(P)H依赖型氧化还原脱氢酶活性的高低又反映了细胞呼吸代谢的强弱.测定完光合活性的样品取250µL藻液样品,加入60µLMTT染液,35℃水浴下,反应4h,然后镜检计数,得到MTT阳性细胞比例[23].
1.7 糖含量和蛋白质含量
细胞内糖含量采用苯酚硫酸法.每天取8mL藻样,3000r/min离心15min弃上清,藻体研磨后于沸水水浴1h,3000r/min离心15min并收集上清液.吸取 2mL上清液,放入具塞试管中,加入6%苯酚1.0mL及浓硫酸5.0mL,摇匀,放置30min,在490nm波长下测定其吸光度,根据标准曲线计算待测样本的浓度.
蛋白质含量采用考马斯亮蓝法进行测定.每天取8mL藻样,3000r/min离心15min弃上清.藻体加入液氮后进行研磨,反复 6~8次以充分提取蛋白质.3000r/min离心15min并收集上清液,吸取1mL上清液,放入具塞试管中,加入 5mL考马斯亮蓝G-250溶液,作用5min,在595nm波长下测定其吸光度,根据标准曲线计算待测样本的浓度.
1.8 漂浮细胞比例和浮力测定
漂浮细胞比例按照文献[24]的方法进行.
自接种后第 1d起每天测定藻细胞的浮力.首先利用percoll密度梯度离心法测得细胞的密度,取 10mL的离心管,由下向上分别加入1mL85%、60%、35%、18%和2%的percoll工作液,密度分别为1.109、1.079、1.050、1.030、1.011g/mL,最后加入1mL藻液放置于最顶层,配平后2500r/min离心10min,离心结束后观察细胞所在的percoll层,确定细胞密度.再通过浮力定律计算细胞浮力:
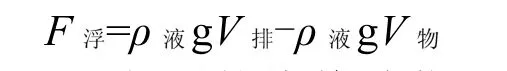
式中:ρ液为测量得到的培养过藻细胞的培养基密度约为 1.05g/mL;ρ物为测量所得的藻细胞密度;g为9.8N/kg;V物为细胞体积V=(4/3)π r3=3.6662×10-8cm3[25].r为细胞半径,通过光学显微镜下测量得来,40倍镜下,一格测微尺长度为2.5µm,测量 1000个细胞求平均值.当 F浮为正值时,表明细胞受到的力向上,细胞上浮.当F浮为负值时,表明细胞受到的力向下,细胞下沉.
1.9 统计方法
实验数据通过spss13.0进行配对T检验和相关分析,当 P<0.05时数据差异显著或显著相关;P<0.01时数据差异极显著或极显著相关.
2 结果
2.1 比生长速率

图1 不同温度下铜绿微囊藻的生长曲线Fig.1 Growth curve of Microcystis aeruginosa at different temperature
不同温度条件下藻细胞生长情况见图 1.比生长速率随温度升高而逐渐增大,其差异具有统计学意义(P<0.05).10℃时藻细胞的比生长速率为零,细胞停止生长,当温度达到 15℃时比生长速率为0.09,细胞开始缓慢生长,当温度高于20℃时,微囊藻细胞快速生长增殖,细胞呈指数增长.
2.2 光合活性的变化
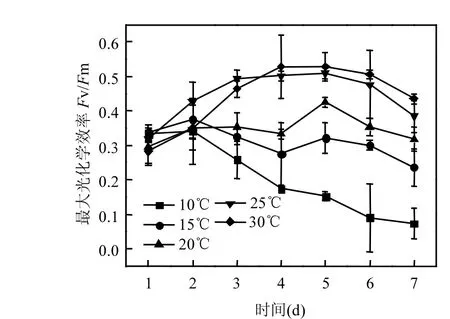
图2 不同温度下藻细胞PSⅡ最大光化学效率Fv /FmFig.2 Fv /Fm of Microcystis aeruginosa at different temperature
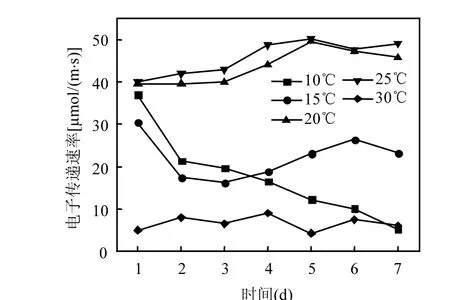
图3 不同温度下藻细胞电子传递速率ETRFig.3 ETR of Microcystis aeruginosa at different temperature
高温(20~30℃)处理组的藻细胞最大光化学效率 Fv/Fm和电子传递速率 ETR均高于低温(10~15℃)处理组(图 2、图 3),且两者差异具有统计学意义(P<0.05).这说明高温下细胞光合能力较强,可产生更多的光合产物—碳水化合物.
2.3 NAD(P)H依赖型氧化还原脱氢酶活性
高温(20~30℃)下 MTT阳性细胞显著多于低温(10~15℃)条件(图 4),两者差异具有统计学意义(P<0.05).高温培养下的藻活细胞较多,其 NAD(P)H依赖型氧化还原脱氢酶活性强,呼吸代谢活动旺盛;低温下藻细胞 NAD(P)H依赖型氧化还原脱氢酶活性弱,显示细胞活性较差.
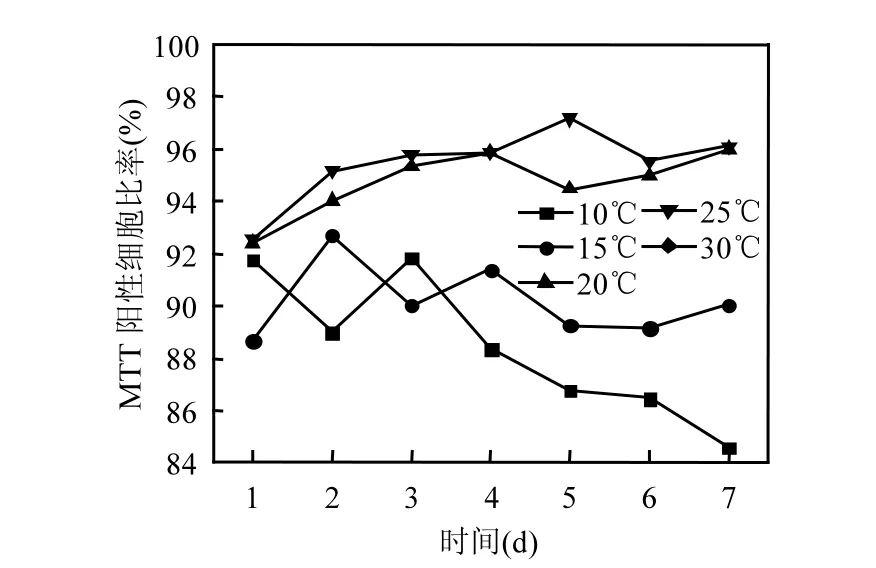
图4 不同温度下铜绿微囊藻MTT阳性细胞比例Fig.4 MTT positive cells ratios of Microcystis aeruginosa at different temperature
2.4 糖含量与蛋白含量的变化
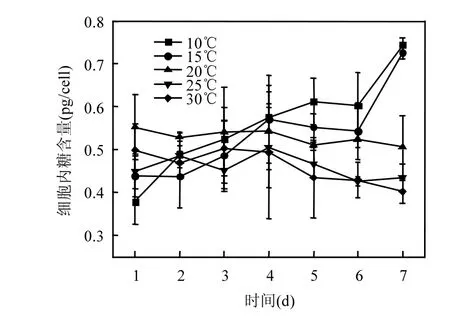
图5 不同温度下铜绿微囊藻细胞内糖含量变化Fig.5 Variations in sugar content of Microcystis aeruginosa at different temperature
随着温度升高,藻细胞内糖含量逐渐减小.在低温(10、15℃)下细胞内糖含量随培养天数增加而增加,7d内分别增加了1.96倍和1.66倍.高温下(20℃、25℃、30℃)细胞内糖含量下降(图5),7d内分别减少8.5%、5%和19.5%,第7d时高温和低温下细胞内糖含量差异显著(P<0.01),10℃培养组细胞内糖含量是30℃培养组的1.851倍.通过 pearson相关分析得到,细胞内糖含量和温度呈极显性负相关(P<0.01).
随着温度升高,藻细胞内蛋白含量逐渐增大(图6).低温条件下细胞内蛋白含量呈下降趋势,在高温条件下细胞内蛋白含量明显升高,第7d时高温和低温条件下蛋白含量具有显著差异(P<0.05).通过pearson相关分析得到,蛋白含量与温度呈极显性正相关(P <0.01).
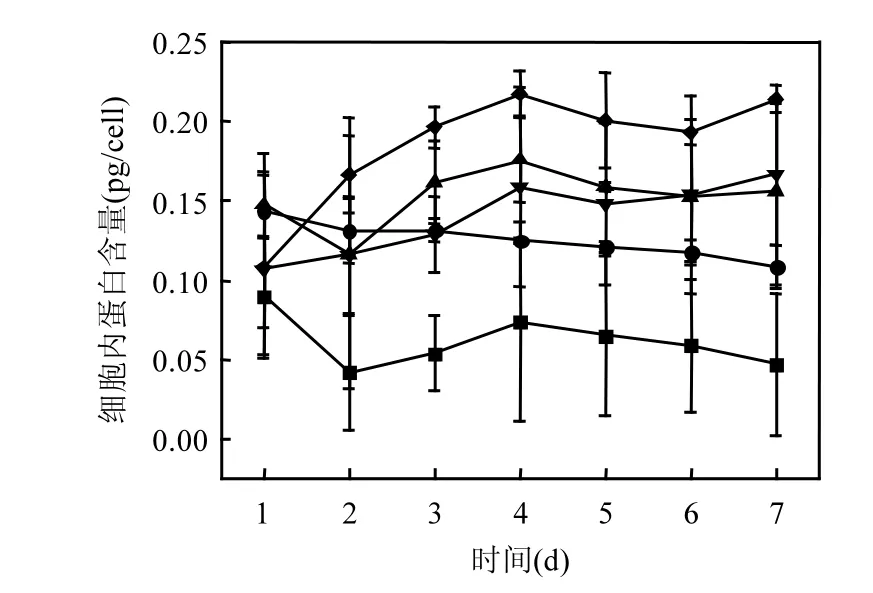
图6 不同温度下铜绿微囊藻细胞内蛋白含量变化Fig.6 Variations in protein content of Microcystis aeruginosa at different temperature
2.5 漂浮细胞比例

图7 不同温度下铜绿微囊藻细胞漂浮细胞比例变化Fig.7 Variations in floating percentage of Microcystis aeruginosa at different temperature
高温(20~30℃)下漂浮细胞比例显著高于低温(10~15℃)下漂浮细胞比例(图 7),并且高温下漂浮细胞比例(>50%)几乎保持不变,表明细胞浮力始终存在.当温度低于 15℃时,漂浮细胞比例开始明显下降(<50%),表明细胞浮力逐渐丧失.通过配对 t检验得出,高温条件下的漂浮细胞比例与低温条件下的呈极显著差异(P<0.01).由此进一步证明,温度对浮力影响的阈值在 15~20℃之间,温度低于 15℃铜绿微囊藻趋于下沉,温度高于20℃铜绿微囊藻趋于上浮.
2.6 浮力的变化
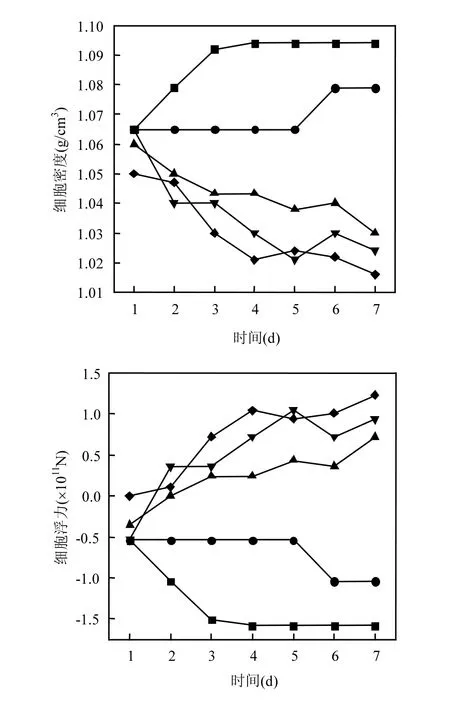
图8 不同温度下铜绿微囊藻细胞密度和浮力的变化Fig.8 Variations in density and buoyancy of Microcystis aeruginosa at different temperature
随着温度升高,藻细胞密度减小,浮力增加(图8),通过pearson相关分析得到,细胞浮力与温度呈极显著正相关(P<0.01).在低温(10~15℃)条件下,随着天数增加,藻细胞密度逐渐增大,浮力逐渐减小,而在高温(20~30℃)条件下,随着天数的增加,藻细胞密度逐渐减小,浮力逐渐变大.通过配对 t检验,高温下与低温下的细胞浮力呈极显著差异(P<0.01).这表明温度对藻细胞浮力影响的阈值应该在15~20℃之间.
3 讨论
多年来温度对铜绿微囊藻生长与代谢的影响一直备受关注,在适宜温度范围内,温度每提高10℃,藻细胞酶促反应速度将提高1~2倍.当温度高于一定限度,酶活性不再增高,反而降低[26].因此,在适宜温度范围内,藻细胞的生长速率随着温度升高而提高.研究表明,微囊藻的最适生长温度为28℃[27-30].袁丽娜等[27]发现铜绿微囊藻在低温(10℃)环境中不增长(μ<0.01)或处于负增长(μ<0)状态;李阔宇等[28]研究表明,在15 ,30µmol/℃ (m.s)条件下,底泥中微囊藻复苏开始启动,而存在于底泥中的微囊藻迁移至上层水体的最适条件为20 ,30µmol/℃ (m.s);Hua等[29]在洋河水库的围隔实验证实,当水温为 26℃时,最适宜于微囊藻的聚集、上浮而形成水华;刘玉生等[30]的研究表明微囊藻在 30~35℃时比生长速率快速增加,35℃达到最大,但当微囊藻生长达到最大增殖后,细胞马上开始沉淀,溶液绿色消退,呈乳白色,因此微囊藻的最适生长温度为28℃.本研究获得了相同的结论,低于15℃的处理对铜绿微囊藻的生长与代谢不利,高于20℃的处理有助于铜绿微囊藻保持正常生命活动;从结果来看,温度对铜绿微囊藻生长代谢的影响与温度对细胞浮力的调节机制具有直接的相关关系.低温(低于15℃)下,细胞比生长速率小、涉及生长代谢的关键酶活力低,光合作用获取的能量大部分转变为糖类物质储藏在细胞内,细胞密度相对较大,导致细胞浮力较小;另一方面,因为细胞浮力较小,细胞无法到达理想的水域获取生命活动所必需的光照和营养,这种状况进一步导致了细胞较低的生长速率,限制了细胞的增殖和种群的增长.高温(20~30℃)作用下,细胞比生长速率较大,涉及生长代谢和光合作用的关键酶活力高,光合作用产生了大量的碳水化合物,而较高的代谢速率及时消耗了大量的光合产物,为细胞的增殖和种群的增长提供了物质和能量基础,最终导致细胞密度减小,细胞浮力增加,使细胞种群可以漂浮在水体表面.Kromkamp等的研究证明,铜绿微囊藻的昼夜垂直迁移,是由于细胞内碳水化合物的累积和消耗,导致细胞密度和浮力快速改变,从而使细胞快速的进行垂直迁移[31-33].金相灿等[12]的研究表明,温度低于 13℃时,水华微囊藻下沉趋于休眠,温度升高至 13℃以上,水华微囊藻趋于复苏和上浮,而在此过程中,糖的积累和消耗是水华微囊藻细胞浮力调节的关键因素.从前人的研究结果可以推断,温度对铜绿微囊藻的影响与其对细胞代谢速率的改变具有直接关系,细胞代谢以及相关胞内胞外物质的快速合成与降解利用是细胞上浮下沉的内在原因,温度作为外部力量改变了细胞的具体反应进程.
本研究结果与上述文献结果基本一致,当温度低于15℃时,铜绿微囊藻的生长代谢速率减小,但此时细胞仍具有较高的光合作用,因此光合作用产生的糖类物质大大超过了细胞分裂需求,导致糖类物质累积,细胞密度增大,而此时细胞内蛋白含量较低,意味着伪空胞所提供的浮力不足以抵消压载物的累积,细胞开始下沉.当温度低于10℃时,藻细胞停止增长,死亡率增加,活细胞的生理生化活性降至最低,浮力减小,细胞下沉,在极低温环境的影响下,细胞进入休眠状态,以抵御外界不良环境.而在高温作用下(20~30℃),细胞具有较高的生长速率,较强的光合作用产生了大量的碳水化合物-糖类,为细胞的快速生长增殖提供了物质基础,而较高的代谢速率及时分解了大量的糖类,产生了大量ATP,为细胞的快速生长增殖提供了能量基础,细胞内糖含量的减少,导致细胞密度减小,浮力增加.同时细胞中蛋白含量增多,伪空胞含量增加,伪空胞提供的浮力抵消了压载物的累积,最终导致细胞上浮.自然水体中,当春天温度升高时,水底沉积表面的温度逐渐升高,藻细胞开始复苏,其生理生化活性缓慢恢复,然后开始利用光能源和营养物质进行光合作用、呼吸作用和生长分裂,以达到生物量的大量累积并在一定条件下形成群体.夏季时,适宜的气象和水文条件会导致已在水体大量累积的铜绿微囊藻群体上浮至水体表面聚集成肉眼可见的水华.由此可见,温度是控制铜绿微囊藻细胞上浮和下沉的重要因子,温度对藻细胞浮力影响的阙值应该在15~20℃之间,温度低至 15℃以下,细胞下沉趋于休眠,温度升高至20℃以上,细胞趋于上浮.
温度对藻细胞浮力的调控首先表现为温度改变了细胞的酶活性和代谢速率.Rubisco酶活性随温度升高而增加,不同温度导致光合作用和呼吸作用产生和消耗碳水化合物的速率的差异,引起藻细胞密度的快速改变,从而改变了藻细胞浮力[34].此外,Rubisco的加氧酶活性与羧化酶活性对温度的敏感程度不一样,通常,Rubisco加氧酶/羧化酶活性的比值随温度的升高而增加[35].因此,随着温度的升高,藻细胞光合作用和光呼吸作用同时增强,但是光呼吸作用加强的速率高于光合作用,也就是糖类的消耗速率高于累积速率,最终导致藻细胞糖类物质含量减少,细胞密度减小,浮力增加.从本文结果分析可知,高温条件下,铜绿微囊藻细胞的光合系统Ⅱ活性较高(图 2,图3 ),其Rubisco酶活性高,光合作用较强,因此产生了大量光合产物-糖类,而此时活细胞较多,其NAD(P)H依赖型氧化还原脱氢酶活性较强(图4),呼吸代谢活动较为旺盛,分解了大量的碳水化合物,产生了大量的能量以满足代谢需要.这也验证了高温条件下,细胞内糖含量减少,细胞密度减小,细胞浮力增加.而低温条件下,铜绿微囊藻细胞的光合系统Ⅱ活性相对降低(图2,图3), Rubisco酶活性降低,光合作用产生的光合产物相对减少,但此时细胞趋于凋亡,活细胞的 NAD(P)H依赖型氧化还原脱氢酶活性较弱(图8),呼吸代谢活动较为不旺盛,无法分解利用光合作用产生的碳水化合物,导致细胞密度增加,细胞浮力减小.
其次,温度对浮力的调节还表现为温度引起伪空胞含量的改变.伪空胞是由蛋白质构成的圆柱体气囊组成,其主要功能是为细胞提供浮力并参与浮力调节,当细胞内伪空胞提供的浮力足够抵消压载物的累积时,细胞将会上浮,反之则下沉.Justin 等[18]的研究表明,铜绿微囊藻蛋白含量随着温度的升高而增大,细胞内蛋白含量变化趋势与细胞内伪空胞一致.本文测试获得的蛋白质含量结果显示,随着温度升高,铜绿微囊藻细胞内蛋白含量逐渐增大,该结果与Justin等[18]的研究一致,说明随着温度的升高,铜绿微囊藻细胞内伪空胞含量也逐渐增大.
本文通过percoll密度梯度离心法得到不同温度下铜绿微囊藻细胞的密度,利用浮力定律直接计算出细胞所受到的浮力大小,再结合对细胞生长速率、糖含量、蛋白含量、光合速率和代谢速率分析得到,温度主要通过影响细胞的生长速代谢速率、光合速率和伪空胞含量来改变细胞密度,从而实现对铜绿微囊藻细胞浮力的调节. 本文所获得的结果正好印证了孔繁祥等[36]将铜绿微囊藻的生长与水华形成分为休眠、复苏、生物量增加(生长)、上浮及聚集等阶段的研究结论;水体中铜绿微囊藻的生命活动因为一年四季的温度差异而表现为显著不同的生态阶段;由此可见,温度对细胞浮力的调控在铜绿微囊藻生命活动的不同阶段中起到了重要作用.
4 结论
4.1 温度通过影响铜绿微囊藻细胞的光合速率、生长代谢速率和伪空胞含量来改变细胞的密度,从而实现对细胞浮力的调节.
4.2 10~15℃时铜绿微囊藻细胞生长和代谢速率降低,光合作用产生的糖类在细胞累积,导致密度增大,浮力减小,细胞发生沉降,低温下糖含量增加使得细胞密度增大是浮力消失的主要原因.
4.3 20~30℃时铜绿微囊藻快速的生长代谢速率及时消耗了光合作用产生的碳水化合物,导致细胞密度减小;同时细胞内产生大量伪空胞所提供的浮力足以抵消压载物的累积,最终细胞上浮.
4.4 细胞漂浮沉降的温度阈值在15~20℃间.
[1] Granf G G, Diurnal mixing and the vertical distribution of phytoplankton in a shallow equatorial lake [J]. Ecol., 1974,62: 611-629.
[2] Robarts R D and Zohary T, Microcystis aeruginosa and underwater light attenuation in a hypertrophic lake [J]. Ecol., 1984,72:1001-1007.
[3] Dokulil M T, Teubner K. Cyanobaeterial dominance in lakes [J]. Hydrobiologin, 2000,438:1-12.
[4] Irene K E, Bnmberg A K.The importance of shallow sediments in the recruitment of Anabaena and Aphanizomenon (Cyanophyeeae) [J]. Phycol., 2004,40:831-836.
[5] Humphries S E, Lyne V D. Cyanopbyte blooms the role of cellbuoyancy [J]. Limnol. Oeeanngr., 1988,33:79-91.
[6] Walsby A E, Hayes P K, Roje R, et al. The selective advantage of buoyancy provided by gas vesicles for planktonic cyanobacteria in the Baltic Sea [J]. New Phytol., 1997,136:407-417.
[7] Klemer A R, Feuillade J, Feuiilade M. Cyanobaeterial blooms: carbon and nitrogen limitation have opposite effects on the buoyancy of Oscillatorial [J]. Science, 1982,215:1629-1631.
[8] Gad G G, Oliver R L. Vertical separation of light and available nutrients as a factor causing replacement of green algae by blue-green algae in the plankton of a stratified lake [J]. Ecol., 1982,70:829-844.
[9] Chu Z S, Jin x C, Yang B ,et al.Buoyancy regulation of Microcystisflos-aquae during phosphorus-limited and nitrogenlimited growth [J]. Journal of Plankton Research, 2007,29:739-745.
[10] Brunberg A K, Blomqvist P. Benthic overwintering of Microcystic colonies of under different environmental conditions [J]. Journal of lankton Research, 2002,24:1247-1252.
[11] Irene K E, Brunberg A K. The importance of shallow sediments inthe recruitment of Anabaena and aphanizomenon (Cyanophyceae) [J]. Journal of Phycology, 2004,40:831-836.
[12] 金相灿,储昭升,杨 波,等.温度对水华微囊藻及孟氏浮游蓝丝藻生长、光合作用及浮力变化的影响 [J]. 环境科学学报, 2008,28(1):50-55.
[13] Walsby A E, Gas vesicles [J]. Microbiol. Rev., 1994,58:94-144.
[14] Thomas R H, Walsby A E. Buoyancy regulation in a strain of Microcystis [J]. Journal of General Microbiology, 1985,131:799-809.
[15] Kinsman R, Ibelings B W, Walsby A E. Gas vesicle collapsemby turgor pressure and its role in buoyancy regulation by Anabaena flos-aquae [J]. Gen. Microbiol., 1991,137:1171-1178.
[16] Bormans M, Sherman B S, Webster I T. Is buoyancy regulationin cyanobacteria anadaptation to exploit separation of light andnutrients [J]. Mar Freshw. Res., 1999,50(8):897-9061.
[17] 梁 瑜,陈雪初,孔海南,等.遮光围隔中铜绿微囊藻的时空分布特征 [J]. 中国环境科学, 2007,27(6):821-825.
[18] Justin B ,George G. Variations in the buoyancy response of Microcystis aeruginosa to nitrogen,phosphorus and light [J]. Journal of lankton Research, 2001,23:1399-1411.
[19] Thomas R H, Walsby A E. The Effect of Temperature on Recovery of Buoyancy by Microcystis [J]. Journal of General Microbiolog, 1986,132:1665-1672.
[20] Maxwell K, Johnson G N. Chlorophyll fluorescence-a practicalguide [J]. Exp Bot, 2000,51(345):659-6681.
[21] Guillard R R, Kilham P, Jackson T A. Kineticsofsilicon-limited growth inmarinediatomthalassiosira-pseudonana hassle andheimdal = cyclotella-nana hustedt [J]. Journal of Phycology, 1973,9:233-237.
[22] Berridge M V, Herst P M, Tan A S. Tetrazolium dyes as tools incell biology: New in sights in to their cellular reducion [J]. Biotechnol. Annu. Rev., 2005,11:127-1521.
[23] Jieli lirongsong. Applicability of the M T T assay for measuring viability of cyanobacteria and algae, specifically for Microcystis aeruginosa (Chroococcales, Cyanobacteria) [J]. Phycologia, 2007, 46(5):593-599.
[24] 李 杰,丁 涛,郑凌凌.滇池微囊藻沉降细胞生理特性及沉降比例动态变化研究 [J]. 环境科学, 2010,31(3):668-672.
[25] 章宗涉,黄祥飞.淡水浮游生物研究方法 [M]. 北京科学出版社, 1991.
[26] 张 程,袁宏志.温度对发酵过程中乙醇脱氢酶的活性效应.山西科技 [J], 2008,4:100-104.
[27] 袁丽娜,宋 炜,肖 琳,等.多环境因素全面正交作用对铜绿微囊藻生长的效应研究 [J]. 南京大学学报, 2008,44(4):408-414.
[28] 李阔宇,宋立荣,万 能.底泥中微囊藻复苏和生长特征的研究[J]. 水生生物学报, 2004,28(2):113-118.
[29] Hua J B, Zong Z X. Experimental research on formation of algae bloom in Yanghereservoir [J]. Universitatis Pekinensis (Acta Scientiarum Naturalium), 1994,30:476-484.
[30] 刘玉生,韩 梅,梁占斌.光照、温度和营养盐对滇池微囊藻生长的影响 [J]. 环境科学研究, 1995,8(6):7-11.
[31] Kromkamp J, Mur L R. Buoyant density changes in thecyanobacterium Microcystis aeruginosa due to changes in the cellular carbohydrate content [J]. FEMS Microbiol. Lett., 1984, 25:105-109.
[32] Wallace B B, Hamilton D P. The effect of variations inirradiance on buoyancy regulation in Microcystis aeruginosa [J]. Limnol. Oceanogr., 1999,44:273-281.
[33] Wallace B B, Hamilton D P. Simulation of water-bloom formation in the cyanobacterium Microcystis aeruginosa [J]. PlanktonRes., 2000,22:1127-1138.
[34] Kromkamp J C, Walsby A E. A computer model of buoyancy and vertical migration in cyanobacteria [J]. Journal of Plankton Research, 1990,12:161-183.
[35] Nicola D’Ambrosio, Carmen Arena. Temperature response of photosynthesis,excitation energy dissipation and alternative electron sinks to carbon assimilation in Beta vulgaris L [J]. Environmental and Experimental Botany, 2006,55:248-257.
[36] 孔繁翔,高 光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考 [J]. 生态学报, 2005,25(3):589-595.
Effects of temperature on the buoyancy of Microcystis aeruginosa.
ZHOU Bei1,2, BI Yong-hong1*, HU Zheng-yu1
(1.State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China;2.University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2014,34(7):1847~1854
Microcystis aeruginosa were cultured in different temperature: 10 ℃, 15 ℃, 20 ℃, 25 ℃, 30 ℃ to screen the effects of temperature on buoyancy regulation. Cell density was measured by percoll density gradient centrifugation and cell buoyancy was calculated by the buoyancy formula. Simultaneously, biomass, specific growth rate, the photosynthetic activity, the activity of NAD (P) H dependent oxidoreductase, intracellular carbohydrate, protein content, the percentage of floating cells were measured. With the increasing of the experimental temperature (10℃-30℃), buoyancy, the percentage of floating cells, intracellular protein content, photosynthesis rate and the activity of NAD (P) H dependent oxidoreductase increased and the intracellular carbohydrate content decreased. After 7days cultured at 10, 15℃, cell density were increased by 2.7% and 1.3%, respectively; carbohydrate content were increased by 95.3% and 65.5%, respectively; the percentage of floating cells were reduced by 23.8% and 18.3, respectively; the activity of NAD (P) H dependent oxidoreductase were reduced by 23.8 % and 18.3% respectively. After 7days cultured at 20, 25, 30 ℃, cell density were reduced by 2.8%, 3.8% and 3.2%, respectively; carbohydrate content were reduced by 8.5%, 2.9% and 19.4%, respectively; the percentage of floating cells were increased by 0%, 7% and 8.5%, respectively; the activity of NAD (P)H dependent oxidoreductase were increased by 0%, 7% and 8.5%, respectively. It was concluded that cell growth rate, photosynthetic rate, metabolic rate were the function of temperature in the buoyancy regulation of Microcystis aeruginosa. The main reason for the buoyancy loss is the accumulation of carbohydrate, the temperature threshold value for the buoyancy is between 15~20℃.
temperature;buoyancy;the regulation mechanism;Microcystis aeruginosa
X171
A
100-6923(2014)07-1847-08
周 贝(1987-),女,河南新乡人,中国科学院水生生物研究所博士研究生,主要研究方向为水域生态学.
2013-10-18
国家自然科学基金项目(31123001);国家973项目(2008CB418002)
* 责任作者, 副研究员, biyh@ihb.ac.cn
