蔬菜类废物两相厌氧消化水解酸化相颗粒降解规律
2014-05-11何品晶
吕 凡,蔡 涛,朱 敏,何品晶*
(1.同济大学固体废物处理与资源化研究所,上海 200092;2.住房和城乡建设部村镇建设司农村生活垃圾处理技术研究与培训中心,上海 200092)
蔬菜类废物两相厌氧消化水解酸化相颗粒降解规律
吕 凡1,2,蔡 涛1,朱 敏1,何品晶1,2*
(1.同济大学固体废物处理与资源化研究所,上海 200092;2.住房和城乡建设部村镇建设司农村生活垃圾处理技术研究与培训中心,上海 200092)
研究蔬菜类废物两相厌氧消化过程中水解酸化液物化性质随水解时间的变化情况,结合总有机碳(TOC)、溶解性有机碳(DOC)、颗粒粒径和溶解性有机物(DOM)分子量的分析,探讨了蔬菜类废物水解酸化过程中TOC溶出和颗粒降解之间的关系,分析了水解酸化相颗粒物降解规律.实验结果表明,蔬菜类废物水解过程可以分成两个阶段:易水解的颗粒物在前5d迅速水解,TOC浓度迅速升高,在第5d达到最大值4920mg/L,水解产生颗粒态物质的二次平均直径从第1d的58.38µm降至第5d的4.64µm,有机物快速溶出,DOC/TOC比值在第4d达到最大值85%,该水解过程可用Contois模型模拟;第5d后,难水解颗粒物质的缓慢水解起主导作用,颗粒态物质的二次平均直径从4.64µm开始逐渐增大,并稳定在8.97~10.68µm范围内,TOC和DOC溶出率逐渐降低,且DOC溶出率小于TOC溶出率.大分子溶解性有机物的降解也主要集中在水解过程的前 5d,水解第 1d产生的大分子 DOM(1.6×109~1.9×109Da)到第 5d已经全部降解成分子量在 5×104~4×106Da的DOM;第5d过后,DOM的分子量分布情况并未发生较大变化.表明蔬菜类废物两相厌氧消化工艺过程中水解时间可缩短为5d.
蔬菜废物;两相厌氧消化;分子量;颗粒态物料;水解
随着农村的产业结构调整,蔬菜作物种植在农业中所占比例越来越大,种植方式开始向大规模集中种植转变,相应的蔬菜种植区会产生大量的蔬菜类废物[1],此外,集贸市场也是主要的蔬菜类废物产生源.目前国内外处理蔬菜类废物的方式有青贮法贮存作为动物饲料[2]以及好氧堆肥法、厌氧消化法、好氧-厌氧联合处理法[3].厌氧消化处理蔬菜类废物,可实现废物的减量化和资源化,近年来得到了广泛的研究[4-5].Bouallagui[6]研究了两相厌氧消化处理果蔬类废物并获得较好的处理效果.两相厌氧消化工艺是将厌氧消化步骤中的水解酸化过程(水解酸化相)和乙酸化甲烷化过程(产甲烷相)分离成两个独立的处理单元,分别单独调控,为水解酸化微生物和产甲烷微生物提供各自适宜的生存环境,从而达到改善厌氧消化效果的目的[7-9].水解酸化相蔬菜类废物以颗粒态固体或半固体的形态存在,其生物化学组成主要是多糖、半纤维素、纤维素、蛋白质和木质素等聚合物[10-11],需要水解成单体有机物、从固相转移至液相后,才能被微生物细胞吸收利用.因此,水解作为蔬菜类废物厌氧消化过程的第一步骤,水解效率和水解产物的性质会直接影响到后续酸化、乙酸化和甲烷化等厌氧消化步骤的效率[12-13],是蔬菜类废物等颗粒态物料厌氧降解的控制步骤[14-16].Dimock等[17]认为颗粒物的水解过程与颗粒表面紧密相关,颗粒物缩减水解模式下颗粒表面积逐渐下降,而颗粒物破碎水解模式下大颗粒被水解成多个小颗粒,颗粒总体表面积则是先增加后下降.而 Batstone[18]认为颗粒有机物水解过程可以分为瓦解、溶解和酶解3个阶段.不同的颗粒有机物组成成分和颗粒水解模式会导致水解动力学的差异[19-21].常见的水解动力学模型包括一级反应动力学模型、两阶段水解模型、Contois模型、PBM 模型等[22-24].但是,目前对水解阶段的研究大多仅基于水解液的pH值、COD、挥发性脂肪酸(VFA)等总量指标来反映水解过程[25-27],而很少直接基于颗粒态物料水解过程中颗粒的变化规律.
本文通过分析水解酸化液中颗粒的粒径和胶体的分子量分布及变化,研究了蔬菜类废物两相厌氧消化过程中水解酸化相颗粒的降解规律,以期为两相厌氧消化工艺调控条件的选择和优化提供依据.
1 材料与方法
1.1 实验材料
从学校食堂收集的蔬菜类废物,其组成包括菜叶、菜头和土豆皮.经人工破碎,平均粒径小于5mm,甲烷相的接种污泥为取自某生活污水处理厂的厌氧消化污泥,其物化组成见表1.
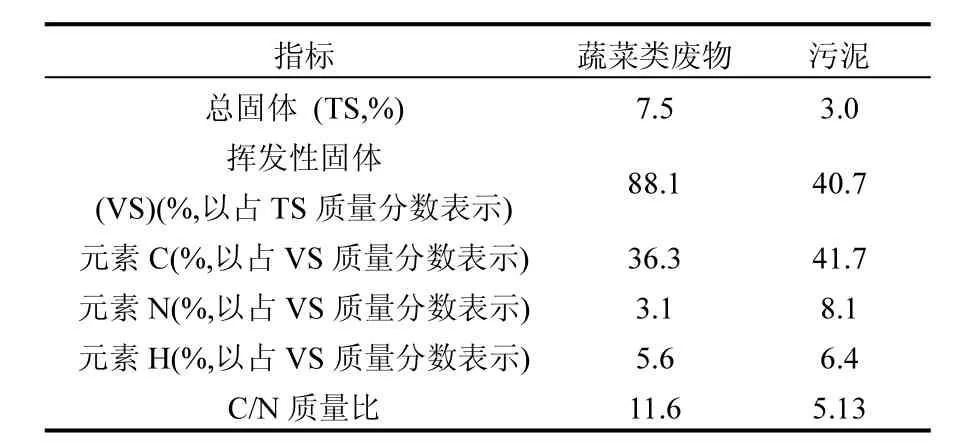
表1 实验材料的理化性质Table 1 Physiochemical characteristics of materials
1.2 实验方法
两相厌氧实验装置如图1所示,由水解酸化反应器和甲烷化反应器两部分构成.水解酸化反应器由有机玻璃制成,体积为 40L,甲烷化反应器是体积为18L的上流式厌氧复合床(UBF)反应器,由下部的升流式厌氧污泥床(UASB)和上部的厌氧滤床(AF)两部分串联组成.AF段填充固定了直径为 4~6mm的陶粒,以提供微生物附着生长的表面及悬浮生长的空间.两相厌氧反应器在中温条件(35℃)运行.
采用间歇批次操作方式,初始批次 9kg蔬菜类废物采用甲烷化出水浸泡(每 500g蔬菜类废物采用1L出水浸泡)约12d后,将水解酸化液一次性排入储存罐备用.本课题组之前研究[28-29]发现甲烷化出水可以为水解酸化提供一定的碱度、微生物和酶.水解酸化液每日定量以3L/d流量用蠕动泵输入到甲烷化反应器,甲烷化反应器出水也用储存罐收集,用来循环浸泡下一批新鲜的蔬菜类废物.甲烷化反应器每次进水完毕后,开启内部循环 1h,使进水在反应器内部均匀.厌氧污泥在启动并稳定运行产甲烷过程时,有机负荷(OLR)不能过低,OLR必须达到 1g TOC/(L·d)以上的水平.不同批次的废物浸泡 12d后水解酸化液的TOC浓度在4500~6000mg/L的范围内,为满足1g TOC/(L·d)以上的OLR的要求,设置甲烷化反应器的水力停留时间(HRT)为6d.
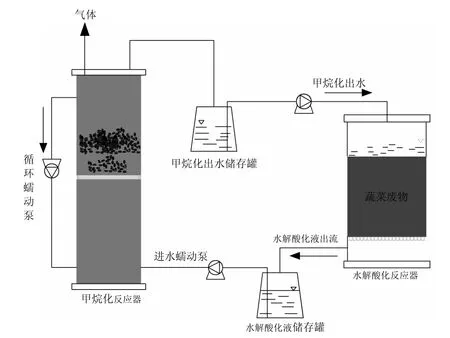
图1 实验装置示意Fig.1 Schematic diagram of experimental set-up
1.3 测试方法
从水解酸化液储存罐中每日采集蔬菜类废物在浸泡过程中产生的水解酸化液,以及甲烷化反应器运行稳定后的甲烷化出水.收集到的液体样品以12000r/min离心10min后,取上清液测总有机碳(TOC);水解酸化液过0.45µm PVDF膜后,测试溶解性有机碳(DOC)浓度和分子量分布,膜上物质采用蒸馏水冲洗收集再悬浮后测试其粒径分布.TOC和 DOC采用 TOC仪(SHIMADZU TOC-V CPH,日本岛津)测定,分子量分布采用凝胶过滤色谱(SHIMADZU LC-10ADVP,日本岛津)分析,粒径分布采用激光粒度分析仪(Eyetech-combo,荷兰安米德公司)分析.实验物料的TS、VS采用减重法测定,C、H、N采用元素分析仪(ELEMENTAR Vario EL III,德国元素分析系统公司)分析.
2 结果与讨论
2.1 水解酸化液TOC和DOC的变化
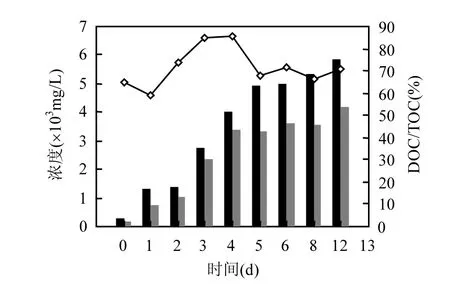
图2 水解酸化液TOC和DOC随时间变化曲线Fig.2 Temporal evolution of TOC and DOC in hydrolytic acidification effluent
蔬菜类废物在12d的浸泡过程中,水解酸化液的TOC和过0.45µm滤膜后的DOC浓度变化如图2所示.在浸泡前5d有机物迅速溶出,TOC值快速升高,至第5d达到4920mg/L;之后,TOC上升速度趋缓,到第 12d浸泡结束,TOC浓度为5880mg/L.水解酸化液的DOC在浸泡初期4d内也迅速增加,至第4d即达到3400mg/L;之后增加趋势不明显,至第12d时达4170mg/L.DOC/TOC的比值在前4d呈上升趋势,至第4d达到最大值85%;之后DOC/TOC值下降,并保持在67%~72%的范围内.
2.2 膜上物质的粒径分布

图3 水解酸化液0.45µm以上颗粒粒径分布(a)及MDv值随时间变化曲线(b)Fig.3 Particle size distribution and temporal evolution of MDv in hydrolysis acidification effluent
分析水解酸化液过0.45µm膜后的膜上物质的粒径分布,测试结果用颗粒体积对应的直径来表达,如图3a所示.可见第1d水解酸化液样品的颗粒度直径远远大于其他样品,而其余样品的颗粒度直径分布非常接近.Day0水解酸化液表示蔬菜类废物浸泡 1h后水解酸化液,颗粒都集中在30µm以下,而蔬菜类废物在水解第1d降解产生的颗粒尺度在30µm以上的物质占到80%.这些颗粒在第2d即被迅速降解成30µm以下的较小颗粒.以体积表征的二次平均直径(MDv)来评价样品的颗粒度大小,MDv指的是以与颗粒体积相同的球体直径表征颗粒大小.如图 3b所示:水解酸化液第1d的MDv最大,达58.38µm,第2d的MDv即降至13.29µm,之后缓慢下降,最低值出现在第5d,仅为4.64µm;第5d后,MDv值又呈上升趋势,但总体稳定在8.97~10.68µm范围.
2.3 溶解性有机物(DOM)分子量分布
水解酸化液过0.45µm膜后的分子量分布如图4所示.图中横坐标是分子量取对数后的值,横坐标方向数值越大,代表的分子量也就越大;纵坐标是各个点位的分子量所占的百分比与DOC浓度的乘积,代表不同分子量的溶解性有机物占总溶解性有机物的浓度比例.由图4可知,蔬菜废物浸泡1h(Day0)和第1d时DOM
分子量集中分布在 1.6×109~1.9×109Da和5×104~4×106Da两个范围内,前者表明水解产生了一些大分子物质;在后一范围内存在3个峰,分子量由小到大分别称为峰a(约4×104Da)、峰b(约7.5×104Da)和峰 c(约 2.5×105Da).至第 3d 1.6× 109~1.9×109Da范围内的大分子物质被降解 水解产物的分子量全部分布在 5×104~4×106Da范围,3个峰的峰值都变大.从第 4d开始,水解产物向5×104~4×106Da范围的两侧衍化,出现小于5× 104Da和大于4×106Da的物质,分子量较小的峰a和峰b的峰值进一步变大.可见,溶解性水解产物在由大分子物质向小分子物质降解的同时,也有部分颗粒水解成更大分子量的 DOM,颗粒的水解与水解产物进一步降解是同时进行的过程.从第5d~8d,峰a和峰b的峰值降低,水解产生分子量500Da左右的小分子物质,但这个过程的变化不显著.到第 12d,水解产物中增加了很多分子量介于4×104Da和7×104Da的物质,分子量分布的峰值为1×104Da,处于峰a和峰b之间.甲烷化反应器出水的分子量分布图显示主峰位于 2.3× 105Da的位置,主要分布在5×104~1×106Da范围.从纵坐标可以看出,甲烷化反应器出水中各级分子量的 DOM所占的浓度比例明显降低,这是由于水解液中大分子的 DOM 被甲烷化反应器中的微生物分解造成的.

图4 水解酸化液溶解性分子量分布曲线Fig.4 Molecular weight distributions of dissolved organic matters in hydrolysis acidification effluent
2.4 讨论
TOC和DOC的溶出速率(dTOC/dt,dDOC/dt)如图5所示.第1d TOC的溶出速率达1000mg/ (L·d),而第2d仅为100mg/(L·d),前2d的TOC升高应归因于初始物料破碎制备时发生的机械水解,第1d的水解率较高是因为在蔬菜废物切碎过程中表面已有一部分TOC溶出,而微生物分泌的水解酶催化水解作用从第2d开始逐渐启动.按水解速率高低,可以将水解过程分成初期的快速水解(前 5d)和后期的缓慢水解两个阶段.结合水解酸化液在浸泡过程中TOC、DOC的变化和膜上物质颗粒度分布的变化看,从第 2~5d,有机物质迅速溶出,DOC、TOC的溶出速率相当,而且此时粒径分布的结果也显示,表征颗粒度大小的二次平均直径(MDv)从58.38µm下降到4.64µm,说明水解酸化液中不溶性颗粒态物质颗粒度减小.由此可知,该阶段水解酸化液TOC浓度的增加主要源于易水解颗粒物水解过程不断产生的溶解性水解产物.第 5d之后,膜上物质二次平均直径(MDv)增大,最终稳定在 8.97~10.68µm范围,且TOC和DOC的溶出速率大大降低,DOC溶出速率小于 TOC.可见第二阶段中,难水解颗粒物的缓慢水解开始占据主导作用,水解产物的溶出速率大大降低,DOC溶出速率小于 TOC.可见第二阶段中,难水解颗粒物的缓慢水解开始占据主导作用,水解酸化液中不溶性颗粒比例增加,水解酸化液TOC浓度的增加主要来自这部分不溶性颗粒的贡献.
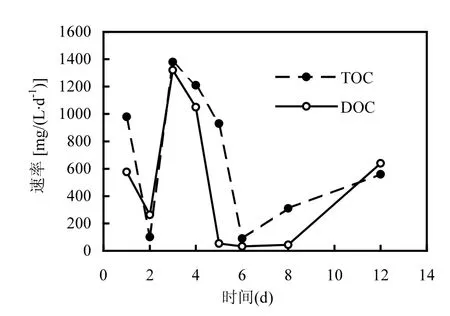
图5 TOC和DOC的溶出速率Fig.5 Dissolution rate of TOC and DOC
可用Contois模型来模拟(式1)[30-31]TOC溶出规律,Contois模型是基于颗粒有机物水解过程3阶段中有机物的溶解为水解限速步骤[32], Vavilin[33-35]认为该模型能够较好地模拟有机垃圾厌氧水解过程.

式中:Xs是溶解性有机物的浓度,mg/L;XH是未水解的颗粒态有机物浓度,mg/L;KH为水解常数,d-1;Kx为饱和水解常数,无量纲.
XH=XT-Xs,其中,XT表示总有机物浓度,mg/L.
式(1)可以变换为式(2):
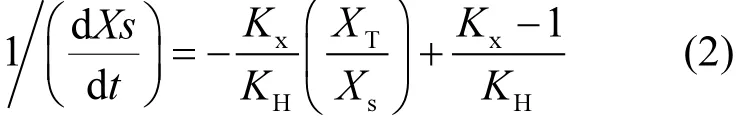
即溶解性有机物降解速率倒数和总有机物浓度与溶解性有机物浓度的比值呈线性关系.式2拟合了水解过程前5d的TOC和DOC实验数据,具有较好的拟合精度(R2=0.9032),拟合确定KH=1.25×103d-1.而 5d之后的水解过程无法用Contois模型模拟得出较好的线性关系,这是由于5d之后,蔬菜类废物水解过程进入后期,较难水解颗粒物的水解起主导作用,其水解过程复杂且缓慢.单独用 Contois模型不能较好模拟蔬菜类废物后期水解过程,有待进一步的探索.
从TOC的变化和DOM的分子量分布可知,水解酸化液TOC的溶出效率在浸泡的前5d最高.浸泡第5d的TOC值为浸泡第12d的84%,第5d时蔬菜类废物的TS降解率达65%,而浸泡12d后,TS降解率也仅为78%.水解第1d产生的分子量在 1.6×109~1.9×109Da范围的溶解性大分子有机物,到第 5d已经全部降解成分子量在5×104~4×106Da范围的DOM;第5d过后,处在该范围的 DOM中极少一部分开始缓慢的向两侧衍化,分子量分布情况并未发生较大变化.由此可见, DOM分子量分布结构变化也主要集中在水解过程的前 5d.因此,针对蔬菜类废物厌氧水解过程的特点,可以考虑缩短蔬菜类废物水解浸泡时间到 5d,以提高蔬菜类废物中有机质的溶出速率.
3 结论
3.1 蔬菜类废物两相厌氧消化工艺的水解过程,按照水解产物形态的不同可分成两阶段.水解反应初期(前5d),易水解颗粒物快速水解,水解产物迅速溶出,且以溶解态物质为主;水解反应后期(5d以后),难水解颗粒物缓慢水解起主导作用,水解速率降低,且水解产物中不溶性颗粒比例增加.
3.2 蔬菜类废物水解反应初期(前5d),颗粒态物质的二次平均直径从 58.38µm 迅速减小到4.64µm,水解酸化液中DOC/TOC比值呈增加趋势,第4d达到最大值85%;水解反应后期,颗粒态物质二次平均直径开始有增长趋势,最后稳定在8.97~10.68µm范围.水解液中DOC/TOC比值开始下降,最后稳定在 67%~72%范围.水解反应初期水解过程可用 Contois模型模拟,证实蔬菜类废物水解反应初期水解过程 3阶段中有机物的溶解是水解过程的限速步骤.
3.3 水解进行到第5d,产生的TOC浓度占整个水解的 84%.水解产物中大分子溶解性有机物(1.6×109~1.9×109Da)的降解主要集中在水解反应初期(前 5d),至第 5d已全部降解成分子量在5×104~4×106Da范围的DOM.表明蔬菜类废物的水解反应时间可缩短至5d,以减小水解反应器容积,同时提高向甲烷化反应器提供溶解性有机物的效率.
[1] 黄鼎曦,陆文静,王洪涛.农业蔬菜废物处理方法研究进展和探讨 [J]. 环境污染治理技术与设备, 2002,3(11):38-42.
[2] Marquez M A, Dianez F, Camacho F. The use of vegetable subproducts from greenhouses (VSG) for animal feed in the Poniente region of Almeria [J]. Renewable Agriculture and Food Systems, 2010,26(1);4–12.
[3] Mata-Alvarez J, Mace S, Llabres P. Anaerobic digestion of organic solid wastes. An overview of research achievements and perspectives [J]. Bioresource Technology, 2000,74(1):3-16.
[4] Frenkel V S, Cummings G, Tang W Z, et al. Food-processing wastes [J]. Water Environ. Res., 2012,84(10):1485-1501.
[5] Gunaseelan V N. Anaerobic digestion of biomass for methane production: A review [J]. Biomass and Bioenergy, 1997,13(1/2): 83-114.
[6] Bouallagui H, Torrijos A, Godon J J, et al. Two-phases anaerobic digestion of fruit and vegetable wastes: bioreactors performance [J]. Biochemical Engineering Journal, 2004,21(2):193-197.
[7] Pavan P, Battistoni P, Cecchi F, et al. Two-phase anaerobic digestion of source sorted OFMSW (organic fraction of municipal solid waste): performance and kinetic study [J]. Water Sci. Technol., 2000,41(3):111-118.
[8] Mohan S, Bindhu B K. Effect of phase separation on anaerobic digestion of kitchen waste [J]. Journal of Environmental Engineering and Science, 2008,7(2):91-103.
[9] Demirel B, Yenigun O. Two-phase anaerobic digestion processes: a review [J]. Journal of Chemical Technology and Biotechnology, 2002,77(7):743-755.
[10] Jiang Y, Heaven S, Banks C J. Strategies for stable anaerobic digestion of vegetable waste [J]. Renew Energy, 2012,44:206-214.
[11] Raynal J, Delgenes J P, Moletta R. Two-phase anaerobic digestion of solid wastes by a multiple liquefaction reactors process [J]. Bioresource Technology, 1998,65(1/2):97-103.
[12] Khalid A, Arshad M, Anjum M, et al. The anaerobic digestion of solid organic waste [J]. Waste Manage, 2011,31(8):1737-1744.
[13] Lata K, Rajeshwari K V, Pant D C, et al. Volatile fatty acid production during anaerobic mesophilic digestion of tea and vegetable market wastes [J]. World J. Microbiol. Biotechnol., 2002, 18(6):589-592.
[14] Zhu M, LÜ F, Hao L P, et al. Regulating the hydrolysis of organic wastes by micro-aeration and effluent recirculation [J]. Waste Manage, 2009,29(7):2042-2050.
[15] Palmowski L M, Muller J A. Influence of the size reduction of organic waste on their anaerobic digestion [J]. Water Sci. Technol., 2000,41(3):155-162.
[16] Palmowski L M, Muller J A. Anaerobic degradation of organic materials - significance of the substrate surface area [J]. Water Sci. Technol., 2003,47(12):231-238.
[17] Dimock R, Morgenroth E. The influence of particle size on microbial hydrolysis of protein particles in activated sludge [J]. Water Research, 2006,40(10):2064-2074.
[18] Batstone D J, Keller J, Steyer J P. A review of ADM1extensions, applications, and analysis: 2002-2005 [J]. Water Sci. Technol., 2006,54(4):1-10.
[19] Martin A, Borja R, Banks C J. Kinetic-model for substrate utilization and methane production during the anaerobic-digestion of olive mill waste-water and condensation water waste [J]. Journal of Chemical Technology and Biotechnology, 1994,60(1):7-16.
[20] Sanders W T M, Geerink M, Zeeman G, et al. Anaerobic hydrolysis kinetics of particulate substrates [J]. Water Sci. Technol., 2000,41(3):17-24.
[21] Wen Z Y, Liao W, Chen S L. Hydrolysis of animal manure lignocellulosics for reducing sugar production [J]. Bioresource Technology, 2004,91(1):31-39.
[22] Vavilin V A, Fernandez B, Palatsi J, et al. Hydrolysis kinetics in anaerobic degradation of particulate organic material: An overview [J]. Waste Manage, 2008,28(6):939-951.
[23] Vavilin V A, Lokshina L Y, Flotats X, et al. Anaerobic digestion of solid material: Multidimensional modeling of continuous-flow reactor with non-uniform influent concentration distributions [J]. Biotechnology and Bioengineering, 2007,97(2):354-366.
[24] Jeyaseelan S. A simple mathematical model for anaerobic digestion process [J]. Water Sci Technol, 1997,35(8):185-191.
[25] Mata-alvarez J, Mace S, Llabres P. Anaerobic digestion of organic solid wastes. An overview of research achievements and perspectives [J]. Bioresource Technology, 2000,74(1):3-16.
[26] 何品晶,潘修疆,吕 凡,等.pH值对有机垃圾厌氧水解和酸化效率的影响 [J]. 中国环境科学, 2006,26(1):57-61.
[27] Okutman D, Ovez S, Orhon D. Hydrolysis of settleable substrate in domestic sewage [J]. Biotechnology Letters, 2001,23(23): 1907-1914.
[28] Zhu M, Lü F, Hao L P, He P J, et al. Regulating the hydrolysis of organic wastes by micro-aeration and effluent recirculation [J]. Waste Management, 2009,29(7):2042–2050.
[29] Lü F, He P J, Hao L P, et al. Impact of recycled effluent on the hydrolysis during anaerobic digestion of vegetable and flower waste [J]. Water Science and Technology, 2008,58(8):1637-1643.
[30] 刘 晓,王 伟,胡 颂.厌氧消化过程中颗粒有机物水解动力学研究进展 [J]. 环境卫生工程, 2009,17(6):23-26.
[31] Mairet F, Bernard O, Ras M, et al. Modeling anaerobic digestion of microalgae using ADM1 [J]. Bioresource Technology, 2011, 102(13):6823-6829.
[32] Alqahtani R T, Nelson M I, Worthy A L. A fundamental analysis of continuous flow bioreactor models governed by Contois kinetics. IV. Recycle around the whole reactor cascade [J]. Chemical Engineering Journal, 2013,218:99-107.
[33] Vavilin V A, Rytov S V, Lokshina L Y. A description of hydrolysis kinetics in anaerobic degradation of particulate organic matter [J]. Bioresource Technology, 1996,56(2/3):229-237.
[34] Vavilin V A. Anaerobic degradation of organic waste: An experience in mathematical modeling [J]. Microbiology, 2010, 79(3):334-341.
[35] Valentini A, Garuti G, Rozzi A, et al. Anaerobic degradation kinetics of particulate organic matter: A new approach [J]. Water Sci. Technol., 1997,36(6/7):239-246.
Particle hydrolysis during the two-phase anaerobic digestion of vegetable waste.
LÜ Fan1,2, CAI Tao1, ZHU Min1, HE Pin-jing1,2*
(1.Institute of Waste Treatment and Reclamation, Tongji University, Shanghai 200092, China;2.Centre for the Technology Research and Training on Household Waste in Small Towns and Rural Area, Ministry of Housing and Urban-Rural Development, Shanghai 200092, China), China Environmental Science, 2014,34(10):2610~2616
During the two-phase anaerobic digestion process of vegetable waste, changes of hydrolytic acidification liquid’s physical-chemical properties were investigated. The relationship among dissolution of total organic carbon (TOC), dissolved organic carbon (DOC) and particulate degradation was discussed. The mechanism of particle hydrolysis acidification was assessed by combining the trend of TOC, DOC, particle size distribution and molecular weight evolution. The experiment results showed that, the hydrolysis process of vegetable waste could be divided into two stages. In the first five days, particulates with high degree of hydrolysis began to hydrolyze quickly. The TOC value rose rapidly, reaching the maximum of 4920mg/L in the fifth day. The quadratic mean diameter of particulates generated from hydrolysis dropped from 58.38 µm in the first day to 4.64 µm in the fifth day. Furthermore, organic matter dissolved rapidly, with a maximum of 85% DOC/TOC ratio. This process could be simulated by Contois hydrolysis model. After the fifth day, the slow hydrolysis of difficult recalcitrantly-hydrolyzed particulate played a dominant role. The quadratic mean diameter of particulates began to increase gradually then stabilized in the range of 8.97~10.68 µm. The dissolution rate of TOC and DOC gradually decreased. DOC dissolution rate was less than the TOC dissolution rate. The distribution diagram of dissolved organic matter (DOM) showed that the degradation of macromolecule DOM mainly concentrated in the first 5days. All of the macromolecule DOM with molecular weight between 1.6×109~1.9×109Da degraded to DOM between 5×104~4×106Da. The distribution of DOM changed a little after the 5th day. It was recommended that hydrolysis time could be shortened to 5 days during a two-phase anaerobic digestion of vegetable waste.
t:vegetable waste;two-phase anaerobic digestion;molecular weight;particulate;degradation
X705
:A
:1000-6923(2014)10-2610-07
吕 凡(1979-),女,福建漳州人,副研究员,博士,主要从事固体废物处理处置与资源化研究.发表论文100篇.
2013-12-01
国家“973”项目(2012CB719801);国家自然科学基金资助项目(21177096;51178327)
* 责任作者, 教授, solidwaste@tongji. edu.cn
