南海红树林内生真菌ZH-3代谢产物研究
2014-05-10杨建香邱声祥佘志刚林永成
杨建香,邱声祥,佘志刚,林永成
( 1.中国科学院华南植物园植物资源保护与可持续利用重点实验室,广东 广州 510650;2. 桂林师范高等专科学校,广西 桂林 541001;3. 中山大学化学与化学工程学院,广东 广州 510275)
研究与开发
南海红树林内生真菌ZH-3代谢产物研究
杨建香1,2,邱声祥1,佘志刚3,林永成3
( 1.中国科学院华南植物园植物资源保护与可持续利用重点实验室,广东 广州 510650;2. 桂林师范高等专科学校,广西 桂林 541001;3. 中山大学化学与化学工程学院,广东 广州 510275)
研究南海红树林内生真菌ZH-3的代谢产物。采用反复硅胶柱色谱法、Sephadex LH-20凝胶色谱法等进行分离纯化,并通过理化常数测定和光谱分析鉴定其化学结构。从南海红树林内生真菌ZH-3的菌体中分离得到4个代谢产物,经波谱解析,分别为2-(3-chloro-2,6-dihydroxy-4-methylbenzoyl)-5-hydroxy-3-methoxybenzoate.(1),3'-dihydroxy-5,5'-dimethyldiphenyl ether(2),7,8-二甲基苯并[g]蝶啶-2,4(1H,3H)-二酮(3),5-o-methylbostrycoidin (4)。初步药理活性显示化合物1对人体肝癌细胞hepG2抑制的IC50值为25μg·mL-1。所有化合物均首次从南海红树林内生真菌ZH-3中分离得到。
红树林;内生真菌;代谢产物
由于海洋环境的特殊性, 海洋微生物以其特有的代谢方式, 产生出结构新颖、 具有多种生理活性的化合物, 成为近年来研究的热点[1-5]。 红树林是热带和亚热带沿海地区特有的植物群落 ,一般生长在海岸及河口潮间带泥地里 ,具有十分独特的生理和生态[6]。红树林是海洋微生物的良好栖息地 ,大部分海洋微生物都可在红树林中找到, 但国内外对红树林微生物特别是内生真菌的代谢研究报道极少。本文对南海红树林内生真菌ZH-3代谢产物进行研究,从菌体中分离得到4个化合物:2-(3-chloro-2,6-dihydroxy-4-methylbenzoyl)-5-hydroxy-3-methoxyben zoate.(1),3,3'-dihydroxy-5,5'-dimethyldiphenyl ether (2),7,8-二甲基苯并[g]蝶啶-2,4(1H,3H)-二酮(3),5-o-methylbostrycoidin (4),通过MS、NMR等波谱分析方法确定它们的结构(图1)。初步药理活性显示化合物1对人体肝癌细胞hepG2抑制的IC50值为25μg·mL-1。
1 实验部分
1.1仪器和试剂
INOVA-500NB超导核磁共振谱仪和INOVA-300NB核磁共振仪;VGZAB-HS双聚焦质谱仪,Thermo DSQ电子轰击电离质谱仪,Thermo MAT95XP高分辨质谱仪;X-4数字显示显微熔点测定仪。
所用试剂均为化学纯,溶剂经重蒸后使用。柱层析硅胶为0.048~0.075mm硅胶,硅胶H, 薄层硅胶GF254。
1.2菌种培养
红树林内生真菌ZH-3采自广东省珠海市,经鉴定为拟茎点霉菌(Phomopsis sp.),保存于中山大学化学与化学工程学院。发酵培养基为葡萄糖10g·L-1,蛋白胨2g·L-1,酵母膏1g·L-1,粗海盐2g·L-1,pH7.0。650mL三角瓶内装培养基280mL,1.25×105Pa 灭菌25 min后接种120L,在25℃静置培养30d。分别收集发酵液和菌体。
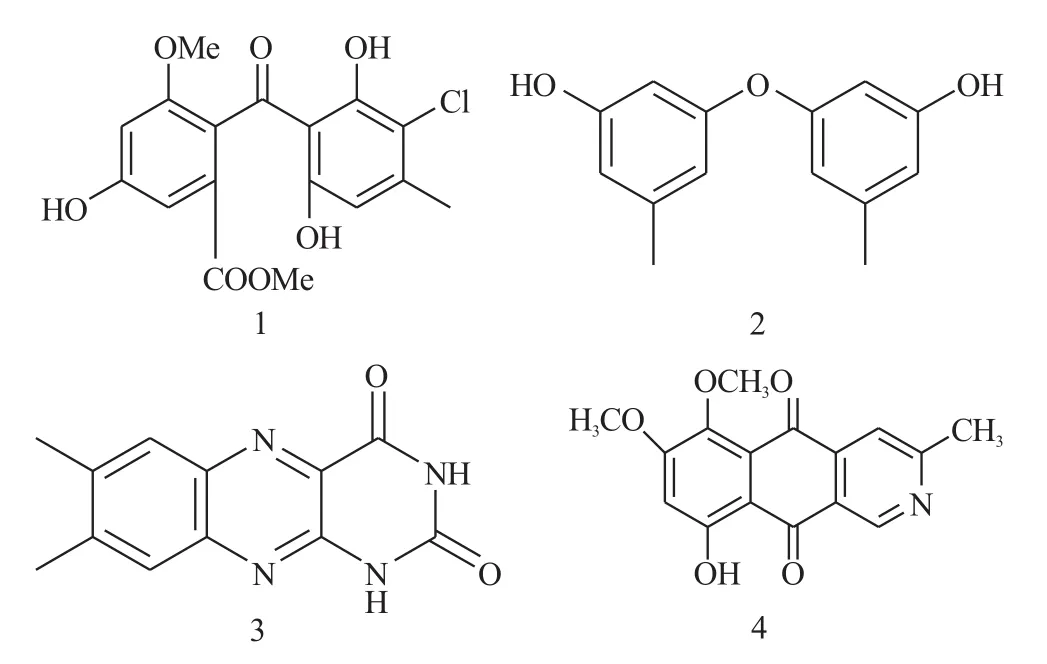
图1 化合物1~4的结构图Fig.1 The structures of compounds 1~4
1.3提取与分离
120L发酵物过滤得菌体和发酵液,发酵液浓缩后用乙酸乙酯充分萃取,菌体用甲醇多次浸泡。提取浓缩物分别以体积比1∶2拌硅胶(0.048~0.075mm)进行柱层析,以石油醚/乙酸乙酯/甲醇进行梯度加压洗脱。收集各组分再经反复柱层析,制备薄层层析,重结晶等方法进行纯化。从菌体粗提物(约15g)分离得到化合物1(15mg),2(10mg),3(10mg),4(12mg)。
1.4细胞毒活性实验
采用MTT法[7]测定了化合物1对人体肝癌细胞hepG2细胞毒的活性。
1.5化合物的实验数据
化合物1:淡黄色针状晶体。1H NMR(500 MHz,CD3OD):6.96(d,1H,J=2.8),6.66(d,1H,J=2.8),6.22(s,1H),3.71(s,CH3),3.69(s,CH3),2.30(s,CH3)。13C NMR (125MHz,CD3OD):202.1(C),168.0(C),160.6(C),160.0(C),159.1(C),158.8(C),146.2(C),130.0(C),127.8(C),112.7(C),111.9(C),109.8(CH),109.0(CH),104.4(CH),56.7(CH3),52.6(CH3),21.1(CH3)。EIMS:366 [M+] for C17H15O7Cl。
化合物2:褐色固体,易溶于常用溶剂。1HNMR (300MHz,CDCl3) δ:7.36(OH,brs),6.40(2H,d,1.5),6.29(1H,t,1.5),2.26(3H,s)。13CNMR (300MHz,CDCl3) δ:158.1(C),156.6(C),141.2(C),112.4(CH),111.5(CH),103.7(CH),21.8(CH3)。EIMS m/z [M+]:230,C14H14O3。
化合物3:黄色粉末,mp:298~300℃,1HNMR (DMSO-d6,500MHz):δ:11.69(s,1H),11.86(s,1H),7.91(s,1H),7.70(s,1H),2.46(s,3H),2.48(s,3H);13CNMR(DMSO-d6,125MHz) δ:150.0(C),160.6(C),130.6(C),138.4(C),128.7(CH),144.6(C),138.9(C),125.8(CH),141.6 (C),146.4 (C),19.5 (CH3),20.2 (CH3)。
化合物4: 红色粉末状固体,mp:209~210℃;EIMS:m/z 299;1HNMR (CDCl3,300 MHz) δ:9.42(1H,s),2.77(3H,s),7.57(1H,s),3.99(3H,s),3.93(3H,s),6.78 (1H,s),13.53(1H,s)。13C NMR (CDCl3,75MHz):δ 188.2(C),177.4(C),164.4 (C), 157.9(C),155.2(C),149.3(CH),148.7(C),138.2(C),126.2(C),118.0(CH),116.1(C),111.5(C),107.9(CH),57.6(CH3),56.8(CH3),25.3 (CH3)。
2 结果与讨论
化合物1:淡黄色针状晶体,在常用溶剂中都可溶。EIMS显示分子离子峰为366,并有氯原子同位素峰,显示化合物中含有1个氯原子,分子式为C17H15ClO7。1HNMR显示化合物有3个苯环氢,2个甲氧基,1个甲基。13CNMR 和 DEPT除给出以上信息外还给出1个酮羰基,1个羧羰基,2个苯环。将化合物数据与文献[8]对照后,得到化合物的结构为2-(3-chloro-2,6-dihydroxy-4-methylbenzoyl)-5-hydroxy-3-methoxybenzoate。
化合物2:褐色固体,EIMS显示化合物的分子量为230,结合核磁数据得到化合物的分子式为C14H14O3,13C NMR显示有7个碳的信号,1个苯环和1个苯环上的甲基,所以分子内存在对称结构,1HNMR与碳谱得到的结论相同,同时显示羟基信号。与文献[9]对照后确定化合物的结构为3,3'-Dihydroxy-5,5'-dimethyldiphenylether。
化合物3:EIMS显示分子量为243,结合核磁数据,推断出该化合物的分子式为:C12H10N4O2,13CNMR和DEPT谱显示有12个碳,其中包括2个酰亚胺羰基(δ160.6×10-6,150.0×10-6),6个芳香季碳(δ 146.4×10-6,144.6×10-6,141.6×10-6,138.9×10-6,138.4×10-6,130.6×10-6),2个次甲基碳(δ128.7×10-6,125.8×10-6), 2个甲基碳(δ20.2×10-6,19.5×10-6),1H NMR谱显示2个活泼的酰亚胺质子δ11.86 (1H,s),δ11.69(1H,s),2个芳香质子δ7.91(1H,s),7.70×10-6(1H,s),2个甲基质子δ2.48(3H,s),δ2.46(3H,s)。通过这些信息,进一步与文献[10]对照,确定该化合物为7,8-二甲基苯并[g]蝶啶-2,4(1H,3H)-二酮。
化合物4:黄色粉末状固体,1HNMR谱图显示有7个单峰,1个螯合的羟基峰(δ 13.53×10-6),3个孤立的芳香质子峰(δ9.42×10-6,7.57×10-6,6.78×10-6),2个连氧的甲基峰(δ3.93×10-6,3.99×10-6),1个甲基(δ2.77×10-6)。13CNMR和DEPT谱图显示有16个碳,其中3个CH3,3个CH,10个季碳。EIMS显示分子离子峰m/z为299。结合上面的核磁谱图,可以推出该化合物的分子式为C16H13NO5,不饱和度为11。根据所得核磁数据与文献[11]对照,确定该化合物为已知化合物5-o-methylbostrycOidin。
[1] YANG Rui yun, LI Chun yuan, LIN Yong cheng, et al. Lactones from a brown alga endophytic fungus (No. ZZF36) from the South China Sea and their antim icrobial activities[J]. Bioorg. Med Chem., 2006(16):4205-4208.
[2] SHAO Chang lun, SHE Zhi gang, GUO Zhi yong,et al.1H and13CNMR assignments for two anthraquinones and two xanthones from the mangrove fungus (ZSUH-36) [J] . Magn Reson Chem., 2007, 45(5):434-438.
[3] XIA Xue kui, HUANG Hua rong, SHE Zhi gang,et al.1H and13CNMR assignments for five anthraquinones from the mangrove endophytic fungus Haloro sellinia sp. (No. 1403) [J]. Magn Reson Chem., 2007, 45(11):1006-1009.
[4] GUO Zhi yong, SHAO Chang lun, SHE Zhi gang, et al.1H and13CNMR assignments for two oxaphenalenones bacillospor in C and D from the mangrove endophyt ic fungus SBE-14[J] . Magn Reson Chem., 2007,45(5): 439-441.
[5] 尹文清,张青松,陈柳生,等.海洋真菌 K26 号代谢产物的研究[J].广西师范大学学报:自然科学版,2004,22(3):54-57.
[6] 林永成.海洋微生物及其代谢产物[M].北京:化学工业出版社,2003,1-3.
[7] Mosmann T. Rapid colorimetric assay for cellular growth and survival application to proliferation and cytotoxicity assays [J]. Journal of immunologicalmethods, 1983, 65(1/2): 55-63.
[8] Inamori Y, Kato Y, Kubo M, et al. Studies on metabolites produced by Aspergillus terreus var. aureus. I. Chemical structures and antimicrobial activities of metabolites isolated from culture broth[J]. Chem. Pharm. Bull., 1983, 31(12): 4543-4548.
[9] Ballantine JA, Hassal CH, Jones BD. Some phenolic metabolites of mutant strains of Aspergillus rugulosus[J]. Phytochemistry, 1968(7): 1529-1534.
[10] Ding Zhang-Gui,Zhao Jiang-Yuan,Yang Pei-Wen,et al.1H and13C NMR assignments of eight nitrogen containing compounds from Nocardia albasp.nov (YIM 30243T) [J]. Magn. Reson. Chem.,2009(47): 366-370.
[11] Steyn, Pieter S, Wessels, Philippus L., Marasas, Walter F. O. Pigments from Fusarium moniliforme Sheldon.Structure and carbon-13 nuclear magnetic resonance assignments of an azaanthraquinone and three naphthoquinones[J]. Tetrahedron, 1979, 35(12):44-47.
Metabolites of Mangrove Endophytic Fungus ZH-3 from South China Sea
YANG Jian-xiang1,2, QIU Sheng-xiang1, SHE Zhi-gang3, LIN Yong-cheng3
(1. Key Laboratory of Plant Resources Conservation and Sustainable Utilization , South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 2. Department of Chemistry and Engineering, Guilin Normal College, Guilin 541002, China; 3. School of Chemistry and Chemical Engineering, Sun Yat-sen University, Guangzhou 510275, China)
Secondary metabolites of mangrove endophytic fungus No. ZH-3 from South China sea were studied. The compounds were isolated by column chromatography and identified on the basic of physic-chemical constants and spectral analysis. Four metabolites were obtained and elucidated as 2-(3-chloro-2,6-dihydroxy-4-methylbenzoyl)-5-hydroxy-3-methoxybenzoate. (1),3,3’-dihydroxy-5,5’-dimethyldiphenylether(2), 7,8-dimethylbenzo[g]pteridine-2,4(1H,3H)-dione (3), 5-o-methylbostrycoidin (4). In the preliminary bioassay, 1 show inhibittory activity on the hepG2 cell line with IC50values of 25μg/mL. The four metabolites were obtained from endophytic fungus No. ZH-3 for the frst time.
mangrove; endophytic fungus; metabolites
O 629
A
1671-9905(2014)02-0001-03
国家自然科学基金资助项目(81373293),国家863计划和支撑计划项目(201473948),广西教育厅科研项目(201204LX497)
杨建香(1979-),女,汉族,博士,副教授,主要从事天然产物化学研究。电话:020-37082553,E-mail: 791011@126.com
2013-11-22
