食品中有害物赖丙氨酸的检测方法综述1
2014-05-10罗序英赵燕涂勇刚王俊杰李建科陈彰毅
罗序英,赵燕,*,涂勇刚,王俊杰,李建科,陈彰毅
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2. 南昌大学 生物质转化教育部工程研究中心,江西 南昌 330047;3. 江西农业大学食品科学与工程学院,江西 南昌 330045)
1964年,Bohak[1]用氨基酸分析仪在碱(pH13)处理后的牛胰脏核糖核酸酶 A(RnaseA)中检出了一种新的氨基酸——赖丙氨酸( lysinoalanine,LAL )。随后,学者们广泛地从酪蛋白酸钙(钠)、婴幼儿配方奶粉、巴氏杀菌乳、面条、烤燕麦、玉米片、煮蛋白、皮蛋、火腿、鸡腿肉以及酵母、大豆分离蛋白、蛋清粉等食品或食品原料中也检出了LAL[2-11]。富含蛋白质的食品或食品原料在高温或碱处理时易产生LAL,其实,即使是在室温条件下,也会慢慢形成LAL[6,11]。LAL的产生伴随着食品中必须氨基酸的减少和外消旋化,使含蛋白质的食品营养价值降低[3,12-15];它甚至还能螯合金属酶,特异地引发小鼠肾钙质沉着、肾细胞巨大及肾小管细胞坏死[16-18]。在很多婴儿配方食品中,LAL已经开始作为一个质量指标[9,10],以避免对婴儿造成伤害。
国外虽已建立了LAL的氨基酸分析仪法[19]、气相色谱法[6,20]、液相色谱法[4,21]及色谱-质谱联用法[5,22]等,但LAL的标准分析方法至今仍未确定;国内对LAL的研究几乎是空白。本文综述了目前已报道的各种LAL的检测方法,并总结各自的优缺点,旨在为食品中LAL的检测方法提供参考和指导,促进LAL的深入研究,确保食品安全。
1 赖丙氨酸的性质
LAL,即Nε-(DL-2-氨基-2羧乙基)-DL-赖氨酸,有2个光学活性中心,因而有两对旋光异构体,分别为LL-、LD-和DL-、DD-LAL。由于部分赖丙氨酸的形成与氨基酸的外消旋化有关,而形成D-赖氨酸的条件苛刻、时间较长,因此LL-和LD-型比较多见[23]。且用钠光灯作光源检测LL-LAL和LD-LAL的旋光度分别为 100.7°和-14.8°[24]。LAL的稳定性比较差,如在乙醇中不稳定;水溶液易受热分解,60℃就有部分LAL分解,约174℃时LL-、DD-LAL完全分解,约192℃时,LD-、DL-LAL完全分解;在酸水解过程中LAL会迅速消旋化并发生部分分解[23]。
2 样品前处理
食品中的LAL多与蛋白质结合,因此在分析食品样品中的LAL时都要先经过水解,使LAL得到释放。食品中蛋白质的水解方法有酶水解法、微波辅助水解法、碱水解法和酸水解法,前三种方法对某些氨基酸而言存在着水解不彻底、氨基酸水解回收率偏低或者破坏某些氨基酸等缺点;而酸水解尤其是盐酸水解法是一种采用较多的水解方法,它迅速而彻底[25]。因此,一般用盐酸水解法来对样品进行前处理[26],具体操作为:向样品中加入适量的6mol/L的盐酸(以1g蛋白质加200mL盐酸的比例为佳[4]),并滴入几滴苯酚作保护剂,在108~110℃水解20~24h,LAL即可得到良好释放。在分析富含脂肪的样品时,为避免脂肪干扰LAL的测定,通常需要先对样品进行脱脂处理[5]。
3 检测方法
20世纪 60年代初氨基酸分析仪的问世,实现了氨基酸分析的自动化,并使氨基酸分析进入了一个崭新的阶段,也促进了LAL的发现[1]和研究。
20世纪70至80年代,国外学者开始致力于LAL检测方法的研究,如薄层层析(TLC)法、氨基酸分析仪法和两步衍生化的气相色谱(GC)法以及液相色谱(HPLC)法等。除TLC外,其他方法都逐渐地得到发展和运用。用TLC法检测食品中的LAL时,由于仪器的局限性,样品中的其它茚三酮阳性化合物会干扰测定结果,特别在测定含少量或不定量LAL的样品时,结果偏差更大,所以该方法没有得到深入研究和广泛使用,目前也基本不用此法测定LAL。当时,两步衍生化的GC法测定LAL已逐渐成为一种仅次于氨基酸分析仪法的常规化检测方法;但是,这种方法存在的诸多弊端限制了它的进一步发展。
20世纪90年代以后至今,检测LAL时用得较多的方法是氨基酸分析仪法、HPLC法和液相色谱-质谱联用(LC-MS)法。此外,LAL一步衍生化的GC法、脉冲-傅里叶变换核磁共振谱仪法(适合检测LAL的非对映异构体)和阴离子交换色谱-积分脉冲安培检测法(HPAEC-IPAD),也具有其各自的优势。以下分别介绍了LAL的氨基酸分析仪、气相色谱、液相色谱及色谱-质谱联用等检测方法。
3.1 氨基酸分析仪法
氨基酸分析仪法是一种用于检测LAL的较好方法,它不但灵敏度高、重复性好,还可以同时测定多种氨基酸。其最大特点是衍生化反应发生在氨基酸与其他物质分离之后,即柱后衍生。因此,分离柱的类型(包括柱长和柱内填料)、洗脱液的类型和温度等的选择非常重要。Slump[19]曾分别选用Bio-Rad Aminex A-4和Beckman M82填充的50cm离子交换柱分离了LAL与其它氨基酸,发现这两种填料的分离效果存在差异,用前者分离时,LAL与甲基赖氨酸(Me-LAL)的两种同分异构体的洗脱时间相同;而后者分离效果略好,只稍微受Me-LAL的一种同分异构体干扰。用氨基酸分析仪检测LAL时,一般以pH5.3浓度0.35mol/L的柠檬酸盐缓冲溶液作洗脱液,约 50℃进行茚三酮柱后衍生化,但是,对于某些成分复杂的样品中 LAL的检测,显色反应控制在 50℃左右会带入某些茚三酮的阳性干扰物,此时要适当提高显色反应的温度[9]。茚三酮柱后衍生的方法是美国官方分析化学师协会(AOAC)分析氨基酸的标准方法,Fritsch等[27]提出用氨基酸分析仪测定LAL时,通过改用邻苯二甲醛柱后衍生并经荧光检测,灵敏度和准确性较茚三酮柱后衍生法明显提高。Chang等[3]为探讨皮蛋腌制过程中氨基酸的变化及其与LAL形成之间的关系,采用氨基酸分析仪法对皮蛋中的氨基酸和形成的LAL进行了定量。Schwarzenbolz等[28]利用氨基酸分析仪测定了几种富含蛋白质的食品在高压处理过程中产生的LAL,并发现LAL的形成量随压力增大而增多。
3.2 气相色谱法
LAL作为一种交联氨基酸,不能直接用GC进行检测,必须经过衍生得到弱极性、低挥发性和良好热稳定性的衍生物后才能用 GC分离测定。LAL的衍生化方法不及普通氨基酸的衍生化方法(包括酯化-酰化反应、烷基化反应、硅烷化反应等)多。
早期,用GC法检测LAL时,一般通过两步(BTFA)衍生法进行柱前衍生化,反应方程式如图1a,第一步利用正丁醇、异丁醇或异丙醇等与LAL发生酯化反应;第二步利用三氟乙酸酐、五氟丙酸酐或七氟丁酸酐等与第一步所得产物进行酰化反应。Hasegawa等[20]分别用正丁醇和三氟乙酸酐作酯化和酰化试剂,并用2%OV-17/1%OV-210固定液的填充柱进行分离,以丁基山嵛酸作内标来定量,检测出碱处理的面筋、大豆球蛋白、溶解酵素和乳白蛋白等样品中的LAL含量。正丁醇和三氟乙酸酐是两步衍生化常用的试剂,但学者们通过改用其它酯化或酰化试剂同样达到了较理想的衍生效果。Buser等[29]改用七氟丁酸酐作酰化试剂,并采用硅烷化高硼硅玻璃柱和氮磷检测器(NPD)分别进行分离和检测,该方法的精密度与离子交换色谱法相近,检出限可低至100µg/g(以蛋白质含量计)。
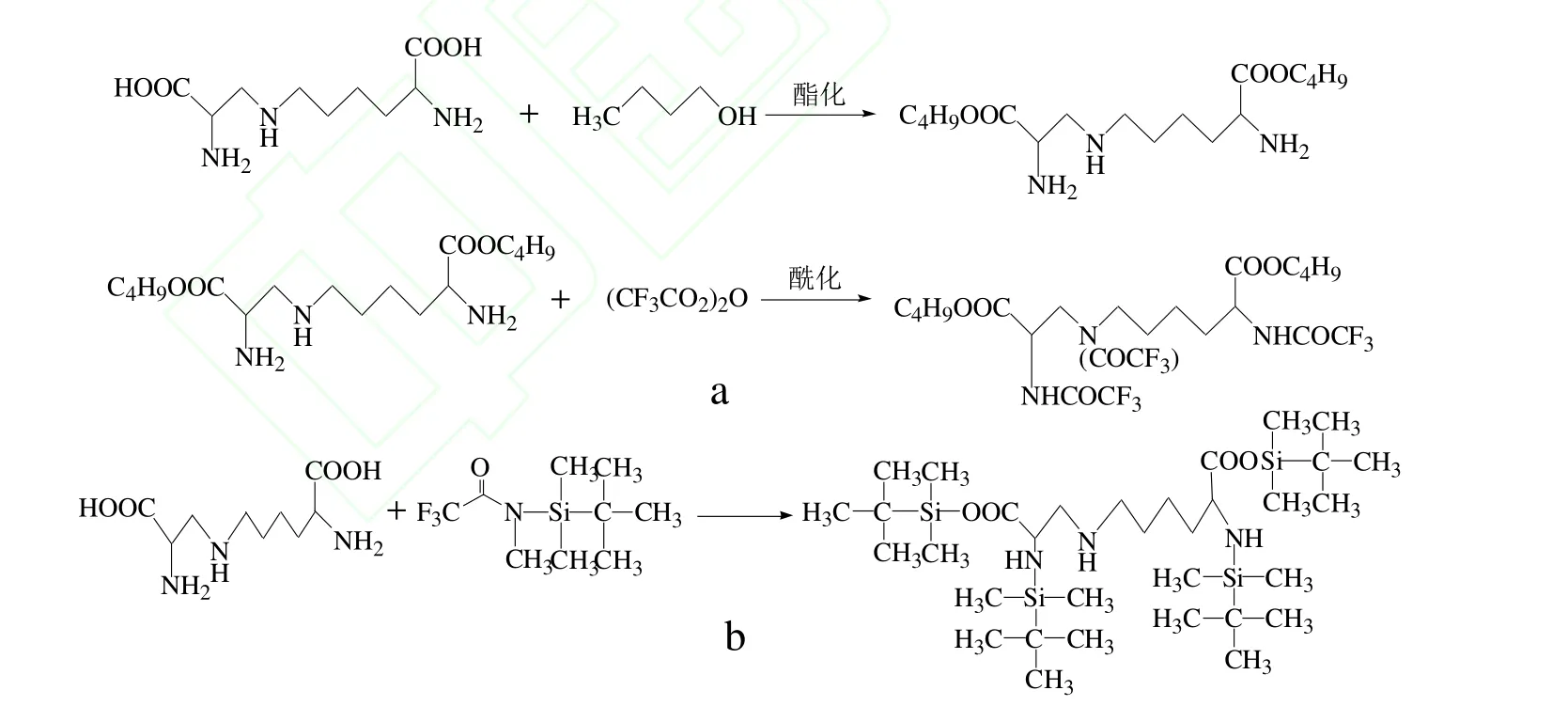
图1 LAL的酯化-酰化(a)和MTBSTFA(b)衍生化反应Fig.1 Derivatization of LAL with BTFA reagent(a)or MTBSTFA(b)
由于两步衍生化法的酰化和酯化反应是在互不相容的介质中进行,第一步结束后需将产物旋转蒸发蒸干,处理较繁杂。近期兴起的另一种衍生化方法是用硅烷化试剂——N-(特丁基二甲基硅烷基)-N-甲基三氟乙酰胺(MTBSTFA)与LAL发生亲核反应进行一步衍生,即MTBSTFA中的Si与LAL上的N、O结合生成tBDMSi-LAL化合物(反应方程式如图1b),然后用GC-FID或GC-NPD等进行检测[30]。Montilla等[6]和Bosch等[31]首次在温和的条件下利用MTBSTFA对LAL进行了衍生,选用2,6-二氨基庚二酸(DPA)作内标,利用GC-FID法对禽蛋、牛奶等制品中的LAL进行了准确定量。该方法样品处理简单,衍生反应条件温和,可避免大量LAL分解,采用毛细管柱分离灵敏度和分离度更高,检测限较低(约50µg/g),回收率较高(约94%),且整个过程不需纯化样品,预处理方便,只需一步衍生化即可进样检测。
两步衍生化的气相色谱法曾被大量用来测定各种食品中的LAL,但是因为其衍生处理繁杂且条件苛刻,易造成LAL的部分分解,该方法未能继续推广。气相色谱法本不是常规氨基酸的常规测定方法,由于一步衍生化的气相色谱法在测定LAL时存在一定的优势,该方法值得继续改进后进一步推广。
3.3 液相色谱法
分析氨基酸所用的高效液相色谱主要是反相高效液相色谱(RP-HPLC)。用此方法分析 LAL的关键和GC法一样,在于衍生试剂的选择。目前主要用5-二甲氨基-1-萘磺酰氯(简称丹磺酰氯,即DNS-Cl)和氯甲酸芴甲酯(FMOC-Cl)。它们都能与一、二级氨基酸反应,为充分反应并使衍生产物单一,衍生试剂必须过量。相应的反应方程式分别如图2a和2b所示。
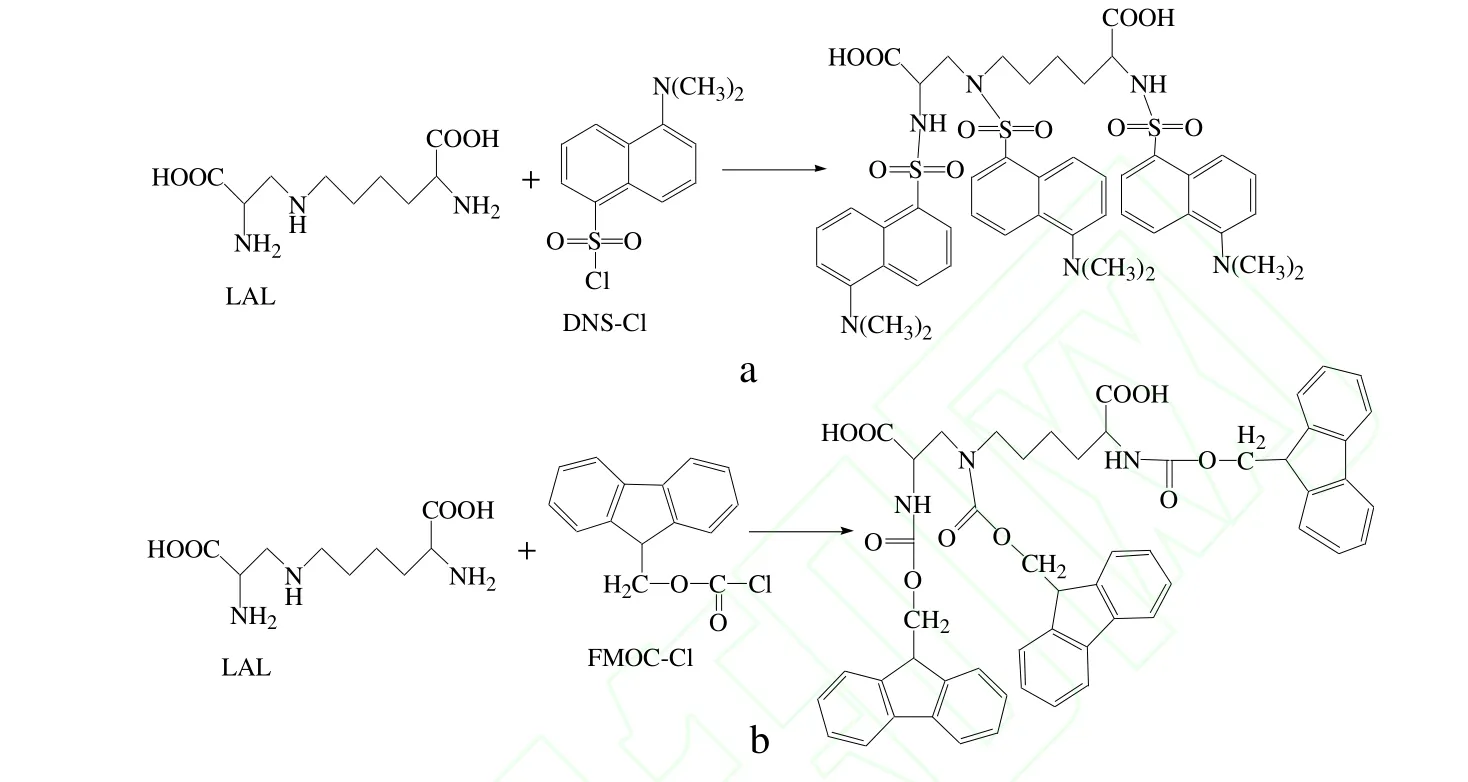
图2 LAL分别与DNS-Cl(a)和FMOC-Cl(b)的衍生化反应Fig.2 Derivatization of LAL with DNS-Cl(a)or FMOC-Cl(b)
Badoud等[32]曾在用DNS-Cl衍生LAL时,以Li2CO3作缓冲溶液,并用甲胺盐酸盐来彻底终止反应,达到了稳定DNS-LAL衍生物和减少了因过量DNS-Cl和DNS-LAL重新反应产生大量DNS-NH2副产物的目的;此外,他们在HPLC分析过程中利用Nε-甲基-赖氨酸作内标来定量,并采用梯度洗脱程序,进而使结果更准确,同时大大缩短了LAL出峰时间。由于存在样品本身性质的差异和方法的局限性,学者们还在继续探索用HPLC检测各种食品中的LAL。Faist等[4]和Al-Saadi等[33,34]在分析UHT乳、巴氏杀菌乳和酪蛋白等样品中的LAL时,通过改变DNS-Cl用量,或采用不同液相柱和不同HPLC的洗脱程序,甚至改用精密度更高的荧光检测器等方式,以达到快速检测、精确分析的目的,尤其Al-Saadi等[34]通过用这种方法测定UHT乳中LAL含量,研究了贮存温度对LAL形成量的影响。
FMOC-Cl是氨基酸 HPLC分析法中的一种常用柱前衍生试剂,可在室温条件下进行衍生化反应。Pellegrino等[21]将FMOC-Cl用于LAL的衍生化,建立了奶制品中LAL的HPLC检测法,该方法变异系数小、灵敏度高、检测限低(约 0.4μg/g)。因为样品中 LAL含量较低,而固相萃取(SPE)技术对微量或痕量目标化合物的提取、分离能力较强,所以该方法在衍生结束后通常需用SPE对相应衍生产物进行浓缩、提取和分离。Cattaneo等[2,9]就是用这种方法测定了几种奶制品中的LAL含量,以此作为产品热损伤程度的指标之一,并对比了在酪蛋白加工成酪蛋白酸钙(钠)过程中形成的LAL量。
DNS-Cl衍生化的HPLC法检测时间虽更短,但衍生副产物较多,对LAL的测定易造成一定的干扰;FMOC-Cl衍生化的HPLC法引入SPE处理,干扰小,重复性较好。
3.4 色谱-质谱联用技术
食品样品成分复杂、LAL含量低,单一的分离检测方法往往难以满足复杂样品分析检测的要求。色谱-质谱联用技术的引入既能发挥色谱法的高分离能力,又能发挥质谱法的高鉴别能力,减少假阳性发生几率。至今为止对食品中LAL的测定主要集中在气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)技术,FMOC-Cl衍生化的LC-MS方法是目前检测食品中LAL的重要手段之一。
GC-MS技术的引入相对GC提高了样品组分的定性能力,但是样品衍生的优缺点与GC法仍是一致的。Hasegawa等[5]在对样品脱脂和除碳水化合物后,用两步衍生法对其衍生化,再用GC-MS测定了小麦制品、奶制品、豆制品和肉制品等样品中的LAL含量。在Montilla等[6]和Bosch[31]建立的一步衍生化的GC-FID法中,也利用了GC-MS所得的特征碎片离子(如m/z 632;m/z387)来对LAL定性。
LC-MS技术用于食品中LAL的检测,灵敏度和准确性比HPLC法更高;由于它可以得到各组分的质量信息来排除样品中其它组分的影响,所以不需要对衍生后的样品进行SPE处理,既简单又节省了样品处理时间。Calabrese等[22]将样品经FMOC-Cl衍生化后,直接利用LC-MS技术,准确地测定了牛奶和奶酪中的LAL。此外,Fenaille等[35]以d4-羧甲基赖氨酸(d4-CML)作内标,并以盐酸正丁醇溶液作衍生试剂,利用LC-MS/MS测定了婴幼儿配方奶、巴氏杀菌乳和UHT乳中LAL的含量。
3.5 其他
其他技术如脉冲-傅里叶变换核磁共振谱仪也曾用于LAL的研究中,Boschin等[36,37]以四甲基硅烷作内标,D2O作溶剂,用脉冲-傅里叶变换核磁共振谱仪测定了合成的LAL中的两种非对映异构体的比例。整个分析过程不需要衍生,处理简单,但其只适于合成的LAL及其标准品的检测,并不适合成分复杂的食品中LAL的分析。近年来,阴离子交换色谱-积分脉冲安培(HPAEC-IPAD)技术也开始运用到LAL的检测中。Rombouts等[38]采用 HPAEC-IPAD法,双柱串接分离和用四元梯度洗脱系统洗脱,检测使用金工作电极和pH参比电极,直接测定了面筋蛋白中的基本氨基酸和LAL的含量,该方法无需衍生,操作简单且重现性好,但也存在重复性差、电极损耗大和费用高等缺点。因此,无论是 LAL分析的核磁共振谱仪法和HPAEC-IPAD技术都尚不及前面几种方法应用广泛,这几种方法固然存在各自的特点(表1)。
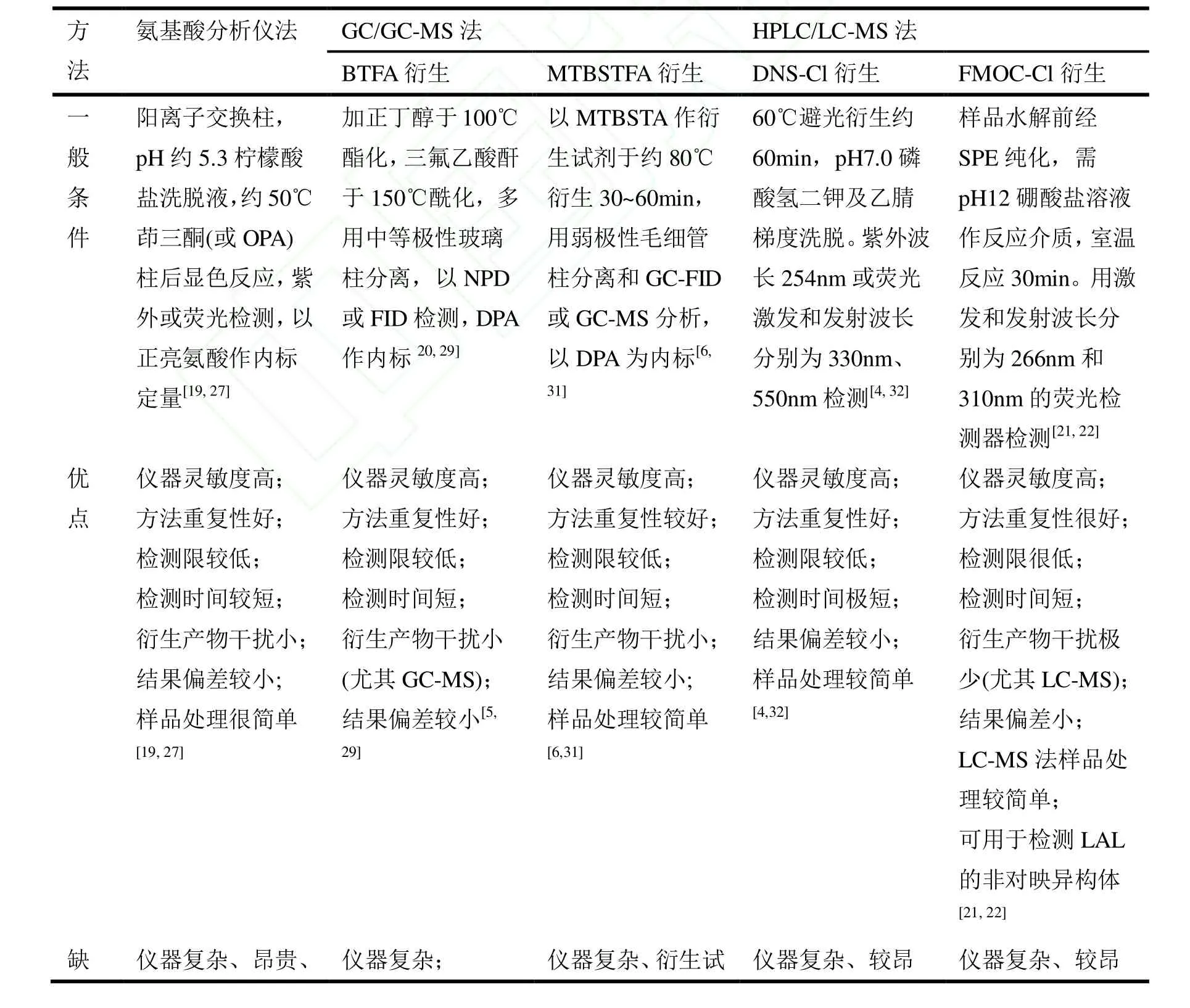
表1 LAL的各种常用检测方法的比较Table.1 The comparison of common detection methods for LAL

点 应用单一;该方法分析条件不易改变,对少于100µg/g的LAL定量不准确[27]样品前期处理复杂、耗时;LAL高温尤其含盐酸时易分解[29,30]剂较贵;衍生试剂及衍生产物的稳定性不太理想,需要严格隔离水分[31]贵;衍生后有DNS-OH、DNS-NH2和其它柱前衍生干扰物干扰检测[32]贵;HPLC法中SPE提取过程复杂、耗时[4]
4 结论与展望
目前,分析LAL的主要方法是氨基酸分析仪法、HPLC和LC-MS法。在开展LAL的理论研究时,通常不仅要测定样品中 LAL含量,也需对其他多种氨基酸定量,这种情况下可选择氨基酸分析仪法;对某些成分复杂且LAL含量低的样品,可能会受水解过程中LAL回收不完全的影响,分析时出现重峰,这些样品可能比较适合用FMOC-Cl衍生化的HPLC法(包括联用SPE或MS技术)分析。另外,MTBSTFA衍生化的GC法,特别是GC-MS法灵敏度和准确性高,且样品衍生处理较HPLC或LC-MS法简单,因此它也是很具潜力的一种检测食品中LAL的方法。但是,任何方法都不是通用的,都有其优缺点和适用范围,正如氨基酸分析仪法定量低含量 LAL时准确性较低,HPLC法样品处理更繁杂,且它与GC法都易受其他分离物的影响。在选择方法时,应充分考虑样品的特征、LAL的特性、仪器的灵敏度、方法的可行性以及成本的高低,结合实际条件,选用合适的方法。针对国内对LAL研究基础薄弱的现状,找到更准确更通用的检测方法,将是我们对LAL研究的重要任务之一。
[1]Bohak Z. Nε-(DL-2-amino-2-carboxyethyl)-L-lysine, A new amino acid formed on alkaline treatment of proteins[J]. Journal of Biological Chemistry, 1964, 239(9): 2878-2887.
[2]Cattaneo S, Masotti F, Pellegrino L.Chemical modifications of casein occurring during industrial manufacturing of milk protein powders[J]. European Food Research and Technology, 2012, 235(2): 315-323.
[3]Chang H M, Tsai C F, Li C F. Changes of amino acid composition and lysinoalanine formation in alkali-pickled duck eggs[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1495-1500.
[4]Faist V, Drusch S, Kiesner C, et al. Determination of lysinoalanine in foods containing milk protein by high-performance chromatography after derivatisation with dansyl chloride[J]. International Dairy Journal,2000, 10(5): 339-346.
[5]Hasegawa K, Mukai K, Gotoh M, et al. Determination of the Lysinoalanine Content in Commercial Foods by Gas Chromatography-selected Ion Monitoring (Food & Nutrition)[J]. Agricultural and Biological Chemistry, 1987, 51(11): 2889-2894.
[6]Montilla A, G Mez-Ruiz J Á, Olano A, et al. A GC-FID method for analysis of Lysinoalanine[J].Molecular Nutrition & Food Research, 2007, 51(4): 415-422.
[7]Pellegrino L, Cattaneo S, Masotti F, et al. Detection of milk powder and caseinates in Halloumi cheese[J]. Journal of Dairy Science, 2010, 93(8): 3453-3460.
[8]Sieber R, Buetikofer U, Kaldas N, et al. Occurrence of lysinoalanine in milk and dairy products[J].Revue Suisse D'agriculture, 2007, 39(6): 297-302.
[9]Cattaneo S, Masotti F, Pellegrino L. Liquid infant formulas: technological tools for limiting heat damage[J]. Journal of Agricultural and Food Chemistry, 2009, 57(22): 10689-10694.
[10]Cattaneo S, Masotti F, Pellegrino L. Effects of overprocessing on heat damage of UHT milk[J].European Food Research and Technology, 2008, 226(5): 1099-1106.
[11]董攀,赵燕,杨有仙,等.食品加工过程中有害物质——赖丙氨酸研究进展[J].食品科学,2011,32(15):312-316.
[12]Friedman M. Origin, Microbiology, Nutrition, and Pharmacology of D-Amino Acids[J]. Chemistry &Biodiversity, 2010, 7(6): 1491-1530.
[13]Sarwar Gilani G, Wu Xiao C, Cockell K A. Impact of Antinutritional Factors in Food Proteins on the Digestibility of Protein and the Bioavailability of Amino Acids and on Protein Quality[J]. British Journal of Nutrition, 2012, 108(S2): S315-S332.
[14]Gilani G S, Cockell K A, Sepehr E. Effects of antinutritional factors on protein digestibility and amino acid availability in foods[J]. Journal of AOAC International, 2005, 88(3): 967-987.
[15]Gilani G S, Sepehr E. Protein digestibility and quality in products containing antinutritional factors are adversely affected by old age in rats[J]. The Journal of Nutrition, 2003, 133(1): 220-225.
[16]Jonker D, Woutersen R, Feron V. Toxicity of mixtures of nephrotoxicants with similar or dissimilar mode of action[J]. Food and Chemical Toxicology, 1996, 34(11): 1075-1082.
[17]Pearce K N, Friedman M. Binding of copper (II)and other metal ions by lysinoalanine and related compounds and its significance for food safety[J]. Journal of Agricultural and Food Chemistry, 1988, 36(4):707-717.
[18]Somoza V, Wenzel E, Wei C, et al. Dose-dependent utilisation of casein-linked lysinoalanine, N(epsilon)-fructoselysine and N (epsilon)-carboxymethyllysine in rats[J]. Molecular Nutrition & Food Research, 2006, 50(9): 833-841.
[19]Slump P. Determination of lysinoalanine with an automatic amino-acid analyzer[J]. Journal of Chromatography A, 1977, 135(2): 502-507.
[20]H ASEGAWA K, OKAMOTO N. Studies on the gas chromatographic analysis of lysinoalanine in alkali-treated food proteins [J]. Agricultural and Biological Chemistry, 1980, 44(3): 649-655
[21]Pellegrino L, Resmini P, De Noni I, et al. Sensitive determination of lysinoalanine for distinguishing natural from imitation Mozzarella cheese[J]. Journal of Dairy Science, 1996, 79(5): 725-734.
[22]Calabrese M G, Mamone G, Caira S, et al. Quantitation of lysinoalanine in dairy products by liquid chromatography-mass spectrometry with selective ion monitoring[J]. Food Chemistry, 2009, 116(3):799-805.
[23]Liardon R, Friedman M, Philippossian G. Racemization kinetics of free and protein-bound lysinoalanine (LAL)in strong acid media. Isomeric composition of bound LAL in processed proteins[J].Journal of Agricultural and Food Chemistry, 1991, 39(3): 531-537.
[24]Tas A, Kleipool R. The stereoisomers of lysinoalanine[J]. Lebensm Wiss-Technol, 1979,9:360-363.
[25]孙秋君,陈晓晔,朱建良.蛋白质降解及其产物氨基酸检测的研究进展[J].食品工业科技,2011,11(32):525-528.
[26]Garcia R, Pyle D, Piazza G, et al. Hydrolysis of animal protein meals for improved utility in non-feed applications[J]. Applied Engineering In Agriculture, 2011, 27(2): 269-275.
[27]Fritsch,R J, Klostermeyer H. Improved method for determination of lysinoalanine in food[J].Zeitschrift Fur Lebensmittel-Untersuchung Und-Forschung .1981, 172(6):101-106.
[28]Schwarzenbolz U, Henle T. Non-enzymatic modifications of proteins under high-pressure treatment[J].High Pressure Research, 2010, 30(4): 458-465.
[29]B Ser W, Erbersdobler H. Determination of lysinoalanine as the heptafluorobutyryl isobutyl ester derivative by gas-liquid chromatography[J]. Journal of Chromatography, 1984, 303(1): 234-237.
[30]Jimenez-Martin E A, Ruiz J, Perez-Palacios T, et al. Gas Chromatography-Mass Spectrometry Method for the Determination of Free Amino Acids as Their Dimethyl-tert-butylsilyl (TBDMS)Derivatives in Animal Source Food[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2456-2463.
[31]Bosch L, Sanz M L, Montilla A, et al. Simultaneous analysis of lysine, Nε-carboxymethyllysine and lysinoalanine from proteins[J]. Journal of Chromatography B, 2007, 860(1): 69-77.
[32]Badoud R, Pratz G. Simple and rapid quantitative determination of lysinoalanine and protein hydrolysate amino acids by high-performance liquid chromatography after derivatization with dansyl chloride[J]. Chromatographia, 1984, 19(1): 155-164.
[33]Al-Saadi J, Deeth H C. Cross-linking of proteins and other changes in UHT milk during storage at different temperatures[J]. Australian Journal of Dairy Technology, 2008, 63(3): 93-99.
[34]Al-Saadi J, Easa A M, Deeth H C. Effect of lactose on cross-linking of milk proteins during heat treatments[J]. International Journal of Dairy Technology, 2013, 66(1): 1-6.
[35]Fenaille F, Parisod V, Visani P, et al. Modifications of milk constituents during processing: A preliminary benchmarking study[J]. International Dairy Journal, 2006, 16(7): 728-739.
[36]Boschin G, Scaglioni L, Arnoldi A. Optimization of the synthesis of the cross-linked amino acid ornithinoalanine and nuclear magnetic resonance characterization of lysinoalanine and ornithinoalanine[J].Journal of Agricultural and Food Chemistry, 1999, 47(3): 939-944.
[37]Boschin G, D’Agostina A, Arnoldi A. A convenient synthesis of some cross-linked amino acids and their diastereoisomeric characterization by nuclear magnetic resonance[J]. Food Chemistry, 2002, 78(3):325-331.
[38]Rombouts I, Lagrain B, Brijs K, et al. Cross-linking of wheat gluten proteins during production of hard pretzels[J]. Amino acids, 2012, 42(6): 2429-2438.
