Fenton氧化反应过程中存在铁系络合物的初步分析
2014-05-08张思月酒井裕司张宗鹏
王 昶,张思月,酒井裕司,张宗鹏,张 骏
(1. 天津科技大学海洋科学与工程学院,天津 300457,中国;2. 工学院大学工学部环境能源化学科,东京都 192-0015,日本)
在难降解有机废水的处理中,Fenton法是研究和应用较多的一项技术,与其他高级氧化技术相比,具有反应快、易操作、可自动产生絮凝的优点.迄今为止已进行了包括染料废水、造纸废水、含油废水及污泥、焦化废水、制药废水等多种废水的降解研究,取得了良好的效果.因其具有的较高的矿化率和较快的反应速率,引起了环境领域研究人员的重视.然而,作为 Fenton氧化技术实际应用的理论指导,Fenton反应的机理一直处在不断的争论中,这也制约了人们对该方法的广泛应用.
Fenton试剂是亚铁离子和双氧水的组合,1894年由 Fenton[1]发现,作为强氧化剂的应用已有一百多年的历史.在 Fenton氧化机理的研究过程中,1934年Haber等[2]提出羟基自由基机理,认为Fe2+和H2O2的混合生成了羟基自由基,羟基自由基是 Fenton反应的主要中间产物,以后的许多学者都基本沿用自由基观点开展机理研究.如 Kang等[3]、唐义等[4]、崔晓宇等[5]在用 Fenton试剂氧化处理各种有机污染物的实际研究和工作中,都遵循了相似的机理观点.该理论认为,Fenton氧化反应中亚铁离子起到催化剂的作用,Fe(Ⅱ)与过氧化氢反应生成氧化活性很强的羟基自由基(HO·),同时 Fe(Ⅱ)被氧化成 Fe(Ⅲ).羟基自由基氧化电位高达+2.8,V,具有很高的电负性或亲电子性(569.3,kJ),容易进攻高电子云密度点.
然而,通过热力学计算可以发现,双氧水和亚铁离子间的外层电子转移反应不能进行,因为中间产物不易形成[6].相反,在Fenton反应体系中,一种含水亚铁和双氧水组成的配合物 Fe(Ⅱ)–H2O2在热力学上是可以形成的.因此,有研究者对羟基自由基作为 Fenton反应的主要中间产物这一反应机理提出质疑.Bossmann等[7]在研究光助Fenton反应降解2,4–p–苯胺时发现其反应的中间产物是 2,4–p–苯酚,与羟基自由基链反应机理预测的结果不同,他们认为这一中间产物是由电子转移促成的,随即提出高价铁氧化机理,该机理与过氧化物酶催化活化 H2O2或分子氧的机制具有相似性.同时,雷乐成等[8]也指出,在UV-Fenton处理PVA废水的实验过程中并没有发现小分子有机酸存在,这同样是自由基链反应未能解释的.高价铁Fe(Ⅳ)氧化机理认为:Fenton试剂氧化有机污染物的活性中间物是 Fe(Ⅳ)的配合物或螯合物.高价铁离子具有很高的氧化能力,通过夺取电子来氧化有机污染物.对高价铁 Fe(Ⅳ)配合物,Bossmann认为铁离子在水溶液中会发生反应:[Fe(OH)另外,高价铁 Fe(Ⅳ)不仅可以直接和有机污染物反应,而且还可以通过反应:进一步生成羟基自由基.
目前,大量的研究工作均从污染物降解的角度对Fenton降解的机理进行了推理性解释,但污染物种类繁多,仅针对某一种污染物的降解并不能普遍地说明问题.雷乐成等的研究虽然针对不同污染物对复杂中间产物进行了较为深入的测量,但具体来说考察的还是某种物质的降解机理,并且是从光子产率角度仅对光助 Fenton体系进行了探讨.本文将在排除降解底物和外加紫外光的影响下,仅从 Fenton氧化反应过程中反应体系的紫外–可见光谱入手,探讨 Fenton氧化反应过程中络合物的存在性.
1 材料与方法
1.1 仪器与试剂
UV–9100D型紫外–可见分光光度计,美国莱伯泰科公司;J500型精密电子天平,奥豪斯国际贸易上海有限公司;pH3210,SET2型精密酸度计,德国WTW公司;79–3型恒温磁力搅拌器.
30%双氧水、FeSO4·7H2O、Fe2(SO4)3,分析纯.
1.2 实验方法
室温下,在已调整pH为3的250,mL的水溶液中,加入一定量的 0.065,79,mol/L FeSO4溶液,开启恒温磁力搅拌器,使其充分混合均匀,然后加入所需的H2O2,并以此作为反应的开始时间,每隔一段时间分别取样,进行全扫描分析.
2 结果与讨论
2.1 FeSO4与不同浓度的 H2O2混合前后全扫描图形的比较
取 0.55,mL 0.065,79,mol/L FeSO4加入到pH为3的 250,mL水溶液中,混合均匀(c(Fe2+)=0.144,mmol/L),单独进行全扫描.然后依次取 0.04、0.05、0.06、0.07、0.08、0.09、0.10,mL 的 30% H2O2加入250,mL的水溶液中,使之溶液中H2O2的浓度分别为1.567、1.959,、2.351,、2.742、3.134、3.526、3.918,mmol/L,混合均匀后,分别单独进行全扫描,实验结果见图1.

图1 FeSO4和不同浓度的H2O2单独UV-Vis图谱Fig.1 UV-Vis spectra of FeSO4 solution and H2O2 solution of different concentration
由图1可知:H2O2在紫外光区域有一定的吸收强度,但在300~500,nm 并没有吸收,而FeSO4在考察的波段(190~500,nm)范围内,几乎没有吸收.
将上述FeSO4溶液和不同浓度的H2O2溶液进行混合,混合均匀后,再次分别单独进行全扫描.另配制一定浓度的 Fe2(SO4)3溶液,使其所含 Fe3+浓度与FeSO4溶液中所含 Fe2+浓度相同,然后取等量的Fe2(SO4)3于250,mL已调整pH为3的水溶液中,单独进行全扫描.实验结果如图2所示.
图2与图1的横坐标和纵坐标的刻度分别一样.由图 2可知:FeSO4和 H2O2混合后吸收曲线相对于相同 H2O2浓度的吸收曲线有了显著的抬升,并且混合物的浓度随着双氧水浓度的增加而增加.若此时Fenton体系中发生的反应为经典羟基自由基理论中的反应:Fe2++H2O2→Fe3++HO·+OH-,那么所加入的具有强氧化性过量的H2O2会将全部的Fe2+(0.144 mmol/L)都氧化成 Fe3+,此时混合体系的吸收曲线在300~500,nm范围内应与图2中0.144,mmol/L Fe3+单独全扫描曲线完全重合,因为在图 1中,该范围内Fe2+和 H2O2的单独吸收曲线基本为零.然而图 2中混合体系的曲线在 300~500,nm 范围内均明显高于Fe3+的吸收曲线,说明该混合体系中除了 Fe3+之外,显然还存在其他物质,且该物质在300~500,nm范围内的吸光度有区别于 H2O2、Fe2+和 Fe3+,属于一种新的化合物,具有极大的吸光度.

图2 FeSO4和不同浓度的H2O2混合UV-Vis图谱Fig.2 UV-Vis spectra of the mixture of FeSO4solution and H2O2 solution of different concentration
2.2 Fe2(SO4)3与不同浓度的 H2O2混合前后全扫描图形的比较
根据 Fenton理论,Fe2+与 H2O2相互作用,由于H2O2的强氧化性,能够使 Fe2+部分氧化成 Fe3+,只产生部分羟基自由基.由图 1和图 2可知:Fe2+、H2O2和 Fe3+单独存在时的全扫描在 300~500,nm 波长范围内 Fe2+和 H2O2并没有吸收,而 Fe3+有一个较高的吸收带;但 Fe2+和 H2O2混合后在 300~500,nm 范围内出现了比Fe3+更强的吸收带.为了调查该波长范围内 H2O2能否与 Fe3+作用形成一种新的化合物,通过以下的实验进行研究.
将 0.55,mL 0.032,895,mol/L Fe2(SO4)3溶液、不同浓度的 H2O2分别加入已调整 pH为 3的 250,mL水溶液中,混合前后分别都进行了全扫描,为了进一步调查 H2O2溶液对 Fe3+的作用影响,将混合的溶液放置 1,h后,再次进行全扫描,观察放置时间对溶液的影响.实验结果如图3—图5所示.
图3中有5条曲线:曲线b为单独对1.567,mmol/L H2O2的全扫描曲线,为图 1中 H2O2的最小浓度;曲线a为对0.144,mmol/L Fe3+溶液单独全扫描曲线;曲线c为两溶液混合后的全扫描曲线;曲线d为该混合溶液混合后放置1,h的全扫描曲线;曲线e为Fe3+和H2O2溶液单独全扫描吸光度的叠加曲线,即曲线 a和曲线b的叠加值.

图3 c(H2O2)∶c(Fe3+)=10.8∶1时 Fe2(SO4)3和 H2O2单独与混合体系UV-Vis图谱的对比Fig.3 UV-Vis spectra of independent Fe2(SO4)3and H2O2 and their mixture when c(H2O2)∶c(Fe3+)=10.8∶1
由图 3可知:Fe3+溶液中加入 H2O2的混合溶液的全扫描(曲线 c)吸收强度,几乎等于 Fe3+和 H2O2相同条件下单独全扫描吸收强度的叠加(曲线 e),这就说明了在Fe3+溶液中加入H2O2后并没有对Fe3+产生影响,这是由于 Fe3+是最高氧化态,相对稳定,不易再被氧化.通过对混合后放置1,h的溶液进一步全扫描,可以发现,放置1,h后的溶液没有发生变化,这就充分说明 Fe3+与 H2O2相对独立,在 300~500,nm之间吸收强度等于Fe3+单独吸收强度,此时不会形成新的络合物.
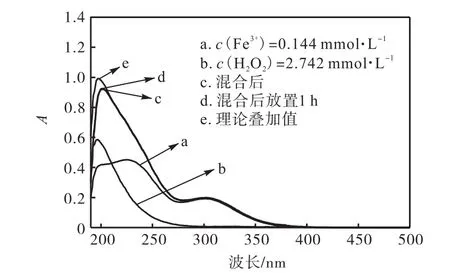
图4 c(H2O2)∶c(Fe3+)=19∶1 时 Fe2(SO4)3和 H2O2单独与混合体系UV-Vis图谱的对比Fig.4 UV-Vis spectra of independent Fe2(SO4)3and H2O2 and their mixture when c(H2O2)∶c(Fe3+)=19∶1
图 4与图 3基本相同,只是改变了 H2O2的浓度,从图 4中的各种曲线的变化规律来看,其结论与图 3完全相同.只不过是在 200,nm 左右,Fe3+和H2O2单独全扫描的理论叠加值略高于实际混合的吸收曲线,这可能是由于紫外可见分光光度计的吸光度适用范围在 0.2~0.8之间,超过该范围,图形会产生压缩,所以理论值略高于实测值,但在 250,nm 之后两者基本重合.
为了进一步调查 H2O2浓度对 Fe3+的影响,将H2O2浓度由 1.567,mmol/L提高到 3.918,mmol/L,为图1中H2O2的最大浓度.由图5可知:即使H2O2浓度很高的情况下,H2O2对 Fe3+并不产生作用,250,nm以后,理论叠加值与实测值极为吻合.从而证明了Fe3+和 H2O2共存体系中,相对稳定,彼此没有产生化学作用,没有形成新的化合物.
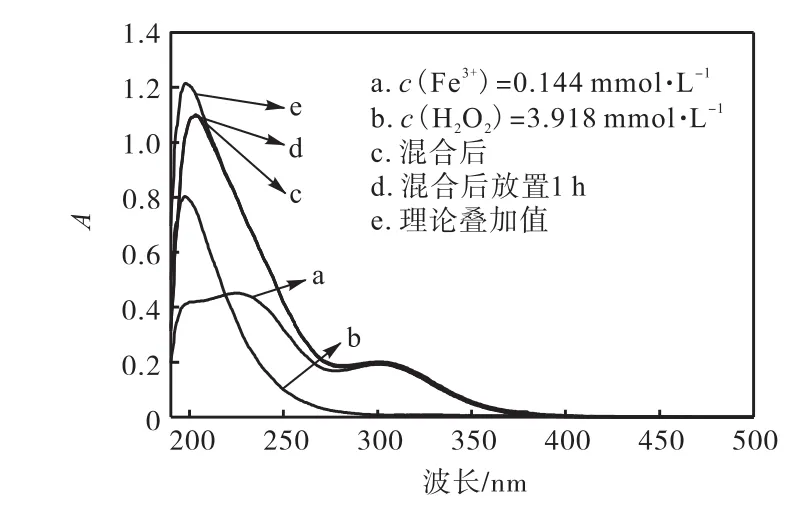
图5 c(H2O2)∶c(Fe3+)=27.1∶1时 Fe2(SO4)3和 H2O2单独与混合体系UV-Vis图谱的对比Fig.5 UV-Vis spectra of independent Fe2(SO4)3and H2O2 and their mixture when c(H2O2)∶c(Fe3+)=27.1∶1
对比图 2在 300~500,nm范围内的吸收强度可知,Fe2+与 H2O2共存体系中,不仅会产生 Fe3+,而且还有新的化合物存在,这与人们提出的 Fenton理论中络合物反应机理[7]有着密切的联系.
2.3 FeSO4与 Fe2(SO4)3等物质的量混合前后全扫描图形的比较
从 Fenton反应的初始溶液来说,Fe2+与 H2O2的作用产生了羟基自由基而自身被氧化成 Fe3+,Fe2+和Fe3+存在一个动态平衡,共存于一体.为了调查它们相互之间的影响,将 0.55,mL 0.065,79,mol/L FeSO4与0.032,895,mol/L Fe2(SO4)3加入已调整pH为3的250,mL水溶液中,混合前后分别进行全扫描,混合后放置1,h再次进行全扫描,结果如图6所示.
由图 6可知:Fe2+和 Fe3+等物质的量混合前后以及混合后放置 1,h的溶液的全扫描吸收强度曲线基本吻合,能够说明 Fe2+与 Fe3+本身并不结成新物质,Fenton体系中Fe不同价态之间的转化是通过强氧化剂H2O2实现的.
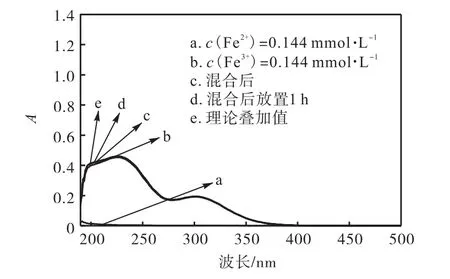
图6 Fe2+与Fe3+混合前后UV-Vis图谱Fig.6 UV-Vis spectra of independent Fe2(SO4)3and FeSO4 and their mixture
至此可知,Fenton反应得到的混合体系中除了Fe3+之外,还存在的另一种新物质应该是一种铁系络合物.由本研究可知,该络合物不是由 Fe3+与 H2O2作用产生,而且 Fe2+与 Fe3+相对独立(图 6),这种络合物只能是由 Fenton试剂反应得到的.这是目前该理论的一个难题,如何揭示新的络合物组成结构,这对于进一步发展 Fenton理论,确定羟基自由基产生的基元反应有着极为重要的意义,也是本课题今后不懈努力的方向.
3 结 论
对FeSO4与不同浓度H2O2的反应、Fe2(SO4)3与不同浓度 H2O2的反应以及FeSO4与 Fe2(SO4)3等物质的量反应的紫外–可见全扫描光谱进行研究,结果表明:Fe3+和 H2O2的混合溶液的全扫描吸收强度与这两种物质的单独全扫描吸收强度的理论叠加值十分吻合,这两种物质相对稳定,彼此不发生化学反应;Fe2+和Fe3+等物质的量混合体系中,Fe2+和Fe3+之间相互独立,不结合成新物质;Fenton反应得到的混合体系中除了 Fe3+之外,存在另一种物质,该物质是单单靠 Fenton试剂反应形成的,并且在 300~500,nm范围内具有极大的吸光度,推测该物质是一种铁系络合物,且随着 H2O2浓度的增加,它的吸收强度也有所增加.
[1] Fenton H J H. Oxidation of tartaric acid in the presence of iron[J]. Journal of the Chemical Society,1894,65:899–910.
[2] Haber F,Weiss J. The catalytic decomposition of hydrogen peroxide by iron salts[J]. Proceedings of the Royal Society of London:Series A,1934,147:332.
[3] Kang N,Lee D S,Yoon J. Kinetic modeling of Fenton oxidation of phenol and monochlorophenols[J]. Chemosphere,2002,47(9):915–924.
[4] 唐义,万静生,王健. Fenton试剂处理异戊基黄药生产废水的研究[J]. 安徽建筑工业学院学报:自然科学版,2011,19(5):52–55.
[5] 崔晓宇,曾萍,邱光磊,等. Fenton法处理黄连素废水试验[J]. 环境科学研究,2012,25(8):916–921.
[6] Goldstein S,Meyerstein D,Czapski G. The Fenton reagents[J]. Free Radical Biology and Medicine,1993,15(4):435–445.
[7] Bossmann S H,Oliveros E,Gob S,et al. New evidence against hydroxyl radicals as reactive intermediates in the thermal and photochemically enhanced fenton reactions[J]. Journal of Physical Chemistry A,1998,102(28):5542–5550.
[8] 雷乐成,何锋. 均相 Fenton氧化降解苯酚废水的反应机理探讨[J]. 化工学报,2003,54(11):1592–1597.
