启动机体防御机制
——利用患者自身免疫系统来对抗癌症
2014-05-05咸孟飞马晋平编译
咸孟飞 马晋平/编译
启动机体防御机制
——利用患者自身免疫系统来对抗癌症
咸孟飞 马晋平/编译
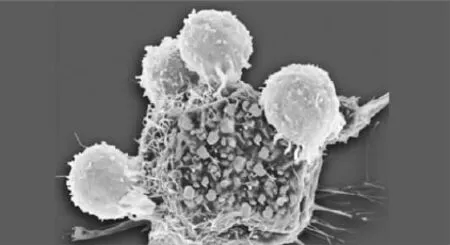
T细胞攻击:彩色扫描电子显微照片(SEM)显示T淋巴细胞(浅色)结合到癌细胞抗原上。研究人员能否利用患者自身免疫系统的杀伤力来治疗癌症呢?
● 继化疗、放疗后,在肿瘤疗法的创新上,研究人员正在探索多种免疫疗法的治疗效果,如阻断免疫检查点、过继性T细胞转移联合治疗,或肿瘤疫苗和细胞因子联合给药等。相信在可预见的未来,免疫疗法将对肿瘤患者的生存产生深远的影响。
一百多年前,美国骨外科医生威廉·科莱(William Coley)对一位面部肉瘤的患者进行了手术切除(切除了大部分瘤体),术后,患者发生了化脓性链球菌感染,不久恶性肉瘤奇迹般地消失了。七年后,科莱在一次随访时发现他仍然活着,也没有任何癌症复发的征象,科莱在惊讶地同时,猜测这位患者可能是由于细菌感染导致的免疫反应发挥了重要的抗癌作用。随后他又为十几例无法进行手术切除的肿瘤患者注射了链球菌,不出所料,发生感染的患者中,只有一位患者肿瘤没有任何变化,其余患者的肿瘤均不同程度地缩小。
随后,科莱便开始了灭活细菌抑制肿瘤作用机理的实验,希望该细菌在激活免疫系统的同时避免致命的感染。结果发现,通过注射灭活细菌可以使发生于骨骼、肌肉和脂肪组织的恶性肿瘤(肉瘤)完全消退。1936年科莱去世。不幸的是,随着放疗应用的逐渐普及和化疗的出现,他的大部分研究也逐渐被淡忘。
如今,利用免疫调节治疗癌症又被重新提上日程。免疫治疗不同于化疗和放疗,后者是直接杀死癌细胞,而免疫治疗是通过增强人体的正常免疫机制,增加机体对抗肿瘤的能力。免疫治疗包括引进复合物直接刺激免疫细胞,加强免疫细胞反应,或通过一种合成蛋白模拟正常免疫反应复合物,加强机体的免疫反应。2013年,《科学》杂志将“肿瘤免疫治疗”列入“年度科学突破”之首。目前,市场上已存有少数治疗癌症的药物,各期临床试验也研究出了几十种前景乐观的疗法,与上述治疗方法相比,免疫治疗或将彻底改变肿瘤的治疗方式。
免疫反应的力量
人体免疫系统分工布局精细,能够持续的监测机体环境并保护人体免受感染。人体免疫系统由两个组成部分:先天性免疫和适应性免疫,两者相互协调共同对抗感染。更重要的是,免疫系统能对感染过的病原体产生记忆。先天性免疫系统的巨噬细胞和嗜中性粒细胞受到如常见微生物肽、表面分子或基因序列等危险信号的刺激,会激发机体的免疫机制迅速抵御外来入侵者。同时,适应性免疫B细胞产生特异性反应,产生抗体识别并清除病原体。已摄入病原体的固有免疫细胞活化抗原特异性T细胞,进一步提高机体的免疫应答。B和T细胞可以产生持久的记忆,对再次入侵的相同病原体产生更迅速、更敏捷的反应。
20世纪60年代和70年代期间,美国纪念斯隆-凯特琳癌症中心(MSKCC)的路德维希癌症研究所(LICR)的劳埃德·奥尔德(Lloyd Old)重燃了人们对肿瘤免疫治疗研究的兴趣。他发现,肿瘤细胞的表面抗原与正常细胞不同,这就是所谓的“肿瘤相关抗原”。他试图以此为基础探索治疗肿瘤的疫苗,激活肿瘤特异性的免疫反应。1980年代,继奥尔德之后,美国国立卫生研究院(NIH)的史蒂文·罗森伯格(Steven Rosenberg)也证实了这一点。罗森伯格利用细胞因子激活免疫系统来治疗癌症。
最近,得克萨斯大学MD安德森癌症中心免疫学主任詹姆斯·艾利森(James Allison)率先开创了免疫检查点阻断技术。他之前就职于MSKCC。为了确保免疫系统不会过度活化,导致引起组织损伤或攻击机体,调节性T细胞和髓源性抑制细胞可以分泌抗炎蛋白或直接抑制促炎性免疫细胞。此外,被激活的免疫细胞其表面免疫抑制蛋白可以中和免疫应答。实际上,肿瘤很有可能利用这些抗炎通路,或通过刺激增加调节性T细胞或增加免疫检查点蛋白的表达,来逃避免疫系统的识别。为了使免疫反应能顺利的攻击肿瘤,艾利森目前正着手开始研究新的技术来阻断免疫检查点。这些令人兴奋的新疗法能延长晚期恶性肿瘤患者的生命,如肾癌和恶性黑色素瘤。

肿瘤疫苗:大多数正在研发的肿瘤疫苗都涉及到肿瘤特异性抗原成分的注射,以加强免疫系统的肿瘤特异性免疫反应。其他诸如前列腺癌疫苗Sipuleucel-T,需要提取患者的抗原呈递细胞(APC细胞),然后加入免疫刺激因子,将其与患者肿瘤抗原共同培养,为APCs在体内激活T细胞做好准备(截止 2014年 4月,FDA共批准了 3个针对癌症的疫苗, 分别是 Cervarix、Gardasil、Sipuleucel-T,前两个都是人乳头瘤病毒(HPV)疫苗,不能说是真正的癌症疫苗。而 Dendreon Corporation的 Sipuleucel-T是 FDA批准的首个癌症治疗性疫苗,2010年获批上市用于转移性去势抵抗前列腺癌。其原理是采集患者抗原呈递细胞(APC),用PAP-GM-CSF(前列腺癌抗原PAP与GM-CSF融合蛋白)激活,APC摄取PAPGM-CSF后加工成小肽片段并呈递到细胞表面,注入患者体内可激活T细胞免疫应答——译者注)
接种疫苗治疗癌症
局部注射的卡介苗(BCG)是由减毒的活牛分枝杆菌制成的抗结核疫苗。1990年,BCG已被批准用于治疗膀胱癌。这是首个获得美国食品和药物管理局 (FDA)批准用于治疗癌症的免疫制剂。早在1929年,约翰·霍普金斯大学的雷蒙德·珀尔(Raymond Pearl)首次提出结核病感染或BCG可能有抗癌作用——活检时发现活性结核病患者的癌症发生率下降。50年代末,奥尔德进一步证实了动物模型注射BCG能减缓肿瘤的生长。随后在70年代和80年代的研究发现,定期给患者肿瘤注射BCG可使膀胱癌消退,肿瘤生长减缓,其复发率降低12倍。在批准后的20年内,BCG仍然是非肌层浸润性膀胱癌最有效的治疗方法,治愈了70%的非肌层浸润性膀胱癌患者。
减毒的菌株可以减缓肿瘤的生长,它通过攻击肿瘤细胞及周围细胞,引起免疫细胞的浸润,促炎症细胞因子的释放,最终导致癌细胞被中性粒细胞和巨噬细胞吞噬。然而,炎症反应在有效杀死肿瘤细胞的同时,也损伤膀胱粘膜的正常细胞,导致类似尿路感染的症状产生(如低烧和尿痛)。研究人员为此希望研制出一种新的疫苗,即通过结合肿瘤细胞的特有蛋白,从而激活全身肿瘤特异性免疫反应,避免局部注射的副作用。
不幸的是,几乎没有研究证实肿瘤特异性疫苗具有显著的抗肿瘤活性。迄今,市场上只有一种肿瘤特异性疫苗——前列腺癌疫苗。该疫苗2010年由FDA批准作为治疗转移性前列腺癌的最后治疗手段。生产前列腺癌疫苗,需要提取患者自身的抗原呈递细胞(APC),经处理后回输患者体内。在体外,APCs可以与免疫刺激因子和前列腺酸性磷酸酶(PAP)抗原一起培养(PAP是一种细胞表面蛋白,约95%的前列腺癌细胞表达)。在一项随机对照试验中,这种治疗方法可以使非肌层浸润的前列腺癌患者的总体生存时间延长四个月。
研究证实,全身性注射PAP抗原或其他肿瘤类似的特异性抗原——而不是离体治疗的白血细胞亚群如前列腺癌疫苗——可以激活肿瘤部位的免疫反应。目前进行的几百项临床试验,正在评估肿瘤疫苗是否可以激活肿瘤特异性免疫反应,对患者生存获益。其中包括乳腺癌、肺癌、肾癌和黑色素瘤的Ⅲ期临床试验。
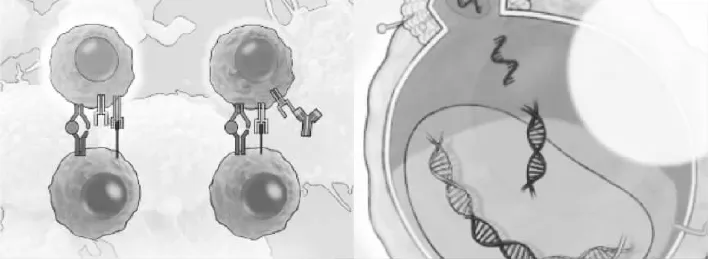
不要停止战斗(左图):免疫检查点阻断疗法可以阻止正常情况下免疫反应的中断。利用结合到T细胞表面的蛋白,如细胞毒性T淋巴细胞抗原4(CTLA-4)或程序性死亡-1受体(PD-1)等分子阻断免疫检查点,这些分子通常在活化的T细胞表达,一般可抑制免疫反应。这种疗法可以使免疫反应维持活性。T细胞过继转移(右图):在进行T细胞过继转移的过程中,将T细胞从病人的血液或肿瘤中分离出来,转染病毒,使其表达肿瘤靶向嵌合抗原受体(CARs),然后将转移的T细胞注入患者体内后,就会攻击癌细胞
阻断免疫抑制作用
另一个令人兴奋且发展较快的免疫疗法是阻断免疫检查点疗法。免疫检查点是防止免疫系统过度激活的抑制通路:当机体认为免疫反应过强时,免疫细胞表面蛋白将活化并终止免疫反应。例如,细胞毒性T淋巴细胞抗原4(CTLA-4)通常位于T细胞膜内,当其表达于细胞膜外时,它将作为一个终止信号传递给免疫系统。
90年代中期,艾利森推测,暂时中断CTLA-4的抑制作用或可增强免疫系统起到抗癌作用。在前临床试验研究中,他给小鼠皮下注射结肠癌细胞,待其形成结肠癌后,再往瘤内注射抗CTLA-4抗体,肿瘤可以完全消失。对早期恶性黑色素瘤患者进行临床试验,结果显示该疗法安全有效。2010年,一项大规模Ⅲ期临床试验表明,用人源单克隆抗体-易普利单抗(Ipilimumab,商品名为Yervoy)阻断CTLA-4,能够延长晚期黑色素瘤患者的总体生存时间。
然而,患者对Ipilimumab的敏感率较低,接受治疗的患者中,只有约10%的患者瘤体缩小,18%的患者瘤体无变化但病情稳定。Ipilimumab是第一个可改善患者总体生存时间的药物。通常情况下,患者从确诊后开始接受传统的化疗,生存期大约为6~9个月。此外,对Ipilimumab敏感的患者,大多数生存期延长至两年以上。2011年,FDA批准该药用于治疗晚期黑色素瘤,早期试验参与者的后续随访研究显示,一些患者的生存期可以延长10年。目前,Ipilimumab的Ⅱ期和Ⅲ期临床试验正在测试其能否治疗其他癌症,包括非小细胞肺癌、前列腺癌、肾癌和卵巢癌等。
Ipilimumab最常见的副作用与免疫有关,是由于药物在免疫系统的释放造成的。主要包括结肠炎,皮炎及肝炎,这些都是由于过度炎症导致的。然而,由于Ipilimumab的反应率偏低,需要进一步地研究以改善这一现状。
其中一个方法是阻断其他的免疫检查点,如T细胞表面的细胞程序性死亡受体1(PD-1)及位于APC的配体(PD-L1)。与CTLA-4类似,PD-1既表达于活化的T细胞表面,也在“耗尽”的T细胞表面表达,尽管后者细胞表面的病原体已经被清除。当PD-1结合PD-L1时,T细胞反应减弱。有趣的是,除了APC表达PD-L1,肿瘤细胞也有表达(或PDL1在肿瘤逃避免疫应答的过程中起重要作用)。早期的结果已证实,百时美施贵宝公司的抗PD-1抗体nivolumab治疗恶性黑色素瘤、非小细胞肺癌、肾癌的前景较好,目前的三期临床试验正在评估这一药物的生存获益。此外,对PD-L1抑制剂也在进行类似的研究。
早期测试抗-CTLA-4和抗PD-1药物的研究,还揭示了两个免疫检查点同时阻断的好处。去年7月,一项发表在《新英格兰医学杂志》上的研究显示,用最大剂量联合nivolumab和Ipilimumab治疗转移性黑色素瘤,有一半以上患者的肿瘤体积缩小超过80%,其中80%的患者治疗后存活超过一年。目前,转移性黑色素瘤的治疗手段有限,临床处理较棘手,而近期的研究结果令人振奋,也阐释了免疫检查节点封锁的治疗方法能够改变癌症疗法的原因。
过继转移T细胞
提高肿瘤免疫攻击的第三种方法,是从患者体内分离出T细胞并在实验室中扩增,然后将这些强效的抗癌成分重新输入患者体内,这一过程称为过继性T细胞转移。首先,利用肿瘤浸润性淋巴细胞(TIL)完成此过程,TIL是一种离开血液循环迁移到实体瘤的白血细胞亚群,可以从切除的肿瘤中分离。不幸的是,一些患者病情发展太快,而体外扩增所需要的时间较长,大约长达一个月。对于生存时间大于一个月的患者,该疗法可能会有所帮助。2010年发表的Ⅱ期临床试验研究显示,20例IV期黑色素瘤患者进行治疗后,一半的患者得到明显改善,其中两名患者的瘤体完全消退。
然而,在一些不可切除病灶的患者和切除肿瘤中无TIL生长或TIL在体外无抗肿瘤活性的患者,这一疗法将受限。为了解决这一问题,研究人员开发了嵌合抗原受体(CARs)对患者的循环T细胞进行遗传修饰,使其将肿瘤细胞作为靶细胞。CARs包括抗原识别结构域及其修饰的抗体片段,这些部位能够识别肿瘤细胞表面的一个特定蛋白和位于细胞内的能够激活T细胞的结构域,刺激自身在体内的增殖。
研究人员已经研制出了治疗多种癌症的CARs,包括慢性淋巴细胞白血病(CLL)。方法是从白血病患者的血液中分离出 T细胞,诱导其表达CD19靶向的CARs,在体外扩增后,将修饰的细胞回输患者体内。CD19是细胞表面蛋白,在正常B细胞和肿瘤恶性B细胞表面均可表达。应用其他治疗方法无效的CLL患者,用此方法治疗后,肿瘤细胞可部分或完全消失。
尽管目前有关过继转移T细胞的疗法还没有获得FDA批准,但是已有多项大规模的Ⅰ期和Ⅱ期临床试验正在探索此疗法的安全性以及对不同癌症患者生存的影响,包括白血病、淋巴瘤、胰腺癌、乳腺癌、前列腺癌和黑色素瘤等。
在不久的未来,研究或将证实,免疫疗法是对抗癌症的一个强力武器,后续的研究也将进一步提高该方法的有效性并增加受益人群。目前,许多研究人员正在研究联合多种免疫疗法的治疗效果,如阻断免疫检查点、过继性T细胞转移联合治疗,或肿瘤疫苗和细胞因子联合给药,等等。在可预见的未来,免疫制剂将对人类生存产生深远的影响,数百种探索肿瘤免疫治疗的临床试验或将取得成果。
[资料来源:The Scientist][责任编辑:则 鸣]
本文作者:杰米·格林(Jamie Green),纽约长老会医院、威尔康乃尔医学院外科住院医师,目前在纪念斯隆-凯特林癌症中心进行一项外科团体研究。曾经组织Ipilimumab临床试验的夏洛特·阿里扬(Charlotte Ariyan)参与了上述这项研究。
