徐汇区医疗机构植入/介入性医疗器械使用情况的调研
2014-05-04王芳陈尧水高吾名顾伟
王芳,陈尧水,高吾名,顾伟
1.上海市食品药品监督管理局徐汇分局,上海 200030
2.上海交通大学附属胸科医院 门诊办公室,上海 200030
徐汇区医疗机构植入/介入性医疗器械使用情况的调研
王芳1,陈尧水1,高吾名1,顾伟2
1.上海市食品药品监督管理局徐汇分局,上海 200030
2.上海交通大学附属胸科医院 门诊办公室,上海 200030
0 前言
随着我国现代医学的进步,医疗器械不仅可用作一般的辅助治疗工具,而且也成为推动疾病治疗新技术应用和提供疾病更多诊治方案的源动力。因此,医疗器械的使用安全,尤其是高风险的植入/介入性医疗器械的使用、管理、追溯等日益被医疗机构、医务人员和患者所重视[1]。本文以上海徐汇区医疗机构为样本,通过问卷调查、现场核查、专家研讨座谈会等形式,对徐汇区内11家二、三级医疗机构植入/介入性医疗器械的管理模式、使用情况进行了调研,针对植入/介入性医疗器械的证照管理、医疗器械不良事件监测管理和非消毒包装骨科植入类产品的追溯管理、医疗器械废弃物的管理等进行分析,并借鉴国内外植入/介入性医疗器械管理的经验,提出相应的管理改进措施。
1 徐汇区医疗机构植入/介入性医疗器械管理和使用现状
1.1 植入/介入性医疗器械管理现状
1.1.1 管理制度
徐汇区现有二、三级医疗机构11家。其中,三甲综合性医院3家,三甲专科医院5家,二级综合性医院3家。这11家医疗机构对医用耗材,特别是植入/介入性医疗器械均指定了相关部门负责采购,并成立医疗器械管理委员会,建立相应的采购流程和准入制度,但是其具体的管理机构归口不统一:有7家医院是由医学装备部或设备科负责,1家医院由物流中心负责,1家医院由药械科负责,2家医院由采购中心负责。归口管理不统一可能导致医院管理者对植入/介入性医疗器械的认识和工作重点定位存在差异。
1.1.2 计算机管理
徐汇区11家医疗机构对植入/介入性医疗器械均采用计算机信息化管理,分别建立相应的计算机追溯系统,理论上均可实现追溯功能,但未与全院的HIS、物价收费系统相关联,在具体执行过程中有先使用、后入库等现象。
1.2 植入/介入性医疗器械使用情况
数据统计显示,全区11家医疗机构的植入/介入性医疗器械的使用量占各医院医疗器械使用总量的30%~40%,见表1。其中进口植入/介入性医疗器械占总量的80%~85%,并呈逐年上升趋势。
各医疗机构植入/介入性医疗器械使用的种类、数量等各有特色,如三甲2医院,其骨科耗材的使用量占植入/介入性医疗器械总量的55%以上;三甲1、三甲5医院,其心内、外科耗材的使用量占植入/介入性医疗器械总量85%以上;三甲7医院的眼科晶体占植入/介入性医疗器械总量的45~55%,见表2。
2 主要问题及分析
2.1 医疗器械证照管理现状与不足
在对11家医疗机构的医疗器械合法资质审核的管理的调研中发现,仅1家三甲医院自行开发了计算机供应商管理系统,实行网络化管理,其他医院都是通过纸质文档或电子扫描文档保存,其档案管理存在着许多不足:① 证照真实性审核存在难点;② 证照的有效性常常疏漏。医疗机构必须对所使用的所有医疗器械证照是否有效、是否在有效期内、是否符合批准范围等进行仔细核实,其核实总量非常大。在对唯一已实行供应商计算机网络化管理的一家医院的调查中了解到,该院每年需新审核的注册证近700份、涉及供应商近120家,而每年到期需更新的注册证有200余份,占总数的30%~40%,其中不包括供应商年内更名、医疗器械许可证到期的情况。
2.2 医疗器械不良事件监测现状与不足
我区11家医疗机构2011~2012年共申报医疗器械不良事件1例,从全区的数据统计来看,2年内共报告医疗器械不良事件331例,其中医疗机构报告6例,只占总数的1.81%,见表3。造成医疗机构申报数偏低的主要原因有:① 对医疗器械不良事件的概念不清、申报意识不强[2-3];② 医疗器械不良事件申报宣传不够、体系不健全、渠道不畅;③ 医疗机构对医疗器械不良事件监测体系不健全。我区仅1家医院建立了院内网络监测系统,其他医疗机构均未建立医疗器械不良事件监测体系。
2.3 医疗器械废弃物管理现状与不足
11家医疗机构的医疗废弃物均由上海市固体废物处置站负责回收,其中1家三甲综合医院2012年送固体废物处置站的医用废弃物总量约54吨,其中植入/介入性医疗器械废弃物约200 kg,不到总量的0.1%,但其危害性依然存在。个别医院在病人索取手术后取出的废弃器械后就直接交给患者或其家属,形成二次污染源。造成目前无序状况的原因主要有:
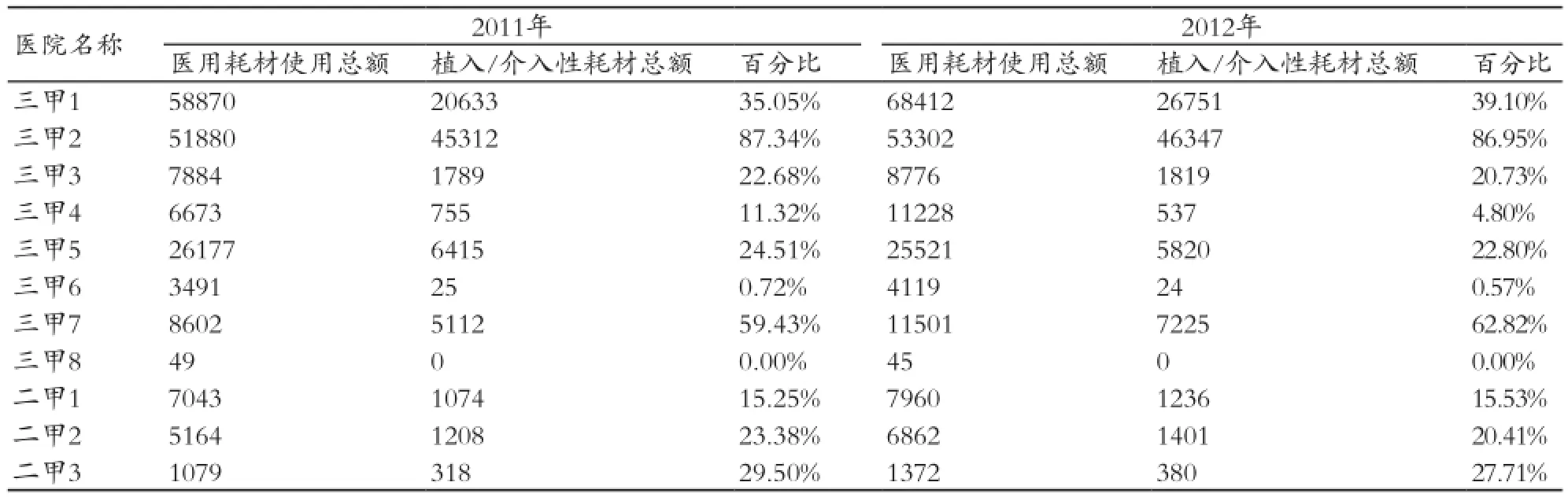
表1 2011~2012年徐汇区医疗机构植入/介入性医疗器械使用情况(金额:万元)

表2 徐汇区三甲医疗机构植入/介入性医疗器械使用量前5位

表3 徐汇区2011~2012年医疗器械不良事件申报情况汇总表
(1)相关制度不全,存在法律缺陷。对植入/介入性医疗器械取出废弃物的管理,相关行政主管部门均无明确规定,存在空白区。
(2)植入/介入性医疗器械的处置信息不对称、流程缺失。植入/介入性医疗器械从采购、使用、处置到监管往往由3~4个部门分管,设备科负责采购、临床科室负责使用、总务科负责废弃物的处置、院感科负责监管,其采购数量、使用数量与处置数量不对称,流程缺失。
(3)医务人员对植入/介入性医疗器械废弃物的销毁概念不清、意识不强。由于医务人员对医疗废弃物界定及危害性认识不足,对医疗废物分类、处置不重视,随意丢弃,导致医疗废物流入正常工作垃圾,或将取出的植入/介入性医疗器械赠予患者。
2.4 骨科“非消毒包装植入性医疗器械”管理现状与不足
本次调研发现:① 骨科植入性医疗器械的追溯信息有时会出现记录错误,尤其在骨钉、螺丝等“非消毒包装植入性医疗器械”较为集中,在现场核查中发现骨科钢板、钢钉在消毒后条形码不能对应、不能配套的差错发生率很高;② 现有的植入性医疗器械验收制度、条形码追溯信息的数据库在遇到“非消毒包装骨科植入性医疗器械”时,由于骨科治疗的特殊性在于需要医生临床手术即时挑选,且消毒时拆去了条码,所以术后统计时有时会发生条形码追溯信息记录差错;③ 非消毒包装骨科植入性医疗器械在一次消毒后未使用,会出现二次乃至多次消毒的问题,见表4,其对医疗器械质量的影响目前尚无专家评估[4]。
究其原因,目前我国市场上有大部分骨科内固定器械为非消毒包装,而非消毒包装植入性医疗器械在消毒灭菌过程中条形码标签与实物分离,造成非消毒包装植入性医疗器械的追溯信息准确率不高。
3 对策与建议
3.1 应用信息化技术强化植入/介入性医疗器械采购审核
(1)建立计算机管理系统及时锁定过期资质信息。通过建立计算机管理系统进行资质材料特别是证照的审核,是改变当前手工审核弊端的有效手段。对本区某三甲医院已实行的证照网络化管理的调研表明:该院通过物资信息管理平台,对所有植入/介入性医疗器械产品的基本信息(产品名称、物资类别、规格型号、品牌、价格、材料分类、医保代码等)通过条形码扫入数据库,同时在基本资料的基础上建立过期预警机制。当供应商营业执照、生产或经营许可证、医疗器械注册证、价格信息、代理授权证明、报关单等相关供应商资质证件即将到期时,发出提示警报,提示更换、办理相关资质证件,见表5。
(2)可由卫生行政管理部门或行业管理部门牵头尝试建立类似于“医疗器械采购资质审核查询中心”的市级平台。在全市建立健全医疗器械证照管理中心数据库、改分散重复管理为统一集中管理,现行管理模式和集中管理模式,见图1。组成覆盖全市的查询系统,其内容包括:①供应商的信息管理,包括公司的名称、营业执照、医疗器械企业经营许可证、产品授权代理证书、销售承诺及售后服务保证书等;② 医疗器械产品的基本信息,包括产品的品牌、注册证、规格型号、有效期、医保编码、产品条形码等,以及警示功能(如产品有效期的提示);③ 医院内部管理信息,包括产品的进货价格、收费价格、科室产品使用权限以及各种统计功能[5-6]。
3.2 健全医疗器械不良事件监测制度
(1)加强宣传,提升公众对不良事件监测的认识。
(2)建立临床科室监测系统,完善不良事件报告数据库。包括:① 明确医疗器械不良事件监测部门,设立专职或兼职人员;② 建立临床科室监测体系,指定可疑医疗器械不良事件监测联系人,明确管理的责任和义务;③ 建立全院信息化管理平台,完善医院可疑医疗器械不良事件报告数据库;④ 建立覆盖全院的网络监测体系[7],由市、区食品药品监督管理局协助建立。
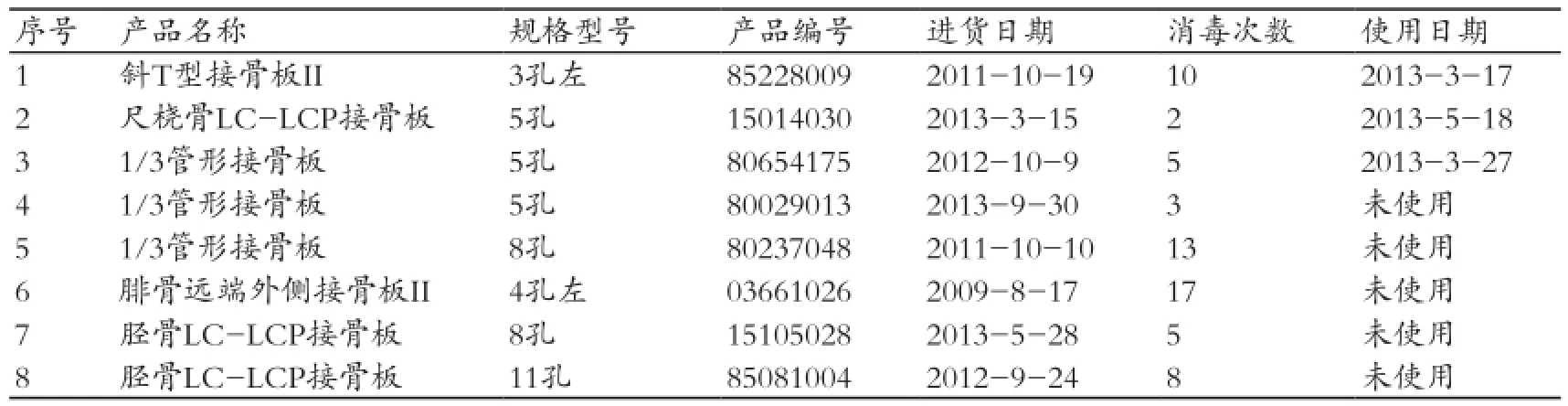
表4 上海某骨科器械代理商对其部份产品消毒次数的记录

表5 徐汇区某三甲医院使用证照网络化管理系统前、后的比较

图1 现行审证模式和集中管理平台模式
3.3 防止植入/介入性医疗器械废弃物流失
(1)医疗机构必须建立起严格的植入/介入性医疗器械废弃物管理制度,建立起严格的操作流程,具体规定使用植入性器械在术前如何进行消毒、灭菌处理,做好灭菌工作量记录;对手术室返回的植入性器械要做灭菌处理后退还;做好对植入人体后取出的植入性器械做消毒后销毁处理,全面、及时对应销毁的器材做好接收、销毁记录;严查存在随意丢弃、重复使用或二次销售的情况[8]。
(2)完善法制,严禁医疗废物流失。从技术层面明确规定非消毒包装植入性医疗器械多次消毒的问题。
3.4 加强对“非消毒包装骨科植入性医疗器械”的监控管理
对“非消毒包装骨科植入性医疗器械”的管理建议采取以下2种办法:① 实行植入性器械单一灭菌包装;② 完善植入性器械法律法规。
3.5 建立医疗器械唯一标识(UDI)系统
由行政主管部门或行业协会建立统一的信息管理标准,即医疗器械唯一标识(UDI)系统,为每个医疗器械建立唯一的UDI识别码[9]。医疗机构等使用单位可以通过扫描UDI码,迅速从公开数据库中查询到制造商名、器械的类别、过期日期、批号、使用方法等基本信息,以及生产许可证、生产厂家资质、经销商等特定信息,甚至还能升级权限,添加临床使用情况、不良反应、销毁时间等备注信息。UDI系统有助于更迅速准确地识别器械和获取器械特性的重要信息,降低医疗事故的发生,但也会带来成本的提高,使医疗费用增加。因此施行UDI系统,应该从风险最高的植入/介入性医疗器械开始,切实保障植入/介入性医疗器械的安全性和有效性。
[1] 国家食品药品监督管理局.医疗器械分类规则(局令第15号)[S].2000.
[2] 上海市食品药品监督管理局,上海市卫生局.关于印发《上海市食品药品监督管理局、上海市卫生局关于进一步加强本市植入性医疗器械管理的意见》的通知[S].2006.
[3] 贾健雄,孟刚.美国医疗器械追溯要求分析与思考[J].中国药物警戒,2012,(10):601-604.
[4] 岳伟.正确区分医疗器械编码与UDI间的不同概念[J].中国医疗器械杂志,2012,36(4):288-292.
[5] 楼晓敏.医疗器械证件识别与信息化管理系统的建立[J].中国医疗设备.2011,26(5):24-27.
[6] 王兰明.医疗器械不良事件监测与风险管理浅议[J].中国药房.2003,14(9):516-519.
[7] 张恩科,部继凤,孙冰,等.做好医疗器械不良事件监测及监测制度的建立[J].中国医疗设备.2011,26(12):81-83,98.
[8] 余永强,郑玉建.我国医疗器械不良事件监测现状研究[J].中国药物警戒.2008,5(1):24-27.
[9] 杨海.非消毒包装植入性器械追溯系统的优化研究[J].中国医疗器械杂志.2009,33(4):288-291.
Research on the Usage of Implantable/Interventional Medical Devices in Medical Institutions of Xuhui District
WANG Fang1, CHEN Yao-shui1, GAO Wu-ming1, GU Wei2
1.Branch of Xuhui, Shanghai Food and Drug Administration, Shanghai 200030, China;
2.Office of Outpatient Service, Chest Hospital Affliated to Shanghai Jiaotong University, Shanghai 200030, China
本文以上海市徐汇区11家二、三级医疗机构为样本,通过问卷调查、现场核查、专家研讨座谈会等形式,对植入/介入性医疗器械的管理现状、使用情况进行了调研。并针对区域内医疗机构目前存在的医疗器械证照管理、医疗器械不良事件监测、医疗器械废弃物管理和骨科“非消毒包装植入性医疗器械”管理的现状与不足,进行分析和研究,提出了植入/介入性医疗器械的管理新思路、新构想。
植入/介入性医疗器械;医疗设备管理;质量控制
The current management situation and usage of implantable/interventional medical devices were investigated in 11 medical institutions in ShanghaiXuhui district by questionnaire survey, field verifcation, expert discussion forums and so on. Status and inadequate of the management of medical device license, medical device adverse event monitoring, management of waste medical devices and orthopedics "non-sterile packaging of implantable medical devices" were analyzed and researched. The new ideas of the implantable/interventional medical devices were put forward in this paper.
implantable/interventional medical devices; medical equipment management; quality control
R197.39
C
10.3969/j.issn.1674-1633.2014.06.025
1674-1633(2014)06-0074-04
2014-02-26
顾伟,上海市胸科医院门诊办公室主任,工程师。
作者邮箱:wangfang@xh.sh.cn
