表面活性离子液体的合成及其在促进CO2水合物生成中的应用
2014-05-03徐小军王树立
徐小军,李 工,王树立,张 琳
(1.常州大学 石油化工学院,江苏 常州 213164;2.常州大学 石油工程学院 江苏省油气储运技术重点实验室,江苏 常州 213016)
CO2水合物是CO2气体在低温高压下与水形成的一种类似于冰的非化学计量的笼形晶体化合物,属于Ⅰ型水合物[1]。目前,CO2大量排放导致严重的环境问题,控制CO2的排放,并寻求新的技术分离、提纯、回收CO2气体是目前研究的热点[2-5],其中水合物法捕集分离CO2被认为是一种有效的方法[6-7]。在标准状况下,每m3的CO2水合物可以储存160~180 m3的气体[8]。但由于CO2水合物的生成过程类似于一种缓慢的结晶过程,伴随着气-液-固三相传质、传热等复杂过程,在不添加促进剂的条件下,CO2水合物的诱导时间长,生成速率非常缓慢,相平衡点较高[9];并且存在于气液界面处的水合物膜阻碍了气体进入液相,使得反应无法连续进行。因此,为实现CO2水合物的快速连续生成,加入的促进剂是研究的重点[10-11]。离子液体是指在室温或邻近室温下完全由阴阳离子构成的呈液态的离子化合物[12]。离子液体的特点是:极低的蒸汽压[13]、较好的化学稳定性及较宽的电化学稳定电位窗口[14],通过调节阴阳离子的结构来改变离子液体的理化性质,从而将功能性基团引入到离子液体中,可以满足某些特定的反应要求[15]。由于具备这些特性,近年来功能化离子液体受到越来越多的关注[16]。
本工作利用离子液体的特点,把表面活性基团引入离子液体中,合成出一类新型表面活性离子液体,使其具有离子液体和表面活性剂的双功能特性,并作为促进剂将其应用于CO2水合物生成过程中,考察其促进CO2水合物生成的效果。
1 实验部分
1.1 原料与仪器
1-甲基咪唑:AR,盐城市百益化工有限公司;六亚甲基亚胺:CP,江苏射阳化工厂;1,3-丙烷磺酸内酯:AR,苏州新区贝克精细化学品有限公司;十二烷基苯磺酸:CP,石家庄海森化工有限公司;哌啶、甲苯、乙酸乙酯、乙醚、甲醇:AR,国药集团化学试剂有限公司;CO2:纯度99.8%,常州京华工业气体有限公司。
Bruker公司Avance Ⅲ型500 MHz核磁共振波谱仪;岛津公司FTIR-8400S型傅里叶变换红外光谱仪;EAI公司CE-440型有机元素分析仪;TA公司SDT-Q600型热重示差扫描量热仪;上海方瑞仪器有限公司QBZY-1型全自动表面张力仪。
1.2 表面活性离子液体的合成及其水溶液表面张力的测定
将1,3-丙烷磺酸内酯溶于甲苯,搅拌下滴加等物质的量的六亚甲基亚胺,滴毕于70 ℃下反应2 h,过滤,滤饼用乙酸乙酯洗涤3次,100 ℃下干燥8 h,得白色固体内鎓盐;将内鎓盐溶于水中,室温下滴加等物质的量的十二烷基苯磺酸,80 ℃下反应8 h,产物在75 ℃下减压蒸馏除水,所得黏稠液体用乙醚和甲醇洗涤3次,再次减压蒸馏后,50 ℃下真空干燥至恒重,得表面活性离子液体1-(3-磺酸基)丙基六亚甲基亚胺十二烷基苯磺酸([HMIPS]DBSA)。用哌啶或1-甲基咪唑代替六亚甲基亚胺,采用上述方法分别合成出1-(3-磺酸基)丙基哌啶十二烷基苯磺酸([PPS]DBSA)和1-(3-磺酸基)丙基-3-甲基咪唑十二烷基苯磺酸([MIMPS]DBSA),其反应过程见式(1)~(2)。

将制备的表面活性离子液体分别配成质量浓度为100,300,500,700,900 mg/L的溶液,用表面张力仪测量不同温度下的表面张力。
1.3 CO2水合物生成实验装置及实验步骤
CO2水合物生成实验装置见图1。该装置由可视化反应釜、磁力搅拌系统、恒温水浴制冷系统、抽真空系统、高压配气系统、水下光纤摄像系统及数据采集系统组成。反应釜设计压力30 MPa,容积0.5 L;内置温度压力传感器,温度测量范围-50~100 ℃(精度±0.1 ℃),压力测量范围0~32 MPa(精度±0.01 MP);釜内装有磁力搅拌子,转速0~1 200 r/min;反应釜温度由低温恒温水槽控制,高压配气系统为CO2水合物生成提供高压环境;水下光纤摄像系统实时监测水合物生成现象;温度、压力数据由数据采集系统实时显示并存储。
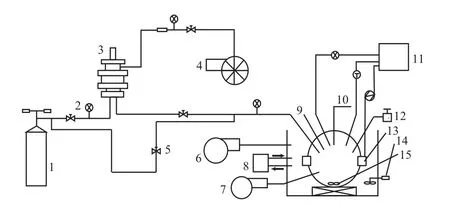
图1 CO2水合物生成实验装置Fig.1 Experimental installation for the formation of CO2 hydrate.
考察表面活性离子液体对CO2水合物相平衡压力的影响时,用待测液润洗反应釜3次后注入200 mL预先配制的不同质量浓度的表面活性离子液体溶液,然后抽真空10 min,打开低温恒温水槽,降至设定温度。打开进气阀,向釜内充入CO2气体,水合物完全生成后,稳定15 min,再打开泄压阀,控制泄压速率(5~10 s下降0.01 MPa),当水合物分解时,显示器中会出现气泡和亮斑,此时压力即为该温度下CO2水合物的相平衡压力。在4 ℃、未搅拌条件下向釜内充入4.0 MPa的CO2,以此作为起始压力,实时记录反应釜内的压力变化,直至压力趋于稳定,考察3种表面活性离子液体对CO2水合物生成过程中压力的影响。
2 结果与讨论
2.1 表面活性离子液体的结构表征结果
[HMIPS]DBSA的1H NMR(500 MHz, D2O)数据(化学位移δ):7.56(s,2H),7.00(d,J=5.0 Hz,2H),3.38~3.36(m,2H),3.33~3.30(m,2H),3.29~3.28(m,2H),3.17~3.14(m,2H),2.07~2.01(m,2H),1.71(d,J=3.9 Hz,2H),1.67~1.59(m,2H),1.47~0.47(m,29H)。[HMIPS]DBSA的FTIR(KBr)谱图见图2(a),其中3 041 cm-1处为苯环上C—H键的伸缩振动峰;2 952,2 854 cm-1处为C—H键的伸缩振动峰;2 798 cm-1处为N—H键的伸缩振动峰;1 600,1 465,1 460 cm-1处为苯环骨架的振动峰;833 cm-1处为苯环对位取代的特征峰;1 157,1 033 cm-1处为磺酸基的不对称伸缩振动和对称伸缩振动峰。元素分析实测值(w,%)为:C 59.041,H 8.989,O 17.633,N 2.694,S 11.643,与[HMIPS]·DBSA分子式的理论值相符。表明合成出的试样为[HMIPS]DBSA,分子式为C27H49S2O6N。
[PPS]DBSA的1H NMR(500 MHz,D2O)数据(δ):7.56(s,2H),7.02(s,2H),3.39(t,J=13.4 Hz,2H),3.14~3.06(m,2H),2.90~2.74(m,4H),2.04(dt,J=15.4,7.6 Hz,2H),1.91~1.70(m,2H),1.47~0.56(m,29H)。[PPS]DBSA的FTIR(KBr)谱图见图2(b),其中3 037 cm-1处为苯环上C—H键的伸缩振动峰;2 954,2 854 cm-1处为C—H键的伸缩振动峰;2 786 cm-1处为N—H键的伸缩振动峰;1 600,1 454 cm-1处为苯环骨架的振动峰;833 cm-1处为苯环对位取代的特征峰;1 161,1 033 cm-1处为磺酸基的不对称伸缩振动和对称伸缩振动峰。元素分析实测值(w,%)为:C 58.490,H 8.992,O 17.920,N 2.618,S 11.980。表明合成出的试样为[PPS]DBSA,分子式为C26H47S2O6N。

图2 表面活性离子液体的FTIR谱图Fig.2 FTIR spectra of ionic liquids with surface activity.
[MIMPS]DBSA的1H NMR(500 MHz,D2O)数据(δ):8.57(s,1H),7.51(d,J=10.9 Hz,2H),7.33(s,1H),7.23(s,1H),6.93(d,J=8.9 Hz,2H),4.24~4.09(m,2H),3.67(s,3H),2.76~2.71(m,2H),2.16~2.10(m,2H),1.42~0.29(m,25H)。[MIMPS]DBSA 的FTIR(KBr)谱图见图2(c),其中3 151 cm-1处为咪唑环上N—H键的伸缩振动峰;3 110 cm-1处为咪唑环上C—H键的伸缩振动峰;2 923,2 854 cm-1处为C—H键的伸缩振动峰;1 573 cm-1处为咪唑环上H键的伸缩振动峰;1 598,1 456 cm-1处为苯环的振动峰;833 cm-1处为苯环对位取代的特征峰;1 172,1 033 cm-1处为磺酸基的不对称伸缩振动和对称伸缩振动峰。元素分析实测值(w,%)为:C 56.450,H 8.120,O 17.900,N 5.440,S 12.090。表明合成出的试样为[MIMPS]DBSA,分子式为C25H42S2O6N2。
2.2 表面活性离子液体的热稳定性
3种表面活性离子液体的TG曲线见图3。由图3可看出,[HMIPS]DBSA,[PPS]DBSA,[MIMPS]DBSA的起始分解温度分别为286.7,304.8,307.6 ℃,表明[MIMPS]DBSA的热稳定性最高,这是由于[MIMPS]DBSA分子中的咪唑环含有共轭的大π键。另外,[PPS]DBSA比[HMIPS]·DBSA的热稳定性高,这是由于哌啶的六元环结构比六亚甲基亚胺的七元环结构稳定所致。
2.3 表面活性离子液体的表面活性
不同质量浓度的表面活性离子液体溶液的表面张力见图4。由图4可知,表面活性离子液体的加入有效降低了液体的表面张力,当表面活性离子液体的质量浓度低于100 mg/L时,在2~10 ℃内,温度对表面张力的影响不大,质量浓度在100~700 mg/L时,随温度的升高表面张力明显下降。质量浓度大于700 mg/L时,表面张力随质量浓度的增加变化不大。在10 ℃和700 mg/L时,[HMIPS]·DBSA,[PPS]DBSA,[MIMPS]DBSA溶液的表面张力分别为33.6,32.8,36.1 mN/m,与纯水的表面张力(73.2 mN/m)相比,降幅超过50%,与同条件下的十二烷基苯磺酸钠(SDBS)溶液的表面张力(34.4 mN/m)相差不大,表明合成的离子液体具有表面活性,是一种表面活性离子液体。

图3 表面活性离子液体的TG曲线Fig.3 TG curves of the ionic liquids.
2.4 离子液体对CO2水合物相平衡压力的影响
表面活性离子液体对CO2水合物相平衡压力的影响见图5。由图5可看出,CO2水合物相平衡曲线的共同特点是随温度的升高而上升。相同温度下,加入表面活性离子液体后,CO2水合物相平衡压力与纯水体系相比均有一定程度的下降,下降幅度与表面活性离子液体的质量浓度有关,每种表面活性离子液体在CO2水合物生成过程中均存在一个最佳质量浓度,[HMIPS]DBSA,[PPS]DBSA,[MIMPS]DBSA的最佳质量浓度分别为700,300,100 mg/L;但最佳质量浓度并不与其水溶液表面张力最低时的质量浓度一致。在同一温度下,最佳质量浓度的表面活性离子液体体系中的CO2水合物相平衡压力最低,较纯水体系的降幅最大。当低于最佳质量浓度时,随质量浓度的增加,溶液的表面张力逐渐降低,能有效降低CO2水合物的相平衡压力;而高于最佳质量浓度时,对表面张力的影响减弱,随质量浓度的增大,溶液中产生包含CO2气体的胶束,导致CO2水合物的相平衡压力增大,相平衡压力降幅相对减小。与700 mg/L的SDBS溶液[17]比较可知,在2~10 ℃内,[HMIPS]DBSA,[PPS]DBSA,[MIMPS]DBSA溶液的CO2水合物相平衡压力明显低于SDBS溶液(见图6)。其中,[PPS]DBSA促进CO2水合物生成的效果最佳,4 ℃时其300 mg/L的水溶液与纯水相比,CO2水合物相平衡压力下降20.1%;与700 mg/L的SDBS溶液相比,CO2水合物相平衡压力下降13.6%。在此温度下表面活性离子液体溶液中CO2水合物相平衡压力为1.5~2.0 MPa,压力不高,因此选取4 ℃为CO2水合物生成的最佳温度。

图5 表面活性离子液体溶液中CO2水合物的相平衡压力Fig.5 Phase equilibrium pressure of the CO2 hydrate in the ionic liquid solutions with surface activity.

图6 表面活性离子液体与SDBS溶液中CO2相平衡压力的比较Fig.6 Contrast of phase equilibrium pressures of the CO2 hydrate in the ionic liquids and in sodium dodecylbenzenesulfonate(SDBS)solution.
2.5 离子液体对CO2水合物生成过程中压力的影响
在4 ℃下考察了[HMIPS]DBSA,[PPS]·DBSA,[MIMPS]DBSA在最佳质量浓度下对CO2水合物生成过程中压力的影响,并与700 mg/L的SDBS溶液进行比较[16],实验结果见图7。由图7可看出,表面活性离子液体溶液及SDBS由于具有表面活性,降低了溶液的表面张力,加速了气液间的传质速率,特别是在水合物生成初期阶段,促进了CO2水合物的生成。在4 ℃、起始压力4.0 MPa的条件下,700 mg/L的[HMIPS]DBSA在160 min时釜内压力趋于稳定值,压力下降1.78 MPa;300 mg/L的[PPS]DBSA在110 min时釜内压力趋于稳定值,压力下降1.91 MPa;100 mg/L的[MIMPS]DBSA在120 min时釜内压力趋于稳定值,压力下降1.74 MPa;而纯水在175 min时釜内压力趋于稳定值,压力下降1.41 MPa;700 mg/L的SDBS在123 min时釜内压力趋于稳定值,压力下降1.58 MPa。对比可知,[PPS]DBSA溶液可使釜内压力下降最大,压力趋于稳定耗时最短。这可能是由于[PPS]DBSA中的哌啶六元环空间结构在CO2水合物生成过程中起到架构水合物笼的模板作用,促进气体分子被包裹进笼型空穴中;而六亚甲基亚胺与1-甲基咪唑的环状结构虽然也有促进作用,但没有哌啶六元环的作用好,表明表面活性离子液体对CO2水合物生成的促进作用与其所含基团的环的大小有关。综合CO2水合物相平衡条件,在合成的3种表面活性离子液体中,促进CO2水合物生成的最佳表面活性离子液体为[PPS]DBSA,最佳生成温度和质量浓度分别为4 ℃和300 mg/L。
2.6 表面活性离子液体促进CO2水合物生成的机理
对于[HMIPS]DBSA,[PPS]DBSA,[MIMPS]DBSA,因为引入具有表面活性的十二烷基苯磺酸根阴离子,使它们具有表面活性剂的功能,降低了溶液的表面张力,有利于CO2气体进入液相,加快了气液传质速率,CO2水合物可快速生成。另外,[HMIPS]DBSA,[PPS]DBSA,[MIMPS]DBSA中的阳离子分别含有七元环、六元环和五元环,在水合物生成过程中,多元环状阳离子能起到架构水合物笼的模板作用,其中含六元环的[PPS]DBSA的效果最佳,当CO2气体进入到液相中时,部分CO2分子与环状结构在水分子的围绕下容易构建CO2水合物,并使气体分子更加牢固地束缚在笼内,同时也降低了CO2水合物的相平衡压力[18]。因此,在表面活性离子液体的阴阳离子共同作用下,促进了CO2水合物的快速生成。

图7 表面活性离子液体对CO2水合物生成过程中压力的影响Fig.7 Effects of the ionic liquids on the pressure in the formation of the CO2 hydrate.
3 结论
1)合成出3种表面活性离子液体[HMIPS]·DBSA,[PPS]DBSA,[MIMPS]DBSA,它们具有离子液体和表面活性剂的双功能特性,其水溶液的表面张力与SDBS溶液的表面张力相近。
2)3种表面活性离子液体均能降低CO2水合物的相平衡压力,促进CO2水合物的生成。其中,[PPS]DBSA的效果最好,生成CO2水合物的最佳条件为:质量浓度300 mg/L、温度4 ℃、起始压力4.0 MPa、反应时间110 min。
3)表面活性离子液体对CO2水合物生成的促进作用是由于其表面活性基团降低了溶液的表面张力、环状阳离子可以起到架构水合物笼的模板作用,二者共同作用促进了CO2水合物的快速生成。
[1]樊栓狮.天然气水合物储存与运输技术[M].北京:化学工业出版社,2005:9-28.
[2]肖杨,刘道平,谢应明,等.二氧化碳水合物最新研究进展[J].天然气地球科学,2007,18(4):607-611.
[3]Daraboina N,Ripmeester J,Englezos P.The Impact of SO2on Post Combustion Carbon Dioxide Capture in Bed of Silica Sand Through Hydrate Formation[J].Int J Greenh Gas Con,2013,15:97-103.
[4]Kumar A,Sakpal T,Linga P,et al.Influence of Contact Medium and Surfactants on Carbon Dioxide Clathrate Hydrate Kinetics[J].Fuel,2013,105:664-671.
[5]周雪冰,陈玉凤,易莉芝,等.CH4-CO2混合气体水合物生成过程[J].石油化工,2013,42(5):479-483.
[6]Sun Shicai,Liu Changling,Ye Yuguang.Phase Equilibrium Condition of Marine Carbon Dioxide Hydrate[J].J Chem Thermodyn,2013,57:256-260.
[7]Torre J P,Dicharry C,Ricaurte M,et al.CO2Capture by Hydrate Formation in Quiescent Conditions:In Search of Efficient Kinetic Additives[J].Energy Proced,2011,4:621-628.
[8]祁影霞,张华.添加水合物促进二氧化碳水合物生成的实验研究[J].高校化学工程学报,2010,24(5):842-846.
[9]Karaaslan U,Uluneye E,Parlaktuna M.Effect of an Anionic Surfactant on Different Type of Hydrate Structures[J].J Pet Sci Eng,2002,34(1/2):49-57.
[10]孙志高,刘成刚,周波,等.四丁基溴化铵-二氧化碳-水体系半笼水合物相平衡数据的测定[J].化学工程,2011,39(12):52-55.
[11]李玉星,朱超,王武昌.表面活性剂促进CO2水合物生成的实验及动力学模型[J].石油化工,2012,41(6):699-703.
[12]Welton T.Room-Temperature Ionic Liquids:Solvents for Synthesis and Catalysis[J].Chem Rev,1999,99(8):2071-2084.
[13]Earle M J,Esperanca J M S S,Gilea M A,et al.The Distillation and Volatility of Ionic Liquids[J].Nature,2006,439:831-834.
[14]赵东滨,寇元.室温离子液体:合成、性质及应用[J].大学化学,2002,17(1):42-47.
[15]李工,徐小军,徐恒,等.新型离子液体型固体酸的合成及其在酯化反应中的应用[J].石油化工,2012,42(6):641-646.
[16]Cole A C,Jensen J L,Ntai I,et al.Novel Brønsted Acidic Ionic Liquids and Their Use as Dual Solvent-Catalysts[J].J Am Chem Soc,2002,124(21):5962-5963.
[17]于永涛,徐恒,王树立,等.几类新型添加剂对气体水合物生成促进的研究[J].天然气化工,2011,36(6):15-20.
[18]杜建伟,唐翠萍,樊栓狮,等.Span20促进甲烷水合物生成的实验研究[J].西安交通大学学报,2008,42(9):1166-1169.
