浸润性乳腺癌PTEN、p53、EGFR与ER、PR及HER-2表达的关系
2014-05-03汤永峰冯晓敏谢莉莉
汤永峰,冯晓敏,谢莉莉
(1.南通体臣卫生学校,江苏南通 226007;2.南京市妇幼保健院病理科,江苏南京 210004)
浸润性乳腺癌PTEN、p53、EGFR与ER、PR及HER-2表达的关系
汤永峰1,冯晓敏1,谢莉莉2
(1.南通体臣卫生学校,江苏南通 226007;2.南京市妇幼保健院病理科,江苏南京 210004)
目的研究乳腺癌中雌激素受体(ER)、孕激素受体(PR)、表皮生长因子受体2(HER-2)与丢失性磷酸酶-张力蛋白基因(PTEN)、蛋白p53、表皮生长因子受体(EGFR)的关系。方法采用免疫组织化学S-P法检测ER、PR、HER-2、PTEN、p53和EGFR在68例乳腺浸润性癌和10例乳腺纤维腺瘤组织标本中的表达。结果ER、PR、HER-2、PTEN、p53和EGFR的表达分别是44.1%、47.1%、54.4%、45.6%、51.5%、58.8%,PTEN蛋白表达与ER呈正相关;p53蛋白表达与ER、PR表达呈负相关;EGFR的表达与ER呈负相关、与HER-2呈正相关。结论联合检测ER、PR、HER-2、PTEN、p53、EGFR对临床上乳腺癌患者判断预后和靶向治疗有重要临床意义。
乳腺癌;雌激素受体(ER);表皮生长因子受体2;p53;表皮生长因子受体
乳腺癌是妇女最常见的恶性肿瘤之一。据统计,全球每年有50万妇女死于乳腺癌,在我国的一些大中城市乳腺癌的发病已呈上升趋势,已成为威胁女性生命健康最常见的疾病。目前有关乳腺癌基因及一些相关因子的研究甚多,对于丢失性磷酸酶-张力蛋白基因(PTEN)、p53和表皮生长因子受体(EGFR)三种标志物的生物学作用的研究也较为广泛,但是有关雌激素受体(ER)、孕激素受体(PR)、表皮生长因子受体2(HER-2)、PTEN、p53和EGFR在乳腺癌中共同表达的研究较少。本研究采用免疫组化S-P法检测68例浸润性乳腺癌组织中PTEN、p53和EGFR蛋白的表达,分析它们与激素受体及癌基因HER-2的关系。
1 材料与方法
1.1 标本68例标本均由南通大学附属医院病理科提供的2004-2005年期间乳腺癌术后存档石蜡标本,病理类型全部为乳腺浸润性癌,所有病例术前均未进行任何放疗、化疗或激素治疗。患者均为女性,年龄30~71岁,平均53.2岁;肿瘤直径<3 cm者39例,≥3 cm者29例;腋窝淋巴结转移者32例,未见腋窝淋巴结转移者36例;按组织学分级:Ⅰ级20例,Ⅱ级25例,Ⅲ级23例。根据TNM临床分期Ⅰ期21例,Ⅱ期27例,Ⅲ期20例。其中46例有完整的随访资料,39例存活,7例死亡。随机选取病理诊断为乳腺纤维腺瘤病理蜡块10例为正常对照组,患者年龄19~44岁,平均36.5岁。
1.2 方法全部标本常规10%福尔马林固定,石蜡包埋切片。所用试剂均购自福州迈新生物技术有限公司,免疫组化采用SP法。
1.3 结果判断免疫组化结果均采用参照文献[1]的标准记分:即根据阳性细胞百分比以及阳性细胞染色强弱判断免疫组化结果。(1)按细胞染色的强弱记分,无阳性反应细胞为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞百分比记分,阳性细胞数≤10%为0分,阳性细胞数11%~25%为1分,阳性细胞数26%~50%为2分,阳性细胞数>50%为3分。根据两项之和判断其结果,如在同一病变中存在多个不同评分的视野,则取最大值和最小值的平均值作为免疫组化评分,<2分判为阴性,2~6分判为阳性。
1.4 统计学方法采用STATA7.0软件进行统计学分析,采用χ2检验及Spearman相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 ER、PR、HER-2、PTEN、p53和EGFR在乳腺癌中的表达情况68例乳腺癌组织中ER阳性30例(44.1%),PR阳性32例(47.1%),HER-2阳性37例(54.4%),PTEN阳性31例(45.6%),p53阳性35例(51.5%),EGFR阳性40例(58.8%)。10例纤维腺瘤组织中PTEN、p53及EGFR的阳性表达率分别为100%、0、10%。3种基因蛋白在上述两组表达的阳性率之间差异有统计学意义(P<0.01),见表1。

表1 PTEN、p53、EGFR在乳腺癌和乳腺纤维腺瘤中的表达(例)
2.2 PTEN蛋白表达与ER、PR、HER-2的关系PTEN蛋白的表达与组织学分级、腋窝淋巴结转移情况、ER状态有关,而与发病年龄、肿瘤大小、临床分期、PR、HER-2无关。在ER阳性组中,PTEN蛋白的阳性率为60%(18/30),在ER阴性组中,PTEN蛋白的阳性率为34.2%(13/38),组间差异有统计学意义(P<0.05),见表2。

表2 PTEN蛋白表达与ER、PR、HER-2的关系(例)
2.3 p53蛋白表达与ER、PR、HER-2的关系p53蛋白在乳腺癌中的表达与组织学分级、腋窝淋巴结转移情况、ER、PR状态有关,与发病年龄、肿瘤大小、临床分期、癌基因HER-2无关。在ER阴性组中p53蛋白的阳性率为63.2%(24/38),明显高于ER阳性组中阳性率[36.7%(11/30)],组间差异有统计学意义(P<0.05);在PR阴性组的p53蛋白阳性率为66.7%(24/36),明显高于PR阳性组中的阳性率[34.4%(11/32)],组间差异有统计学意义(P<0.01),见表3。

表3 p53蛋白表达与ER、PR、HER-2的关系(例)
2.4 EGFR蛋白表达与ER、PR、HER-2的关系EGFR蛋白的表达与乳腺癌组织学分级、腋窝淋巴结转移情况、ER状态、HER-2有关,而与发病年龄、肿瘤大小、临床分期、PR无关。EGFR在ER阴性组阳性率为71.1%(27/38),明显高于ER阳性组的阳性率[43.3%(13/30)],差异有统计学意义(P<0.05);在癌基因HER-2阳性组中,EGFR阳性率为70.3%(26/37),明显高于阴性组中EGFR阳性率[45.2%(14/31)],差异有统计学意义(P<0.05),见表4。
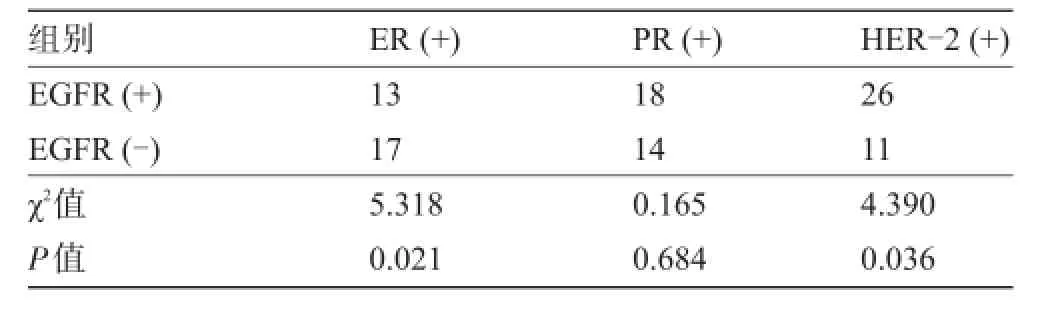
表4 EGFR蛋白表达与ER、PR、HER-2的关系(例)
3 讨论
3.1 PTEN在乳腺癌中的表达与激素受体关系PTEN又称MMACI或TEPI,是1997年由美国三个实验室先后发现的第一个具有磷酸酶活性的抑癌基因,定位于染色体10q23,全长约20 kb,含9个外显子和8个内含子,其cDNA共有1 209个核昔酸,编码403个氨基酸残基组成的蛋白[2]。PTEN蛋白在乳腺癌中的表达缺失率为27.3%~60.0%[3-4]。Depowski等[5]认为PTEN蛋白的低表达是乳腺癌常见的分子事件,而且PTEN蛋白表达缺失与不利的预后因素包括雌孕激素受体阴性、淋巴结转移,以及与乳腺癌存活率明显相关,即PTEN蛋白表达缺失常常与乳腺癌预后不良相联系。研究认为PTEN蛋白表达与ER呈正相关,且PTEN和ER同时阳性表达的乳腺癌患者预后较好[6-7]。Bose等[2]的实验发现PTEN的杂合性丢失与ER表达的缺失高度相关,认为PTEN蛋白下降表达与ER失表达密切相关,而与PR无关。Shoman等[7]的研究也表明在ER阳性乳腺癌中PTEN表达的下调与抗雌激素抵抗之间有非常密切的联系。本研究结果显示:ER阳性组PTEN阳性率高于ER阴性组,差异有统计学意义(P<0.05),提示PTEN表达与ER呈正相关,而与PR、HER-2的表达无关,与上述报道一致。我们推测在乳腺癌的进展和转移过程中,PTEN基因的10q23区的某种特异基因改变或PTEN蛋白的表达缺失与雌激素失调之间存在着一定的相关性。而最近有研究发现AKT激活与PTEN基因的缺失或者HER-2过表达高度正相关,并且与PR呈负相关,认为PTEN基因缺失和HER-2过表达同时出现加强了AKT活性,可能导致PR阴性表达[8]。
3.2 p53 在乳腺癌中的表达与激素受体关系p53基因是人类肿瘤中最频繁突变的抑癌基因,人类p53基因定位于17号染色体短臂1区3.1带(17p13.1),全长16~20 kb,基因组有11个外显子、10个内含子,转录产生的mRNA约2.5 kb。Van't Veer等[9]认为p53基因突变与表达在乳腺癌早期阶段已发生。且随着分级的提高,突变型p53蛋白的表达量也增加。国内[10]也有研究发现突变型p53在良性病变未见阳性表达,随着癌变动态过程(乳腺正常组织-良性增生-原位癌-早期浸润癌-浸润性导管癌)突变型p53的表达在逐渐升高,说明细胞周期调控因子p53基因突变参与了乳腺癌的发生与发展过程,可能是正常乳腺组织癌变的一个早期分子事件。本研究结果显示:乳腺癌中p53表达在ER、PR阴性组阳性率明显高于阳性组,差异有统计学意义(P<0.05),提示p53蛋白表达与ER、PR表达呈负相关,与文献[11]报道一致,推测由于雌激素和孕激素通过活化p53基因而减少乳腺癌发生,p53一旦突变后,雌激素和孕激素则加速乳腺癌发生。而Bourdon等[12]认为野生型p53可通过Scotin-ER途径完成促细胞凋亡过程,所以突变型p53过度表达则意味着ER、PR可能同时丧失了受体活性,导致细胞凋亡过程受抑制并逐步向细胞恶性增殖演变。我们认为乳腺癌是一种激素依赖性肿瘤,雌激素作为刺激乳腺组织分裂增殖的重要因子,在乳腺癌发生发展过程中扮演重要角色。因此乳腺癌中p53蛋白与ER、PR的同时检测对判断预后、指导内分泌治疗具有一定的指导意义。有关p53表达与HER-2的关系,文献[13-14]报道两者在乳腺癌中的表达呈正相关,Bull等[13]的实验观察同时有HER-2扩增和p53突变时,乳腺癌患者复发和死亡危险性增高,它们的共同表达有较高的预后价值。本实验结果显示:p53蛋白表达与HER-2无关(P>0.05),这可能与实验条件、实验方法的不同以及判断阳性标准的不同有关。
3.3 EGFR在乳腺癌中的表达与激素受体关系EGFR是原癌基因C-erbB-1的表达产物,其基因定位于人类第七号染色体短臂上(7p13-p12),它是含有1 186个氨基酸的跨膜糖蛋白,分子量为170 kD,具有酪氨酸激酶活性,是一种跨膜分布的细胞表面传感器。其结构由细胞外区、跨膜区和细胞内区三部分组成:细胞外区为受体部位,由621个氨基酸残基组成;跨膜区由23个氨基酸组成;细胞内区由542个氨基酸组成[15]。多数研究者认为EGFR表达与ER、PR呈负相关[16],与癌基因HER-2表达呈正相关[17-18]。本实验结果为:乳腺癌中EGFR阳性率在ER阴性组为71.1%,明显高于ER阳性组(43.3%),两者比较差异有统计学意义(P<0.05),显示EGFR的表达与ER呈负相关,与上述报道一致。推测EGFR在癌细胞内的活化参与了对ER功能状态的抑制,最终导致其激素依赖性消失,说明EGFR过度表达的乳腺癌其发生、发展可能不依赖女性性激素,因此对化疗及内分泌治疗疗效差、预后不佳。实验结果还显示EGFR阳性率在HER-2阳性组明显高于阴性组,组间差异有统计学意义(P<0.05),表明两者表达呈正相关。Park等[17]的研究表明在HER-2基因扩增的乳腺癌组织中EGFR的蛋白表达也显著增加,认为EGFR在乳腺癌中的表达与原癌基因HER-2的表达高度正相关。HER-2作为乳腺癌预后判断的一项独立因子也已经基本被公认。我们认为HER-2基因与EGFR同属表皮生长因子家族,它们具有同源性,均编码具有酪氨酸激酶活性的细胞膜糖蛋白,因而EGFR和HER-2可能共同参与肿瘤细胞的生长、增殖,两者在乳腺癌的发生发展中起协同作用。
综上所述,肿瘤的发生发展是一个多因素、多阶段的过程,联合检测ER、PR、HER-2、PTEN、p53、EGFR对临床上乳腺癌患者判断预后和靶向治疗有重要临床意义。
[1]Kurose K,Gilley K,Matsumoto S,et a1.Frequent somatic mutations in PTEN and TP53 are mutually exclusive in the stroma of breast carcinomas[J].Nat Genet,2002,32(3):355-357.
[2]Bose S,Crane A,Hibshoosh H,et al.Reduced expression of PTEN correlate with breast cancer progression[J].Hum Pathol,2002,33 (4):405-409.
[3]黄玉钿,张声,郑曦,等.PTEN蛋白表达与乳腺癌增殖、侵袭转移的相关性[J].中国肿瘤生物治疗杂志,2007,14(4):373-376.
[4]Lee JS,Kim HS,Kim YB,et a1.Reduced PTEN expression is associated with poor outcome and angiogenesis in invasive ductal carcinoma of the breast[J].Appl Immunohistochem Mol Morphol,2004, 12(3):205-210.
[5]Depowski PL,Rosenthal SI,Ross JS.Loss of expression of the PTEN gene protein product is associated poor outcome in breast cancer[J].Mod Pathol,2001,14(7):672-676.
[6]Shi W,Zhang X,Pintilie M,et al.Dysregulated PTEN-PKB and negative receptor status in human breast cancer[J].Int J Cancer, 2003,104(2):195-203.
[7]Shoman N,Klassen S,Mc Fadden A,et al.Reduced PTEN expression predicts relapse in patients with breast carcinoma treaed by tamoxifen[J].Modern pathology,2005,18(2):250-259.
[8]Tokunaga E,Oki E,Kimura Y,et al.Coexistence of the loss of heterozygosity at the PTEN locus and HER2 overexpression enhancesthe Akt activity thus leading to a negative progesterone receptor expression in breast carcinoma[J].Breast Cancer Res Treat,2007,101 (3):249-257.
[9]Van't Veer LJ,Dai H,Van de Vijver MJ,et a1.Gene expression profiling predicts clinical outcome of breast cancer[J].Nature,2002, 415(6871):530-536.
[10]孙丽梅,王鲁建,宋敏,等.乳腺癌组织突变型p53和抑癌基因PTEN表达及其临床意义的研究[J].中华肿瘤防治杂志,2008,15 (6):430-433.
[11]Yamashita H,Toyama T,Nishio M,et al.p53 protein accumulation predicts resistance to endocrine therapy and decreased post-relapse survival in metastatic breast cancer[J].Breast Cancer Res,2006,8 (4):48.
[12]Bourdon JC,Renzing J,Robertson PL.et al.Scotin,a novel p53-inducibe proapoptotic protein 1ocated in the ER and the nuc1ear membrane[J].J Cell Biol,2002,158(2):235-246.
[13]Bull SB,Ozcel H,Pinnaduwage D,et al.The combination of p53 mutation and neu/cerbB-2 amplification is associated with poor survival in node-negative breast cancer[J].J Clin Oncol,2004,22(1):86-96.
[14]Yamashita H,Nnisho M,Toyama T,et al,Coexistence of HER2 over-expression and p53 protein accumulation is a strong prognostic molecular marker in breast cancer[J].Breast Cancer Res,2004, 6(l):24-30.
[15]Baselga J.Why the epidermal growth factor receptor?The rationale for cancer therapy[J].Oncologist,2002,7(4):2-8.
[16]Matkovic B,JureticA,Separovic V,et al.Immunohistochemical analysis of ER,PR,HER-2,CK5/6,p63 and EGFR antigen expression in medullary breast cancer[J].Tumori,2008,94(6):838-844.
[17]Park K,Hanb S,Shin E,et al.EGFR gene and protein expression in breast cancers[J].The Journal of Cancer Surgery,2007,1(33): 956-960.
[18]Ana Valdehita,Ana MB,Andrew V,et al.Vasoactive intestinal peptide(VIP)induces transactivation of EGFR and HER-2 in human breast cancer cells[J].Molecular and Cellular Endocrinology,2009, 302:41-48.
Expression of PTEN,p53,EGFR,ER,PR and HER-2 in invasive breast cancer.
TANG Yong-feng1,FENG Xiao-min1,XIE Li-li2.1.Nantong Tichen Health School,Nantong 226007,Jiangsu,CHINA;2.Department of Pathology,Nanjing Maternity and Child Health Care Hospital,Nanjing 210004,Jiangsu,CHINA
ObjectiveTo evaluate the expression and significance of estrogen receptor(ER),progesterone receptor(PR),human epidermal growth factor receptor 2(HER-2),phosphatase and tensin homolog deleted on chromosome ten(PTEN),protein 53(p53)and epithelial growth factor receptor(EGFR)in the invasive breast cancer. MethodsS-P immunohistochemistry was used to detect the expression of ER,PR,HER-2,PTEN,p53 and EGFR in 68 cases of breast cancer and 10 cases of breast fibroadenoma.ResultsThe expression rate of ER,PR,HER-2, PTEN,p53 and EGFR were 44.1%,47.1%,54.4%,45.6%,51.5%and 58.8%,respectively.The expression of PTEN was positively correlated with the expression of ER,and the expression of p53 was negatively correlated with the expression of ER and PR.EGFR expression was negatively correlated with ER expression,while positively correlated with HER-2 expression.ConclusionThe combined detection of ER,PR HER-2,PTEN,p53,EGFR could indicate the prognosis of breast cancer,which plays an important role in individual treatment.
Breast cancer;Estrogen receptor(ER);Human epidermal growth factor receptor 2(HER-2);Protein 53(p53);Epithelial growth factor receptor(EGFR)
R737.9
A
1003—6350(2014)05—0630—04
10.3969/j.issn.1003-6350.2014.05.0247
2013-08-10)
谢莉莉。E-mail:nantongxielili@sina.com