高效液相色谱-蒸发光散射检测薯蓣皂甙元
2014-05-02朱小燕雷新荣严春杰
朱小燕,雷新荣,严春杰,沈 翔
(1.中国地质大学(武汉)材料与化学学院,湖北 武汉 430074;
2.中国地质大学(武汉)纳米矿物材料及应用教育部工程研究中心,湖北 武汉 430074)
薯蓣皂甙元(diosgenin),商品名为薯蓣皂素,简称皂素,分子式C27H42O3,分子结构式见图1,化学名△5-异螺旋甾烯-3β-醇,属异螺旋甾烯烷的衍生物,为薯蓣科薯蓣属植物根茎中薯蓣皂甙的水解产物[1]。
它以糖甙的形式广泛存在于自然界的植物中,尤以薯蓣科含量最多。世界各国生产的甾体激素60%以上用它为原料。甾体激素应用广泛,目前,大约有400多种药物以薯蓣皂素为生产原料或中间体[2]。我国薯蓣皂素年产量4 000t以上,占全球产量的90%,其中2/3用于直接出口[3]。利用黄姜生产薯蓣皂甙元的制备方法包括酸水解法、物理分离法、自法和超声发酵法、酶水解法、超临界流体萃取法等[4]。
1 薯蓣皂甙元检测方法简述
当前薯蓣皂素价格约95万元/吨[3]。测试方法的不同及结果的偏差都会带来贸易的纠纷。因此,具体工作中选择何种方法检测是一个需要考虑的问题。国内外报道的薯蓣皂甙元检测方法早有重量法[5]、薄层比色法[6]、紫外分光光度法[7]、旋光法[8]、红外光谱结合核磁共振的方法[9]、薄层扫描法[10]、气相色谱法(GC)[11]、高效液相色谱法(HPLC)[12]等。2002 年陕西省依据此发布《黄姜薯蓣皂素》DB61/T 302—2002的地方标准,该标准即以皂素熔点的高低作为判断黄姜皂素合格与否、优质与否的重要判断依据。但缺点是时间长,易造成观测误差,仪器造成的系统误差较大,人为因素较多,产生了定性不准的缺点[13]。
图1 皂素分子结构
高效液相色谱法测定薯蓣皂甙元含量不需要进行分离,也不需要进行衍生化,减少了检测操作步骤,且测试更快更准,被越来越广泛地应用于薯蓣皂素的检测[4]。对薯蓣皂甙元检测分析的研究目前多采用此法,采用正相或反相色谱法,二者均采用末端吸收波长进行检测[14]。早期多采用正相色谱法,现在反相色谱法应用最为广泛(约占HPLC分离分析的70%~80%[15]),因为反相色谱法在近紫外区透明度较好,背景吸收相对较低。但,如果样品在紫外光区的吸收信号太弱,流动相对其影响较明显。
蒸发光散射检测器(ELSD)可用来测定那些不能用紫外检测器、荧光检测器检测的组分,消除了常见于传统HPLC检测方法中的难点,它的响应不依赖样品的光学特性,任何挥发性低于流动相的样品均能被检测,不受其官能团的影响。因此,本文尝试建立薯蓣皂甙元的HPLC-ELSD分析方法,并将此方法与已有文献中所用的高效液相色谱法作对比,使学生更深入地理解HPLC测试及数据处理的方式方法。本文所采用方法快速、方便、准确度高,也适合于用户的测试需求。
2 实验
2.1 主要实验仪器和试剂
仪器:Dionex p680液相色谱仪;AllTECH 蒸发光散射检测器ELSD2000。
试剂:HPLC分析用甲醇为色谱纯;HPLC分析用水(18.2MΩ·cm,总有机碳量为3mg/L)由 Millipore纯水机制备;皂素标样购自于北京恒元启天化工技术研究院;其他化学试剂均为分析纯,一般用水为去离子水;薯蓣皂甙元产品利用环保酸浸法从黄姜中提取获得[16],制得薯蓣皂甙元含量不同的3个样品记为Sample1、Sample2、Sample3。
2.2 实验方法
2.2.1 标准溶液的配制
准确称取皂素200mg用色谱级甲醇溶于10mL容量瓶中,作为母液;从母液中移取0.5、1、1.5、2mL溶于10mL容量瓶中定容,经0.45μm微孔滤膜过滤,测试。
2.2.2 样品溶液配制
称 取 Sample1、Sample2、Sample3 3 种 样 品 各0.02g定容于10mL容量瓶中,利用乙醇溶解;从10 mL中分别取1mL定容于10mL容量瓶中,甲醇定容,经0.45μm微孔滤膜过滤。用Dionex p680液相色谱仪和AllTECH蒸发光散射检测器ELSD2000进行测试。
2.2.3 HPLC-ELSD分析条件
色谱柱:ZORBAX SB-C18(4.6mm×150mm,5μm),柱温28℃,进样量10μL。
流动相:V(水)/V(乙腈)=1 090(等梯度)。
ELSD:气 流 流 速 1.2mL/min,漂 移 管 温 度80℃。
2.2.4 常规HPLC方法对比测试
样品制成0.5g/L溶液与标样(对照品)注入液相色谱仪检测含量。采用文献[13]的检测条件:流动相:V(甲醇)∶V(水)=84∶16,流速为1.0mL/min;进样量为20μL;检出波长为210nm[13]。检测柱:C18反相柱。仪器为Agilent1220型高效液相色谱仪。
3 结果与讨论
3.1 流动相的选择
选用V(甲醇)∶V(水)=95∶5[17],V(甲醇)∶V(水)∶V(乙腈=30∶20∶50)[18],V(乙腈)∶V(水)=90∶10[19],V(石油醚)∶V(异丙醇)=98∶2[20]为流动相进行比较。结果表明:水和甲醇的流动相中,溶剂甲醇有较大的背景吸收,因此灵敏度较低;采用10%水和90%乙腈等梯度洗脱程序时,峰形对称性好,分析效果最为理想。
3.2 工作曲线
按2.2.3节的HPLC条件,分别将质量浓度配制成0.1、0.2、0.3、0.4g/L的标准溶液系列样品进样。每个浓度平均测试5次,以皂素的峰面积为纵坐标,以皂素的质量浓度为横坐标绘制工作曲线(见图2),得到线性方程y=138.5x-3.280,R2为0.996,y为面积,x为标样质量浓度,R为相关系数。

图2 薯蓣皂素工作曲线
3.3 样品的 HPLC-ELSD测试
按2.2.2节方法制备样品溶液,并按2.2.3节方法测定。色谱图见图3,测定结果表明,3个样品中薯蓣皂甙元的含量(质量分数)如表1所示。5次测定值的相对标准偏差为1.2%。

图3 样品Sample1、Sample2、Sample3的 HPLC-ELSD色谱图

表1 样品的HPLC-ELSD的测试
3.4 样品的HPLC对比测试及其存在的问题
按2.2.4节的 HPLC条件,分别将标准样品(STANDARD SAMPLE)按质量浓度配制成0.1、0.2、0.3、0.4g/L的标准溶液系列样品进样。通常,学生所得数据无法得到较好的拟合标准曲线。于是,学生将标样及3种样品都配制成0.2g/L进行直接测试,得到图谱见图4。并且,按文献[21]所提供的公式计算:

其中,cx供测试品的质量浓度,cR对照品的质量浓度,Ax供测试品的峰面积,AR对照品的峰面积,mR对照品质量,mx供测试品质量。
按式(2)计算得到的Sample1、Sample2和Sample3薯蓣皂甙元的质量分数分别为36.65%,28.81%和21.84%。与HPLC-ELSD方法所测的结果相差太大。主要原因是:①样品在210nm处紫外吸收太弱,数据信号不强;②计算公式(2)不可以直接应用,因为,峰面积与含量之间对应并不是1∶1的关系,而是以一定系数的线性方程所得。因此,利用HPLC测试皂素的数据在实际应用中存在着较大的问题,而利用HPLC-ELSD测试ELSD的优势得到体现。
4 结论
本文建立了黄姜皂素产品中皂素测定的高效液相色谱-蒸发光散射检测方法,消除了样品紫外吸收弱的影响,提高了定量的准确性。通过对比测试,让学生理解了HPLC测试过程及数据处理中应该注意的问题。而且该方法操作简便,省去了固相萃取步骤,缩短了检测周期,也可满足实际检测工作的需要。
(
)
[1]Mi Wei,Yun Bai,Mingzhang A,et al.Novel method utilizing microbial treatment for cleaner production of diosgenin from Dioscorea zingiberensis C H Wright(DZW)[J].Bioresource Technology,2013(146):549-555.
[2]沈晖,赵丛丛,岳玉琴,等.薯蓣皂素清洁化生产工艺与传统酸水解法的比较[J].食品工业,2012,33(6):35-37.
[3]上海有机化学研究所.上海有机所研发降解剑麻皂素洁净新技术[EB/OL].[2013-04-03].http://www.cas.cn/ky/kyjz/201304/t20130403_3813506.shtml.
[4]Linli Qiu,Hai Niu,Wen Huang.Ultrasonic and fermented pretreatment technology for diosgenin production from Diosorea zingiberensis C H Wright[J].Chemical Engineering Research and Design[J].2011(89):239-247.
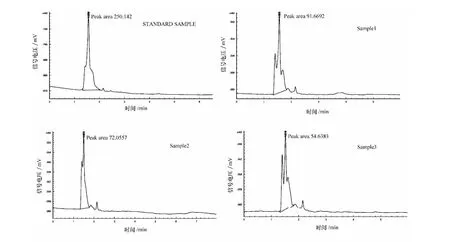
图4 样品Sample1、Sample2、Sample3及STANDARD SAMPLE的HPLC色谱图
[5]黄娟萍.黄姜皂素重量测定法存在问题及原因探析[J].科学之友,2013(8):27-28.
[6]徐礼燊,刘爱茹.皂甙元分析方法的研究[J].化学学报,1977,35(3):239-242.
[7]沈晖,赵丛丛,刘曾,等.紫外分光光度法测定薯蓣皂甙元含量的研究[J].食品研究与开发,2013,34(7):107-110.
[8]江天生.旋光法测定薯蓣皂甙元含量[J].吉首大学学报:自然科学版,1997,18(2):63-64.
[9]金志敏,张静夏,罗美凤,等.多羟基甾醇25(R)-异螺甾环-5-烯-2β,3α,19-三醇的合成[J].有机化学,2007,29(9):1142-1146.
[10]魏永春,李谦,李明静,等.黄姜中薯蓣皂苷元的薄层扫描法测定[J].分析试验室,2006,25(11):67-69.
[11]都述虎,王晓华,夏重道.穿龙薯蓣中薯蓣皂甙元毛细管气相色谱法研究[J].药物分析杂志,2001,21(2):116-119.
[12]彭红霞,鲍建国,彭月娥.超声提取-反相高效液相色谱法测定黄姜中薯蓣皂甙元[J].光谱实验室,2010,27(3):961-965.
[13]郝江山,王碧军.黄姜皂素中皂素含量检验方法的探讨[J].现代科学仪器,2010(3):98-99.
[14]Oncina R,BotõÂa J M,Del RõÂo J A,et al.Bioproduction of di-osgenin in callus cultures of Trigonella foenum-graecum[J].Food chemistry,2000(70):489-492.
[15]Jaime Niño,Diego A Jiménez,Oscar M Mosquera,et al.Diosgenin quantification by HPLC in a dioscorea polygonoides tuber collection from colombian flora[J].Journal of Brazil Chemical Society,2007,18(5):1073-1076.
[16]Wen Huang,Huazhang Zhao,Jinren Ni,et al.The best utilization of D zingiberensis C H Wright by an eco-friendly process[J].Bioresource Technology,2008(99):7407-7411.
[17]杨文远,熊楚明.反相高效液相色谱法测定中药中薯蓣皂苷元[J].分析试验室,2002,21(1):74-75.
[18]阳波,李湘斌.HPLC测定地奥心血康胶囊中薯蓣皂苷元的含量[J].中国中药杂志,2006,31(7):605-606.
[19]周娟,王野,高向军,等.金刚藤泡腾片的薄层鉴别及薯蓣皂苷元的含量测定[J].华西药学杂志,2006,21(4):386-387.
[20]李卓,危当恒.高效液相色谱法测定地奥心血康胶囊中薯蓣皂苷元的含量[J].中国药房,2007,18(6):449-450.
[21]皂 素 质 量 标 准 (试 行)[S/OL].[2013-08-20].http://wenku.baidu.com/view/c5b41fc589eb172ded63b7a4.html.
