载银水凝胶或载抗生素壳聚糖水凝胶在抑菌性能和细胞毒性方面的研究*
2014-05-02伍芳何静吴尧吴方
伍芳 何静 吴尧 吴方*
论著·实验研究
载银水凝胶或载抗生素壳聚糖水凝胶在抑菌性能和细胞毒性方面的研究*
伍芳 何静 吴尧 吴方*
目的研究壳聚糖水凝胶,壳聚糖载银水凝胶和壳聚糖载抗生素水凝胶短期的抑菌功效和细胞毒性。方法通过添加交联剂后制备壳聚糖水凝胶,并有效装载银离子或硫酸庆大霉素。进行抑菌实验和累计释放实验了解壳聚糖基水凝胶的抗菌性能和药物控释性。通过使用材料的浸提液检测这三种水凝胶的细胞毒性。结果抑菌实验结果表明壳聚糖水凝胶,壳聚糖载银水凝胶和壳聚糖载抗生素水凝胶均能有效抑制金黄色葡萄球菌的增殖。且壳聚糖载抗生素水凝胶具有最佳的抑菌性能且极大地抑制了生物膜的形成。体外药物释放显示抗生素在7天内的累计释放多于60%;而银离子的释放低于10%。细胞毒性实验表明这三个凝胶材料无明显细胞毒性。结论壳聚糖基水凝胶具有良好的短期抑菌效果,可降解,且无明显细胞毒性,在骨科应用方面有着巨大的前景。
壳聚糖;水凝胶;抑菌性能;细胞毒性
引言
目前骨科领域抑菌材料的研究主要集中在抑菌剂的持续释放和长期抑菌效能[1-3]。然而,在非骨水泥型假体的置换应用中,术后最初几天的微生物感染风险最高,因而材料的短期抑菌性能更关键,而且抑菌成分的持续释放有可能影响植入体材料的生物学功能。骨植入体的早期固定和新生骨的快速形成不仅对病人的早期康复很关键,而且也能增加人工骨的使用寿命。因此,构建一种具有短期 (3~5天)抑菌效果和较低细胞毒性的生物材料在医学研究和临床治疗等领域中具有极大的应用前景。
壳聚糖(chitosan)具有较低的细胞毒性、可降解性、良好的抑菌性能,因而被广泛使用在生物医药应用方面[3-5]。最近,我们报道了在羟基磷灰石涂层表面覆着一层壳聚糖膜,在合适的浓度范围内,壳聚糖能兼顾优良的生物相容性和良好的抑菌效果[4]。然而,该壳聚糖膜只在第一天内对细菌有抑制作用,时间太短而缺乏实际的临床应用意义。水凝胶形式的壳聚糖能在3~5天内抑制细菌增殖,且具有适当的降解率,因而能有效解决上述问题。
在本研究中,我们选用水溶性壳聚糖,在京尼平的交联作用下形成壳聚糖水凝胶,添加硝酸银/硫酸庆大霉素等抗菌成分后制备得到载银水凝胶和载抗生素水凝胶。系统而全面地测试这三种壳聚糖基材料的短期抑菌性能和细胞毒性。
1 材料与方法
1.1 实验仪器及材料
酶联免疫检测仪 (Bio-Rad550);电感耦合等离子体-原子发射光谱仪 (Thermo Scientific-IRIS Adv.);UV-VIS分光光度仪(PerkinElmer-Lambda650);SEM(S4800,HitachiLtd, Japan);水溶性壳聚糖 (羧甲基壳聚糖,浙江澳兴生物科技有限公司);磷酸盐缓冲溶液(PBS,Sigma);硝酸银(Sigma);京尼平(临川之信生物科技公司);硫酸庆大霉素(GS,奥克生物科技有限公司);二苯基四氮唑溴盐 (MTT,Sigma)。
1.2 含有不同抑菌剂的壳聚糖水凝胶的制备与表征
用无菌超纯水在无菌超净台里配置0.1 M AgNO3、2 wt %GS和3瓶50g/L的水溶性壳聚糖溶液。在其中两瓶壳聚糖溶液中分别加入AgNO3,GS溶液,搅拌均匀。最后在3瓶壳聚糖溶液中均加入京尼平溶液,使得京尼平与壳聚糖的质量比为1∶100。将配好材料在37°C放置24小时,形成凝胶。这三种材料分别用chitosan、chitosan-Ag+、chitosan-GS表示。以不含凝胶材料的空白孔作为空白对照组(control组)。使用尼康数码相机 (COOLPIX S70,Japan)记录三种材料形成凝胶前后的形貌变化。
1.3 抑菌样本制备
本研究选用金黄色葡萄球菌Staphylococcus aureus(ATCC 25923)评估已制备的三种凝胶材料的抑菌性能。在形成凝胶前,分别取0.5 ml样品于24孔板中静置24小时。其中以不含凝胶材料的空白孔作为空白对照组 (control组)。然后取1ml密度为1~2×106CFUs/ml的S.aureus菌液接种于凝胶材料上培养1、3、5天。然后在每孔中加入200 lMTT液,继续培养4小时后,加入1mlDMSO液,于波长490nm条件下在酶标仪上测得吸光值 (OD值)。
1.4 菌体形貌研究
采用SEM对这三个样品表面的细菌形貌进行观察。在培养1天后,将细菌样品用2.5%的戊二醛固定过夜,经过脱水、脱醇处理,喷金并观察细菌形貌。
通过普通数码相机观察材料表面的细菌菌落形貌。将细菌培养在含有凝胶材料的直径为35 mm的玻底皿中,其中以不含凝胶材料的空白玻底皿作为空白对照组(control组)。在37°C培养箱中培养1、3、5天后,用普通相机观察细菌生物膜的形成情况。
1.5 抑菌剂的释放动力学
分别取0.5ml载抗生素或载银壳聚糖水凝胶于不同的离心管中,静置24小时后。加入16mlPBS(pH=7.4)并置于恒温摇床,摇速和温度分别保持在100 rpm和37°C。定时取出1 ml上清液,用离心管收集,并在释放介质中添加1 ml新鲜的PBS。使用UV-VIS分光光度仪(PerkinElmer-Lambda650)测量上清液中抗生素的含量。采用电感耦合等离子体-原子发射光谱仪 (Thermo Scientific-IRIS Adv.)测得银离子的浓度。
1.6 体外浸提液毒性观察
本文参照 ISO 10993-5的标准,对 chitosan、chitosan-Ag+、chitosan-GS进行细胞毒性研究。按材料重量与浸提介质体积为0.2g/ml的比例加入含10%血清的 -MEM(Hyclone)培养基,于37°C中浸提24小时。将此浸提原液与含10%血清的 -MEM培养基 (V/V=1∶0,V/V=1∶1,V/V=1∶3)混合,得到100%、50%、25%浓度的浸提液。取100l密度为50000个/ml的MC3T3-E1细胞悬浮液于96孔板培养24小时后,弃去培养液,用不同浓度的浸提稀释液继续培养1天。以含10%血清的 -MEM培养液培养的细胞作为空白对照 (control组)。采用MTT法在490nm波长处,测得其吸光值。
2 结果
2.1 凝胶表征
在形成凝胶前,三种材料(chitosan、chitosan-Ag+、chitosan-GS)分别呈现淡黄色,乳白色和黄色(图1,彩图见插页)。而在形成凝胶后,所有的样品均转变为深蓝色或者灰色。

图1 壳聚糖基样品在形成凝胶前后的形貌:a形成凝胶前;b形成凝胶后(1)chitosan;(2)chitosan-Ag+;(3)chitosan-GS
2.2 抑菌性能分析
S.aureus在材料上培养1、3、5天后,这三个凝胶样品组的OD值明显低于空白组的OD值(图2),表明所制备的壳聚糖复合材料均有一定的抑菌行为。在壳聚糖水凝胶中添加抗菌剂后,抑菌性能显著提高。在任意时刻,chitosan-GS样品组的OD值最低。随着时间的延长,chitosan组的吸光值逐渐降低。

图2 三种不同凝胶体系的抑菌性能
3.3 细菌形貌分析
如图3所示,空白孔表面有大量的金黄色葡萄球菌聚集而形成生物膜。载银的壳聚糖水凝胶表面的细菌数量显著降低,在载抗生素水凝胶上没有发现细菌。

图3 金黄色葡萄球菌在不同凝胶材料上培养一天的SEM图。(a,e) control;(b,f)chitosan;(c,g)chitosan-Ag+;(d,h)chitosan-GS
如图4所示(彩图见插页),空白孔中存在大量的白色的沉淀物 (即细菌菌落)。在实验的任意时间点,纯的壳聚糖水凝胶上仅发现少量的白色沉淀,说明壳聚糖能抑制生物膜的形成。在第1天时,载银水凝胶上没有白色的沉积物,但在第5天时该样品上开始出现白色沉淀。而载抗生素水凝胶组在1、3、5天时均没有发现白色沉淀。以上的结果与MTT抑菌结果相符合,进一步证实壳聚糖载抗生素水凝胶具有最优的抑菌效果。此外,在第3天后,壳聚糖基水凝胶结构开始降解。

图4 金黄色葡萄球菌菌落在凝胶样品上培养1、3、5天的形成情况。(a)control;(b)chitosan;(c)chitosan-Ag+;(d)chitosan-GS
3.4 抗菌剂的释放动力学分析
从累计释放曲线可以看出(图5,彩图见插页),抗生素在84小时内具有"突释"效应,药物释放速度较快,而后呈平稳缓慢释放,载抗生素水凝胶7天内药物释放多于60%。与抗生素的释放速率相比,银离子的释放相对缓慢。在7天内,从壳聚糖水凝胶中释放出来的银离子不足10%。

图5 抗生素和银离子的累积释放曲线
3.5 细胞毒性研究
从图6所示,在100%浓度时,纯的壳聚糖水凝胶组的OD值较空白对照组的OD值高,表明纯的壳聚糖水凝胶组的浸提原液没有细胞毒性。而空白组,壳聚糖载银组和壳聚糖载抗生素组的细胞增殖能力并无明显区别。随着浸提原液稀释后,这三种不同凝胶组的细胞增殖水平均高于空白组,表明了这三种材料无明显细胞毒性。
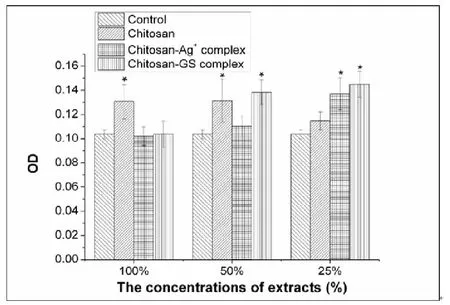
图6 凝胶材料不同浸提液浓度的细胞毒性研究。*表示样品组相对空白对照组而言,具有显著性差异(P<0.05)
3 讨论
京尼平是一种天然的生物交联剂,能交联含有氨基官能团的生物聚合物 (如壳聚糖、硫酸庆大霉素),其毒性远低于戊二醛[6]。chitosan样品和chitosan-Ag+样品在室温下放置6个小时,便能观测到凝胶的形成 (图1b),而 chitosan-GS需要约10个小时才能形成凝胶。原因可能在于京尼平与抗生素之间发生化学反应,形成深蓝色物质,从而降低了与壳聚糖交联的京尼平含量,导致需要更长的时间形成壳聚糖基水凝胶。壳聚糖富含羟基和氨基官能团,通过离子交换、吸附和螯合,壳聚糖能结合金属离子[7]。我们选取的水溶性的碱性壳聚糖,能与AgNO3反应形成乳白色的物质 (图1a)。
MTT结果(图2)、SEM结果(图3)和生物膜形成结果(图4)表明了壳聚糖基水凝胶极大地抑制了 S.aureus的增殖。壳聚糖的抑菌机理主要是通过其聚阳离子性能 (NH2+)损害细菌的细胞膜,从而有效抑制细菌[8]。添加Ag+或抗生素后,壳聚糖基水凝胶的抑菌性能显著增强,且能明显抑制细菌生物膜的行成。chitosan-GS样品具有最佳的抑菌性能且能有效抑制生物膜的形成(长达5天)。随着时间延长,纯的壳聚糖水凝胶样品的抑菌能力一直增加。很可能是因为凝胶结构的物理降解 (图 4),使得更多的壳聚糖的活性基团(NH2+)暴露出来,增强了壳聚糖的抑菌能力。
释放结果 (图5)表明壳聚糖能有效装载抗生素和银离子。抑菌成分通过与京尼平或壳聚糖发生化学反应共价结合,能在凝胶中能滞留更长时间。然而在第3天后,壳聚糖基水凝胶的结构开始降解(图4)。因此,采用可降解的壳聚糖在短期能 (3~5天内)极大地抑制S.aureus的增殖和生物膜的形成。在细胞毒性实验中(图6),所制备的这三个凝胶材料无明显细胞毒性。
本文所制备的这三个凝胶样品无明显细胞毒性。壳聚糖载抗生素水凝胶具有最佳的抑菌效果,且能有效抑制金黄色葡萄球菌生物膜的形成。总之,具有短期抑菌性能和较低细胞毒性的壳聚糖基水凝胶在骨科应用方面有着巨大的应用前景。然而降低材料的细胞毒性仅是应用于临床的第一步,其次还需要提高植入体材料的生物相容性、骨结合能力等。该壳聚糖基水凝胶能赋予植入器械抑菌和较低细胞毒性两大功效,可进一步提高现有植入体的安全性和成功率,满足临床需要的短期抑菌效果。
[1] Damm C,Münstedt H,Rosch A.Long-term antimicrobial polyamide 6/silver-nanocomposites[J].JMater Sci,2007,42(15):6067-6073.
[2] Baro M,Sánchez E,Delgado A,et al.In vitro-in vivo characterization of gentamicin bone implants[J].J Controlled Release, 2002,83(3):353-364.
[3] Cao Z,Sun Y.Chitosan-based rechargeable long-term antimicrobial and biofilm-controlling systems[J].J Biomed Mater Res A, 2009,89A(4):960-967.
[4] Song L,Gan L,Xiao YF,et al.Antibacterial hydroxyapatite/chitosan complexcoatings with superior osteoblastic cell response[J]. Mater Lett,2011,65(6):974-977.
[5] ZhengLY,ZhuJF.Studyon antimicrobial activity ofchitosan with different molecular weights[J].Carbohydr Polym,2003,54(4): 527-530.
[6] Moura MJ,Figueiredo MM,Gil MH.Rheological Study of Genipin Cross-Linked Chitosan Hydrogels[J].Biomacromolecules, 2007,8(12):3823-3829.
[7] Murugadoss A,Arun C.A'green'chitosan-silver nanoparticle composite as a heterogeneous as well as micro-heterogeneous catalyst [J].Nanotechnology,2008,19(1):015603.
[8] Chung YC,Chen CY.Antibacterial characteristics and activity of acid-soluble chitosan[J].Bioresource Technol,2008,99(8): 2806-2814.
The research of Ag+or antibiotic loaded chitosan hydrogels on antibacterial efficacy and cytocompatibility
Wu Fang,He Jing,Wu Yao,et al.Engineering Research Center for Biomaterials,Sichuan University,Chengdu,610064, China
Objective Chitosan hydrogels,alone and with the loading of different antibacterial agents(Ag+and GS),were prepared in this study and their short-term antibacterial activity and cytotoxicity were systematically examined.Methods We selected water-soluble chitosan derivative formed hydrogel using genipin as the crosslinking agent,alone and with the additional incorporations of silver nitrate or gentamycin sulfate.We studied the cumulative release profile of antibacterial ingredients from the chitosan hydrogel.S.aureus was selected to systematically test the antibacterial efficacies and cytotoxicity of the three chitosan based antibacterial materials.Results The antibacterial tests showed that all three hydrogels achieved antibacterial activities on S.aureus,with the chitosan-GS hydrogel showing the best antibacterial efficacy and inhibition on biofilm formation.In vitro release showed that more than 60%of the entrapped antibiotics in hydrogel had been released,while less than 10%of the entrapped Ag+had been released within 7 days.The cytotoxicity tests also indicated all three materials were highly cytocompatible for MC3T3-E1 cells.Conclusion Chitosan based hydrogels have great potential in orthopedic applications,with combined short-term antibacterial efficacy,biodegradable and excellent biocompatibility on MC3T3-E1 osteoblasts.
Chitosan;Biofilm;Cytotoxicity
R318.08
A
10.3969/j.issn.1672-5972.2014.05.001
swgk2014-04-0057
伍芳(1989-)女,硕士研究生。研究方向:生物材料。
*[通讯作者]吴方(1972-)男,教授、博士生导师。主要研究方向:生物材料。
2014-04-11)
国家重点基础研究项目(973计划)(No.2012cb619103);国家自然科学基金(No.31170922);教育部新世纪优秀人才支持计划(NCET-12-0387);国家科技部支撑计划项目(No.2012BAI17B06)资助
四川大学生物材料工程研究中心,四川成都610064
