红树林、海草床和珊瑚礁三大典型海洋生态系统功能关联性研究及展望*
2014-05-01汤坤贤林河山傅世锋陈庆辉
宋 晖,汤坤贤,林河山,陈 鹏,傅世锋,陈庆辉,张 悦
(1.国家海洋局第三海洋研究所 厦门 361005;2.国家海洋局海岛研究中心 平潭 350400)
红树林、海草床和珊瑚礁三大典型海洋生态系统功能关联性研究及展望*
宋 晖1,汤坤贤1,林河山2,陈 鹏1,傅世锋1,陈庆辉1,张 悦1
(1.国家海洋局第三海洋研究所 厦门 361005;2.国家海洋局海岛研究中心 平潭 350400)
红树林、海草床和珊瑚礁三大典型系统的分布区域既接近而又相互独立,其独具特色的生态位和环境特征致使他们在功能上又相互依存。目前对于三大典型生态系统的关联性研究主要以鱼类资源的结构和生物量分布、营养级结构和岸线保护等领域展开。三大系统之间的关联性因地域、各个系统所处的状态以及系统自身的结构特征的差异而有所不同,因此研究成果具有较大的区域特征。目前,研究已经开始从简单的定性研究逐步往定量研究发展,但是由于研究技术和方法的差异性,地域间的可比性还有待加强。作为我国海岸带资源的重要组成部分,三大系统之间的关联性研究还较为薄弱。基于此,针对我国三大生态资源的现状开展相关研究,并制定相关的恢复和保护的技术对策,可为我国三大典型海洋生态资源的可持续发展和利用提供有力的技术支撑。
红树林;珊瑚礁;海草床;功能关联性;海洋典型生态系统
红树林和珊瑚礁同属最具生命力的四大海洋生态系统,海草床随着其生态和经济价值的发掘,其重要的价值与意义也普遍被学者和政府主管部门关注,目前被统称为三大典型海洋生态系统。三大典型海洋生态系统,是成千上万动植物赖以生存的重要资源,是巨大的海洋生物基因库,自身具有很高的生态经济价值,同时具有防止海岸侵蚀、吸收海浪能量、发展海洋生态养殖业等方面的功能,在海洋生态环境的保护和维护中具有重要的生态功能和经济价值。他们共同具有高生产力、生物多样性丰富和结构复杂等特点[1]。三大典型生态系统是在海岸带分布的重要生态资源,目前三大典型生态系统的价值评估和功能研究一般相互独立,而对三大系统之间的相互联系以及相互依存性关注不足。因此,本研究通过近年来国内外对三大系统之间的功能关联性及研究成果进行综述,从而对三大系统的可持续发展和管理对策提供技术支持。
1 红树林、海草床以及珊瑚礁三大典型生态系统相互依存,共生共栖
红树林和海草床共生共存。红树林多分布于隐蔽避风的淤泥质滩地上,如海滩、河口、潟湖以及近岛屿,分布特点与海滩潮汐的成带特点相一致。红树植物的根系十分发达,盘根错节屹立于滩涂之中。陆地径流带来的丰富营养物质,在通过红树林时被吸收、过滤和沉淀,径流水质在达到海草床之前得到改善。海草是一种根茎植物,生长于近海海岸淤泥质或沙质沉积物上,可捉紧泥土,减弱海浪冲击力。当海潮上涌,经过海草床时,海流减速,海流携带的泥沙沉降,与处于有庇护环境下的红树林相比,经常被大浪和急流淹没的红树林将损失更多的凋零物。海草床为红树林的生长提供一片静流区,促进了红树林的繁荣生长[2-3]。
红树林和海草床使珊瑚礁远离过量的营养物质和沉积物的负载,同时为珊瑚礁供应必需的营养物质。红树林、海草床和珊瑚礁在生长的地理位置上并不总是互相临近的。然而,3个生态系统重要的生物和物理的相互作用已经引起了众多学者的研究[4]。与能在富含营养的咸水水域蓬勃生长的红树林不同,珊瑚礁则只能在透明度高、营养相对少的水域生长。河流入海处,海水盐度低,泥沙含量大,混浊度高,海水透明度低,会使珊瑚窒息而死,所以有大量泥沙入海的河口处一般不发育岸礁。红树林能净化受到淤泥、人为排放污染物和营养物质而污染的水体,为珊瑚茁壮成长提供良好的水体环境。海草床同样能起到一定的过滤功能。海草床在红树林和珊瑚礁相互作用间起到重要的缓冲作用。在水流到达珊瑚礁前,海草床能使水流速度放缓,导致悬移质泥沙沉淀下来,使覆盖到珊瑚上的泥沙减少,并且过滤营养物和沉积物,改善水质,从而有利于珊瑚生存。
同时,珊瑚礁具有防波堤的功能,是抵消海浪能量的缓冲区,经过珊瑚礁到达海草床以及红树林的潮水能量被降低,在与海草共同作用下,保护了红树林的根不被湍急的波流伤害并通过增加沉降帮助红树林播种繁殖。
总之,三大系统在不同的生态位上为彼此提供有力的生存空间,而他们的共同作用对维护岸线的稳定发挥了重要的作用。三大系统之间的相互依存关系如图1所示。
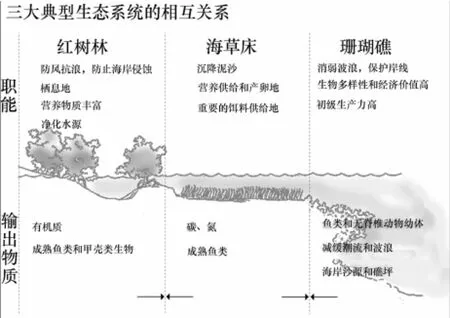
图1 红树林、海草床和珊瑚礁关系及物质交流[5]
2 红树林、海草床和珊瑚礁共同为众多经济鱼类提供孕育场所和栖息地
红树林、海草床和珊瑚礁三大典型生态系统以其生物多样性著称,而珊瑚礁的生物多样性是最丰富的,它被誉为“海洋中的热带雨林”和“蓝色沙漠中的绿洲”,珊瑚虫在虫黄藻的帮助下可以捕捉并且重复利用那些几乎流失在水中的营养物质。珊瑚礁生态系统为众多具有商业价值的鱼类提供了食物来源和繁殖成长的场所,健康的珊瑚礁系统每年渔业产量达35 t/km2,全球约10%的渔业产量源于珊瑚礁地区。因此,珊瑚礁生态系统对于经济鱼类重要性的研究已经较为成熟。但是,加勒比海域、印度洋海域和太平洋海域诸多研究表明,红树林和海草床也是众多珊瑚礁鱼类在幼年时期的繁殖地和栖息地,红树林和海草床生态系统的功能和状态对珊瑚礁鱼类种群结构和生物量具有重大的影响,邻近两大系统的珊瑚礁鱼类资源的种类丰富度和生物量远比没有他们存在的更大。研究也表明,邻近的红树林或者海草床系统的破坏会对珊瑚礁鱼类资源造成直接的不良影响[6-8]。
红树林和海草床对于珊瑚礁鱼类的影响关系主要是基于他们可以作为鱼类的避难所、摄食场和产卵地等因素:①红树林和海草床复杂的群落结构为鱼类资源提供了良好的隐蔽场地,降低了被捕食的几率;②红树林和海草床为鱼类生长提供了丰富的饵料;③红树林和海草床相比珊瑚礁一般领域面积更大,在一定程度上能够截留更多的鱼仔[9-10]。
三大系统的分布位置、距离大小及其生态健康状态等都对鱼类资源的种类、密度、生物量和群落结构产生影响。目前,研究主要集中在加勒比海地区、印度洋以及西太平洋地区,品种繁多并且巨大数量的河口/珊瑚礁鱼类栖息在红树林和海草床之中。对伯利兹和墨西哥沿海的珊瑚礁所做的一项研究显示,珊瑚礁鱼类的群落结构和多样性非常依赖于红树林。红树林的培育使得一些具有重要商业价值的鱼类的生物量加倍,并使得珊瑚礁鱼群落的多样性得到加强。红树林的丧失以一种直接的方式影响珊瑚鱼的生存。研究人员发现,位于红树林附近的珊瑚礁中的鱼类数量,远远高出远离红树林的珊瑚礁,差距可达两倍之多[11]。
红树林、海草床和珊瑚礁对鱼类资源的贡献对于不同的鱼类以及鱼类的不同生长周期发挥不同的作用,为协同作用或者决定作用,影响力的方式及大小因不同的区域及鱼类的生活方式而定,目前还没有统一的定论[12]。Nagelkerken等[13]。研究表明,虽然大部分种类的鱼都有特定偏好的栖息地,但是在他们的一生中却有可能使用多种生境。许多鱼类都出生在海草床并且生长在那里,直到海草无法提供遮蔽让他们躲避掠食者。随后他们迁移到红树林继续发育,更为成熟时则迁移到珊瑚礁。从研究人员观测的14种珊瑚礁类幼鱼研究资料表明,红树林、海草床和0~3 m水深生长的浅水珊瑚,是这3类生态系统结合最紧密的区域。红树林和海草床幼鱼数量十分密集,他们联合作用为珊瑚礁鱼类提供了幼鱼的孕育场所。对于大多数的珊瑚礁鱼类,幼鱼出没在浅水生境而成鱼则出没在(深水的)珊瑚礁处。海草床拦截了大量的幼鱼并为他们提供丰富的食物和庇护所。当他们成熟后,这些鱼类最终将迁徙到近岸的岸礁和离岸的珊瑚礁,所以在红树林和海草床很少见到成鱼。对于以潟湖为栖息地的物种,此类栖息地必须提供足够的优势,来抵消鱼类迁徙到珊瑚礁和潟湖与随后返回繁衍时的能源耗费和在这个过程中幼仔被捕食的风险[14]。Shulman,Sweatman和Robertson认为,与生活在珊瑚礁边相比,以海草床作为庇护所至少能减少幼鱼被捕食的可能性。随着新成员越长越大,海草叶不再能够提供隐蔽,但是这时动物已经成长,游得更快,更加灵敏,足以从捕猎者手中逃脱。他们能够更容易地迁徙到更有利的硬底区域。研究表明,在博内尔岛,海草床对于法国呼噜声鱼、鲱鱼等幼鱼十分重要;而红树林则对巴拉金梭鱼、蝴蝶鱼等鱼类十分重要[15-16]。
石鲈则是珊瑚礁和海草床之间的营养关联最好的证明。石鲈夜间在海草床觅食导致在海草附近珊瑚礁生物量的减少。夜晚,当鱼类迁徙到有着更多喜好食物的海草床区域,海草附近的珊瑚礁经历了鱼类密度和丰富度的大减。Meyer等发现,夜间在海草区觅食的幼年石鲈鱼,会将富含氮、磷等营养元素的排泄物排至白天休息的珊瑚礁区域,这些营养物质对珊瑚礁成长十分有益。在珊瑚礁附近的红树林沼泽中,经常可以在红树林树根之间看到珊瑚礁类鱼的鱼苗[17-18]。定量研究表明,没有红树林或者海草床存在的环境下,珊瑚礁鱼类资源的丰富度和生物量则显著下降,因此这是二者对珊瑚礁鱼类贡献的直接证据[10,19]。目前世界上很多地区砍伐红树林或海草床破坏的现象仍较严重,人类活动的影响加之他们之间密不可分的功能互联性,任何系统的破坏都会对彼此产生影响,如红树林的损失已导致大西洋最大食草鱼彩虹鹦嘴鱼的局部灭绝。因此,珊瑚礁经济鱼类的保护不仅局限于珊瑚礁生态系统的保护,更应该加强其周边红树林和海草床生态系统的关注。
3 三大特殊生态系统共同保护海岸线,防灾减灾
红树林,海草床和珊瑚礁生态系统,不仅为人类提供了丰富的经济产品,更对自然生态健康和世界人民生命安全作出了巨大的贡献。红树林、海草床、珊瑚礁、海岸防护林是保护海岸系统稳定的一道屏障,对减轻海啸破坏力和洪水冲击力发挥重要作用。红树植物的根系十分发达,盘根错节屹立于滩涂之中。它对海浪和潮汐的冲击有着很强的适应能力,可以护堤固滩、防风浪冲击、保护农田、降低盐害侵袭,对保护海岸起着重要的作用,为内陆的天然屏障,有“海岸卫士”之称。健康的珊瑚礁就像自然的防护堤一样,约有70%~90%的海浪冲击力量在遭遇到珊瑚礁时会被吸收或减弱。虽然红树林、海草床和珊瑚礁并不能完全阻止洪水,但在灾难发生时,有它们的地方受灾程度将比没有它们的地区大幅减小。此外,红树林、海草床、珊瑚礁能够提供对附近沙滩的保护。红树林可净化海水,吸收污染物,降低海水富营养化程度,防止赤潮发生。红树林在海滩上形成了一道樊篱,促进了淤泥的沉积,而密致的支柱根,加速了淤泥的沉积作用。随着红树群落向外缘发展,陆地面积也逐渐扩大。海草是一种根茎植物,生长于近海海岸淤泥质或沙质沉积物上,可捉紧泥土,减弱海浪冲击力,减少沙土流失,起到巩固及防护海床底质和海岸线的作用。而珊瑚礁本身会有自我修复力量,死掉的珊瑚会被海浪分解成细沙,丰富海滩,取代已被海浪冲走的沙粒[4,20]。
4 展望
综上所述,三大典型生态系统存在密不可分的关系。虽然,针对三者之间的关系已经开展了大量的研究,但研究仅局限于对鱼类资源的贡献力、能量流及海岸保护等领域,且这些领域的研究目前多局限于定性研究。由于动态变化和技术方面的难度,定量研究还局限于小区域内单个系统的研究。ARIAS-GONZÁLEZ等[21-22]利用加勒比海域丰富的研究数据初步开展了不同保护强度下珊瑚礁能流变化和营养级结构的模型构建工作,以此来评价人类活动干扰对生态系统结构的影响,这些前瞻性的工作为生态系统保护政策的制定提供了良好的技术保障。但是,三者之间的复杂关系因地域、研究技术、研究方法的差异,目前还没有统一的定论和模式,因此,进一步加强三大系统之间的能量流动、物质流动和作用机制的研究,以及对各种关系进行定量评价均是以后研究的重要领域。
三大典型生态系统的内部关联性还因地域的差异,各个生态系统的分布区域、状态而不同。三大生态资源在我国海岸带资源中发挥着重要作用,但是目前我国这方面的研究还比较薄弱。我国红树林、珊瑚礁和海草床生态现状面临着严重退化的趋势,但是目前我国针对三大典型资源的保护措施一般是相对独立的[20]。因此加强相互关系的研究并提高人们对这种关联性的认识,在此基础上制定相应的应对措施,是利用和保护这三大资源的重要工作。三大系统之间的关联性已经成为不争的事实,近年来由于人类活动的影响和全球气候变化的影响,我国红树林、珊瑚礁、海草床生态系统都面临着各种各样的压力,因此针对三大生态系统面临的问题,深入研究他们之间的关联性研究,并在研究的基础上提出相应的应对和技术对策,才能保障我国宝贵的生态资源的可持续发展和利用。
[1] 兰朱虹,廖岩,陈桂珠.热带海洋景观的生态系统服务替代和恢复[J].海洋环境科学,2009,28(2):218-222.
[2] Conservation International.Economic Values of Coral Reefs,Mangroves,and Seagrass:A Global Compilation[R].Center for Applied Biodiversity Science,Conservation International.Arington,VA,USA,2008.
[3] CHONG J.Protective Values of Mangrove and Coral Ecosystems:A Review of Methods and Evidence[R].IUCN,Gland,Switzerland,2005.
[4] HARBORNE A R,MUBBY P J,MICHELI F,et al.The functional value of Caribbean coral reef,seagrass and mangrove habitats to ecosystem processes[J].Advances in marine biology,2006,50:57-189.
[5] The World Bank Group.Philippines ENVIRONMENT MONITOR 2005:Coastal and Marine Resource Management[R].Washington,2005.
[6] MUMBY P J,EDWARDS A J,ARIAS-GONZÁLEZ J E,et al.Mangroves enhance the biomass of coral reef fish communities in the Caribbean[J].Nature,2004,427:533-536.
[7] DORENBOSCH M,GROL M G G,CHRISTIANEN M J A,et al.Indo-Pacific seagrass beds and mangroves contribute to fish density and diversity on adjacent coral reefs[J].Marine Ecology Progress Series,2005,302:63-76.
[8] PEREIRA P H,FERREIRA B P,REZENDE S M.Community structure of the ichthyofauna associated with seagrass beds(Halodule wrightii)in Formoso River estuary-Pernambuco,Brazil[J].Anais da Academia Brasileira de Ciências,2010,82(3):617-628.
[9] NAGELKERKEN I,VAN DE VELDE G,GEORISSEN M W,et al.Importance of Mangroves,Seagrass Beds and the Shallow Coral Reef as a Nursery for Important Coral Reef Fishes,Using a Visual Census Technique[J].Estuarine,Coastal and Shelf Science,2000,51(1):31-44.
[10] NAGELKERKEN I,ROBERTS C M,VAN DER Velde G,et al.How important are mangroves and seagrass beds for coral-reef fish?The nursery hypothesis tested on an island scale[J].Marine Ecology Progress Series,2002,244(2002):299-305.
[11] MUMBY P J.Connectivity of reef fish betweenmangroves and coral reefs:Algorithms for the design of marine reserves at seascape scales[J].Biological Conservation,2006,128(2):215-222.
[12] JAXION-HARM J,SAUNDERS J,SPEIGHT M R.Distribution of fish in seagrass,mangroves and coral reefs:life-stage dependent habitat use in Honduras[J].Revista de Biología Tropical,2012,60(2):683-698.
[13] NAGELKERKEN I,KLEIJNEN S,KLOP T,et al.Dependence of Caribbean reef fishes on mangroves and seagrass beds as nursery habitats:a comparison of fish faunas between bays with and without mangroves/seagrass beds[J].Marine E-cology Progress Series,2001,214:225-235.
[14] ARON J A,JOHN P E.Use of back-reef and lagoon habitats by coral reef fishes[J].Marine Ecology Progress Series,2002,228:213-226.
[15] SHULMAN M J.Recruitment of Coral Reef Fishes:Effects of Distribution of Predators and Shelter[J].Ecology,1985,66(3):1056-1066.
[16] SWEATRNAN H,ROBERTSON D R.Grazing halos and predation on juvenile Caribbean surgeoniishes[J].Marine Ecology Progress Series,1994,111:1-6.
[17] MEYER J L,SCHULTZ E T,HELFMAN G S. Fish Schools:An Asset to Corals[J].Science,1983,220:1047-1049.
[18] NAGELKERKEN I,DORENBOSCH M,VERBERK W C E P,et al.Day-night shifts of fishes between shallow-water biotopes of a Caribbean bay,with emphasis on the nocturnal feeding of Haemulidae and Lutjanidae[J].Marine Ecology Progress Series,2000,194:55-64.
[19] 施富山,王瑁,王文卿,等.红树林与鱼类关系的研究进展[J].海洋科学,2005,29(5):54-59.
[20] KATHIRESAN K,RAJENDRAN N.Coastal mangrove forests mitigated tsunami[J].Estuarine,Coastal and Shelf Science,2005,65(3):601-606.
[21] ARIAS-GONZÁLEZ J E.Trophic models of protected and unprotected coral reef ecosystems in the South of the Mexican Caribbean[J].Journal of Fish Biology,1998,53:236-255.
[22]ARIAS-GONZÁLEZ J E,NUÑEZ-LARA,E,GONZÁLEZ-SALAS,C,et al.Trophic models for investigation of fishing effect on coral reef ecosystems[J].Ecological Modelling,2004,172(2-4):197-212.
[23] 兰竹虹,陈桂珠.南中国海地区主要生态系统的退化现状与保育对策[J].应用生态学报,2006,17(10):1978-1982.
国家海洋局第三海洋研究所基本科研业务费专项资金资助项目(海三科2011030);全国海域地名普查项目:海域海岛地名普查成果分析与评价.
