基于金纳米-植酸胶束混合组装的过氧化氢传感器的电化学研究
2014-04-28郭小玉苗云杨海峰
郭小玉,苗云,杨海峰
(上海师范大学生命与环境科学学院化学系,上海 200234)
基于金纳米-植酸胶束混合组装的过氧化氢传感器的电化学研究
郭小玉,苗云,杨海峰*
(上海师范大学生命与环境科学学院化学系,上海 200234)
采用混合组装技术,利用植酸胶束(IP6m icelles)的磷酸酯键络合辣根过氧化物酶(HRP)和金纳米粒子(GNPs),形成了具有生物亲和性的纳米复合材料,保持了辣根过氧化物酶的生物活性,并利用金纳米粒子的高电子密度、介电特性和催化性能,实现了HRP与玻碳电极(GCE)表面的直接电子转移。Nafion膜的滴加能提高电极的选择性和稳定性。实验过程中借助紫外-可见吸收光谱和透射电子显微镜进行表征,实验结果证明:GNPs的高导电和高催化性能,结合植酸胶束的优良生物相容性和对酶的高负载量的特点,使得吸附在其上的HRP保持活性,制备的生物传感器能对H2O2进行电催化还原。Nafion/HRP-IP6micelles-GNPs/ GCE对H2O2的线性浓度范围为5×10-7~1.15×10-5mol/L(线性相关系数r=0.993,n=9),最低检测限为0.1 μmol/L(信噪比S/N=3),米氏常数为0.002 4mmol/L。
植酸胶束;金纳米粒子;辣根过氧化酶;过氧化氢传感器
0 引言
近年来,随着纳米技术与生物传感器的日益发展与融合,纳米生物传感器引起了越来越多的关注。纳米生物传感器是纳米技术与生物传感器的联结,综合运用光、声、电等检测技术,其研究范围涉及到生物科学、信息技术、纳米技术、界面科学等众多领域,因而成为研究热点。在对生物传感器研究中,将纳米材料与多种生物分子结合,实现识别捕获、信号传导和信号放大等功能的集成,从而可以在单体系中一步实现高效生物检测[1~3]。酶传感器作为生物传感器的一种,由于其对被检测物质的专一性和高效性,在过氧化氢、葡萄糖、胆固醇、抗坏血酸、亚硝酸盐等物质的检测方面应用前景广泛。金纳米(GNPs)在电化学生物传感器的研制中,是研究最广泛的纳米材料之一。金纳米粒子(GNPs)的粒径在100 nm以内,具有高电子密度、介电特性和催化作用,可与多种蛋白质或酶结合,不影响其生物活性。利用氯金酸还原法可以制备出各种不同粒径的GNPs。GNPs是一种极好的催化剂,因其粒子尺寸小、表面积大、表面原子配位不齐,故表面的活性位点增加,使它具备了作为催化剂的基本条件[4~8]。GNPs具有制备简单、优良的导电性,较大的比表面积、催化效率高、性能稳定,吸附能力强,良好的生物相容性,易于进行表面化学修饰而被广泛应用于传感器中酶的固定。GNPs可与酶分子的某些特定基团定向结合,提高固定酶的活性且提高酶与电极间的电子传递速率。该文研究工作采用混合组装技术,利用植酸胶束的磷酸酯键络合辣根过氧化物酶和金纳米粒子,形成了具有生物亲和性的纳米复合材料,因此保持了纳米复合材料中辣根过氧化物酶的生物活性,并利用金纳米粒子的高电子密度、介电特性和催化性能,实现了HRP与玻碳电极表面的直接电子转移。Nafion膜的滴加能提高电极的选择性和稳定性。实验结果证明,制备的生物传感器能对H2O2进行电催化还原。
1 实验部分
1.1 实验试剂
辣根过氧化物酶冻干粉(HRP,E.C.1.11.1.7, RZN3.0,A>250 U/mg,上海市生物化学试剂公司);高氯金酸(HAuCl4·3H2O),植酸钠(记作Na12IP6)和全氟磺酸树脂(Nafion,5%,溶剂:乙醇和水)均购自Sigma公司;0.1 mol/L磷酸缓冲溶液(PBS)由磷酸氢二钠和磷酸二氢钾的水溶液配制而成,并且通过加入0.1mol/L磷酸和氢氧化钾的水溶液配置成不同pH的PBS;过氧化氢(H2O2,30%,上海润洁化学试剂公司),其它试剂均为分析纯试剂,未经任何纯化。实验过程中均用去离子水。
1.2 实验仪器
JEM-2100型透射电子显微镜(日本电子);UV-8500型紫外-可见分光光度计(上海天美科学仪器有限公司);CHI 660 D型电化学工作站(上海辰华仪器有限公司);pH计(梅特勒-托利多仪器上海有限公司);SK2200H超声仪(上海科导超声仪器有限公司)。
1.3 植酸胶束的制备
植酸胶束(IP6micelles)的制备参照文献[9]并略做一些改动。1mmol/L植酸钠溶液在90℃条件下加热回流20min,然后冷却到室温以形成植酸胶束。
1.4 纳米金制备
参照文献[10]合成纳米金(GNPs)并略作改动。所用玻璃仪器均用王水清洗浸泡1 h,二次去离子水清洗至少3次。从配置好的HAuCl4(1%)中,移取1.0 mL滴加到100 mL冰水中在冰浴条件下搅拌,使其均匀分散。然后快速加入1%柠檬酸三钠1.0 mL,再慢慢逐滴加入0.075%NaBH41.3mL,搅拌15min,即制得纳米金(GNPs)。
1.5 修饰电极的制备
玻碳电极(GCE,φ=3mm)先后用0.3和0.05 μmα-Al2O3粉在麂皮上打磨成镜面,再依次用去离子水、乙醇、去离子水进行超声清洗,最后用氮气吹干后备用。将植酸胶束、辣根过氧化酶、纳米金按1∶2∶2的比例混合,并静置2 h后,移取5μL此混合液滴于玻碳电极表面,置于4℃冰箱中晾干待用,使用前滴加5μLNafion修饰电极,记作Nafion/HRP-IP6micelles-GNPs/GCE修饰电极,作为对比,分别制作了Nafion/HRP-GNPs/GCE,Nafion/HRP/GCE修饰电极。
1.6 实验方法
采用普通的三电极体系,以修饰好的玻碳电极(φ=3mm)作为工作电极,铂片电极和饱和甘汞电极(SCE)分别作为对电极和参比电极。循环伏安实验和计时电流实验前,将高纯氮气通入PBS中至少15min以除去氧气,保证实验在氮气氛下进行。
2 结果与讨论
2.1 金纳米粒子(GNPs)的TEM表征
图1是金纳米粒子(GNPs)的透射电子显微镜图。从图上可以观察到GNPs的粒径为3~8 nm,呈球形均匀分布,且没有发生团聚现象。期望利用纳米金的高电子密度、介电特性和催化作用,并能与生物酶结合,且不影响其生物活性的特性,在玻碳电极与辣根过氧化物酶之间起电子导线的作用,提高电子转移速率。

图1 金纳米粒子(GNPs)的TEM表征图Fig.1 TEM imageofGNPs
2.2 紫外-可见吸收图谱表征
由图2知,IP6micelles(a)无紫外可见吸收;GNPs(b)的最大吸收峰出现在509 nm;HRP(c)的最大吸收峰位于395 nm。HRP(c)在395 nm位置处的最大吸收峰所对应的是HRPFe(Ⅲ)的Soret吸收带[11]。当植酸胶束(IP6micelles),金纳米粒子(GNPs)和辣根过氧化物酶(HRP)按1∶2∶2的比例混合并静置2 h后,HRP-IP6micelles-GNPs(d)的最大吸收峰在396 nm和509 nm[12~13]处,分别对应于辣根过氧化物酶和纳米金。并且纳米金的特征峰并无变化,说明GNPs在HRP-IP6micelles-GNPs中未发生团聚并且分散均匀[14]。HRP-IP6micelles-GNPs(d)中HRPFe(Ⅲ)的Soret吸收带,与HRP在395 nm处的特征峰相比,仅发生1 nm的红移,表明修饰在HRP-IP6micelles-GNPs中的HRP其构象可能发生了细微的变化,但仍保持着其原有的生物活性,并未发生变性。
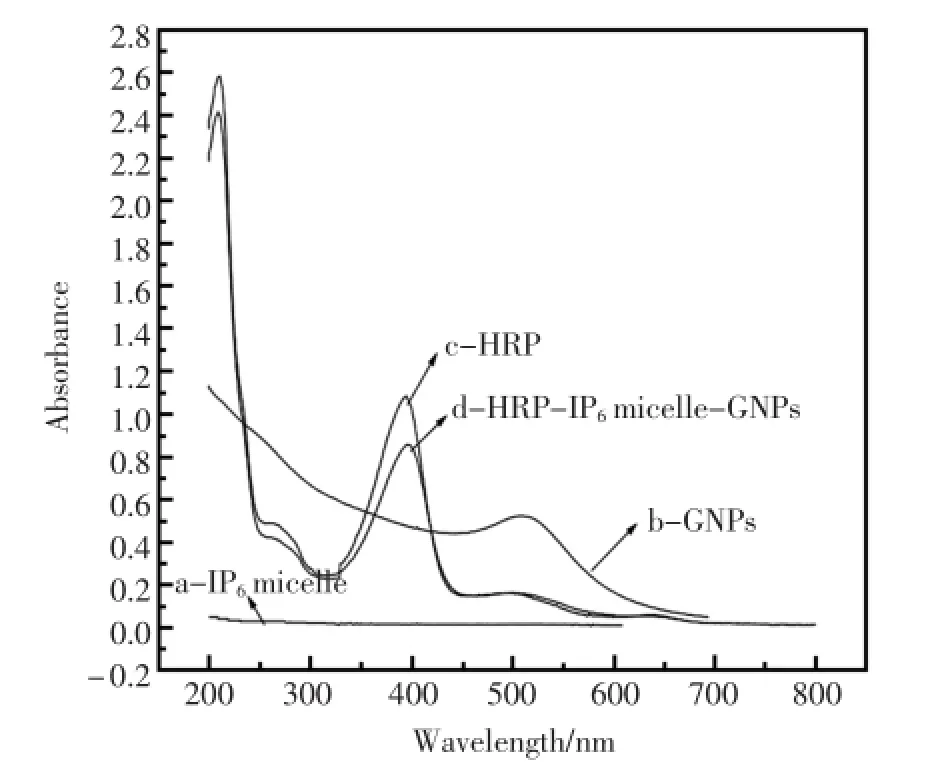
图2 (a)IP6micelles,(b)GNPs,(c)HRP和(d)HRP-IP6micelles-GNPs的紫外-可见光谱图Fig.2 UV-vis spectra of(a)IP6micelles,(b)GNPs,(c)HRPand(d)HRP-IP6micelles-GNPs
2.3 直接电化学行为

图3 (a)裸玻碳电极,(b)Nafion/HRP/GCE,(c)Nafion/ HRP-IP6micelles/GCE和(d)Nafion/HRP-IP6micelles-GNPs/GCE在PBS(pH7.0)中的循环伏安曲线。扫速:100mV/sFig.3 Cyclic voltammograms(CVs)of(a)bareGCE,(b)Nafion/HRP/GCE,(c)Nafion/HRP-IP6micelles/GCEand(d)Nafion/HRP-IP6micelles-GNPs/GCE in PBS(pH7.0).Scan rate:100mV/s
利用HRP-IP6micelles-GNPs三者混合组装,固定到玻碳电极表面,研究HRP的直接电化学行为。图3是(a)裸玻碳电极,(b)Nafion/HRP/ GCE,(c)Nafion/HRP-IP6micelles/GCE和(d)Nafion/HRP-IP6micelles-GNPs/GCE在PBS(pH7.0)中的循环伏安曲线。裸玻碳电极(a)和Nafion/HRP/GCE(b)的循环伏安曲线上未观察到氧化还原峰。在曲线(d)Nafion/HRP-IP6micelles-GNPs/GCE上可以观察到一对明显的氧化还原峰,而在(c)Nafion/ HRP-IP6micelles/GCE上有一对相对微弱的峰,这说明GNPs的存在能促进HRP在电极表面的直接电化学行为,IP6micelles-GNPs提供的微环境,不仅可以保持HRP的生物相容性,而且能有效地加快HRP与玻碳电极的电子转移。当扫速为100 mV/s时,Nafion/HRP-IP6micelles-GNPs/ GCE的氧化峰电位Epa=-0.347 V,还原峰电位Epc=-0.397 V。由此推得式量电位E0'=-0.372 V(E0'=(Epa+Epc)/2),ΔEp=50mV,说明Nafion/HRPIP6micelles-GNPs/GCE实现了直接电子转移,电子传递速率较快,是一个准可逆的电化学过程。
2.4 不同扫速的循环伏安曲线
图4是Nafion/HRP-IP6micelles-GNPs/GCE在PBS中不同扫速的循环伏安曲线,其峰电流均随扫速的增加而增加,峰电位基本不变。由内插图观察到,在扫速50~500mV/s范围内,氧化还原峰电流之比(Ipa/Ipc)接近1,峰电流与扫速成正比。说明这是一个表面控制的电极反应过程。同时这也进一步说明HRP已固定到了电极上,并发生了直接电子转移。
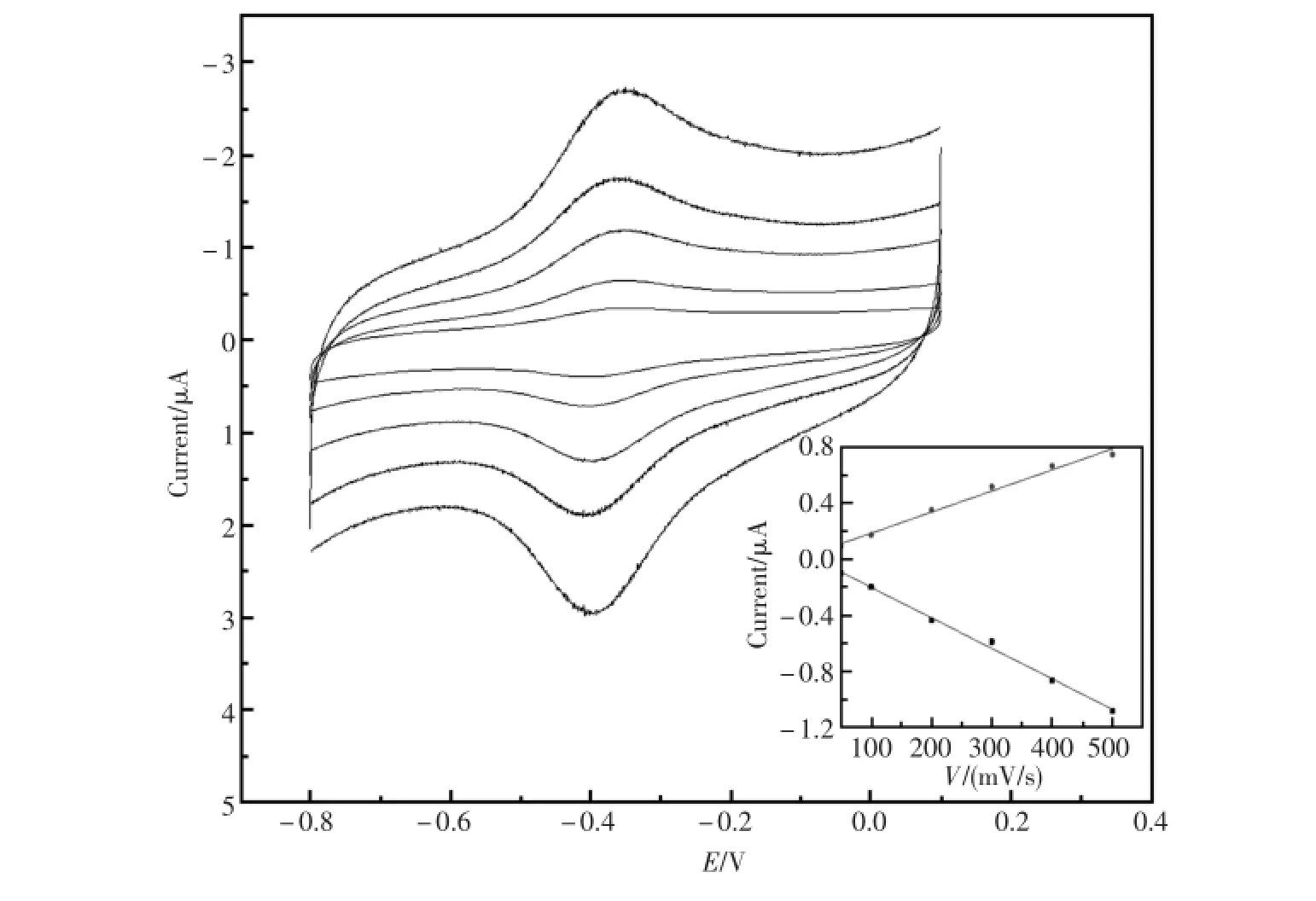
图4 Nafion/HRP-IP6micelles-GNPs/GCE在PBS(pH7.0)中不同扫速的循环伏安曲线:50,100,200,300,400,500mV/s(由内至外)。内插图:峰电流与扫速的线性关系Fig.4 CVsofNafion/HRP-IP6micelles-GNPs/GCE in PBS(pH7.0)atscan ratesof50,100,200,300,400,500 mV/s(from interior toexterior).Inset:peak currentversusscan rate
2.5 溶液pH的影响
图5是Nafion/HRP-IP6micelles-GNPs/GCE在pH值5.0,6.0,7.0,8.0和9.0的PBS中的循环伏安曲线。从图上可以看到可逆的氧化还原峰,并且随着pH值的增加,氧化还原峰电位发生负移。内插图是式量电位E0'与pH值的线性关系图,斜率为-53.8mV/pH。这一数值稍小于伴随一个质子转移的单电子可逆电极反应的理论值-57.6mV/pH。原因可能是受到了水合铁离子或血红素轴向配位基团的质子化作用的影响[15~17]。
2.6 Nafion/HRP-IP6m icelles-GNPs/GCE对过氧化氢的催化
图6是Nafion/HRP-IP6micelles-GNPs/GCE对不同浓度的H2O2的循环伏安图。当H2O2加入到PBS(pH7.0)后,Nafion/HRP-IP6micelles-GNPs/ GCE的还原峰电流变大而氧化峰电流变小。随着H2O2浓度的增加,还原峰电流逐渐增大,而氧化峰电流逐渐减小甚至消失。实验结果表明:Nafion/HRP-IP6micelles-GNPs/GCE修饰电极可以电催化还原H2O2。
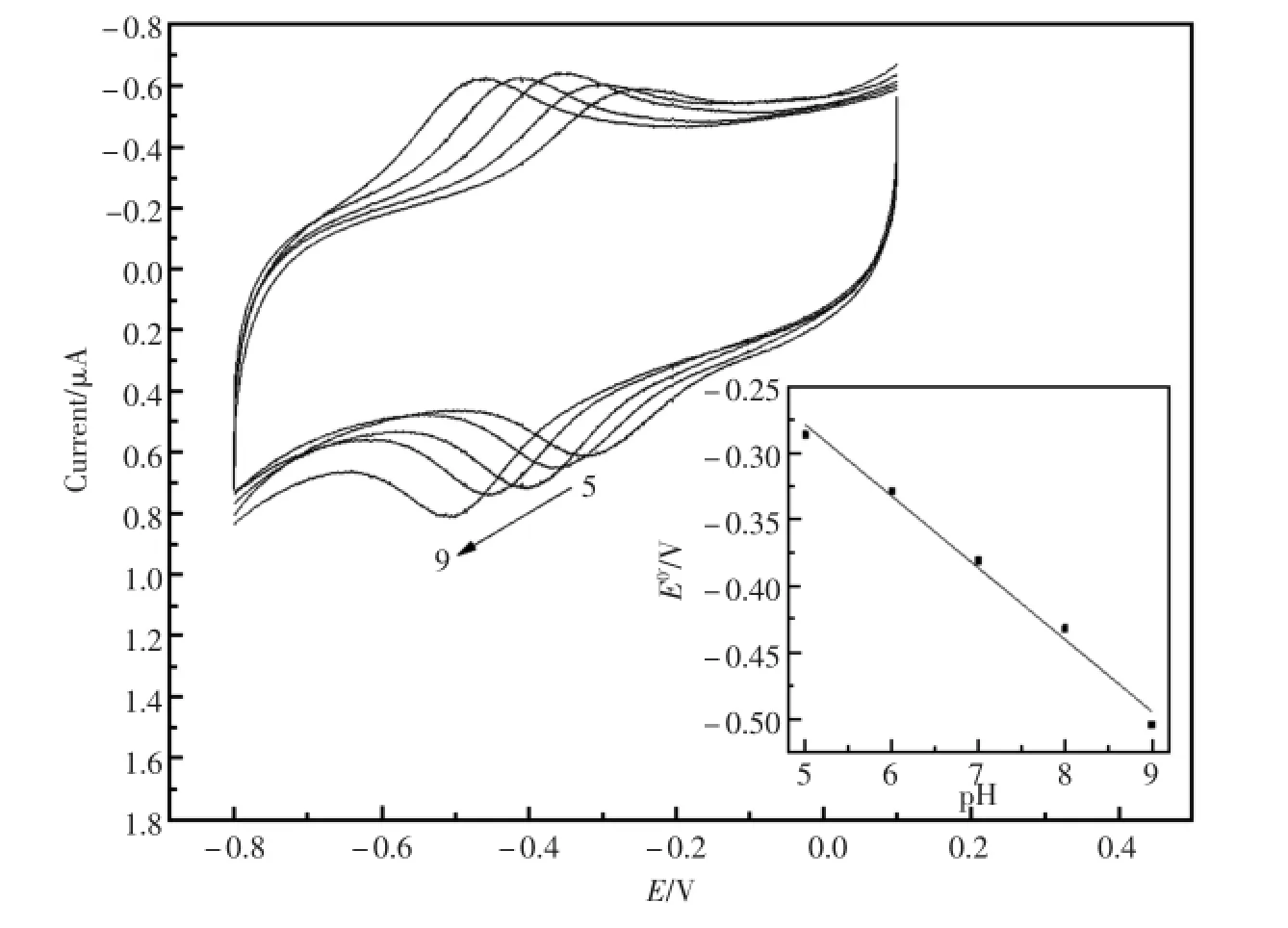
图5 Nafion/HRP-IP6micelles-GNPs/GCE在pH值为5.0,6.0,7.0,8.0和9.0PBS中循环伏安曲线。内插图:式量电位E0'与pH值的线性关系。扫速:100mV/sFig.5 CVsof Nafion/HRP-IP6micelles-GNPs/GCE in PBSwith pH value of5.0,6.0,7.0,8.0 and 9.0.Inset:plotof formalpotential versus the pH.Scan rate:100mV/s
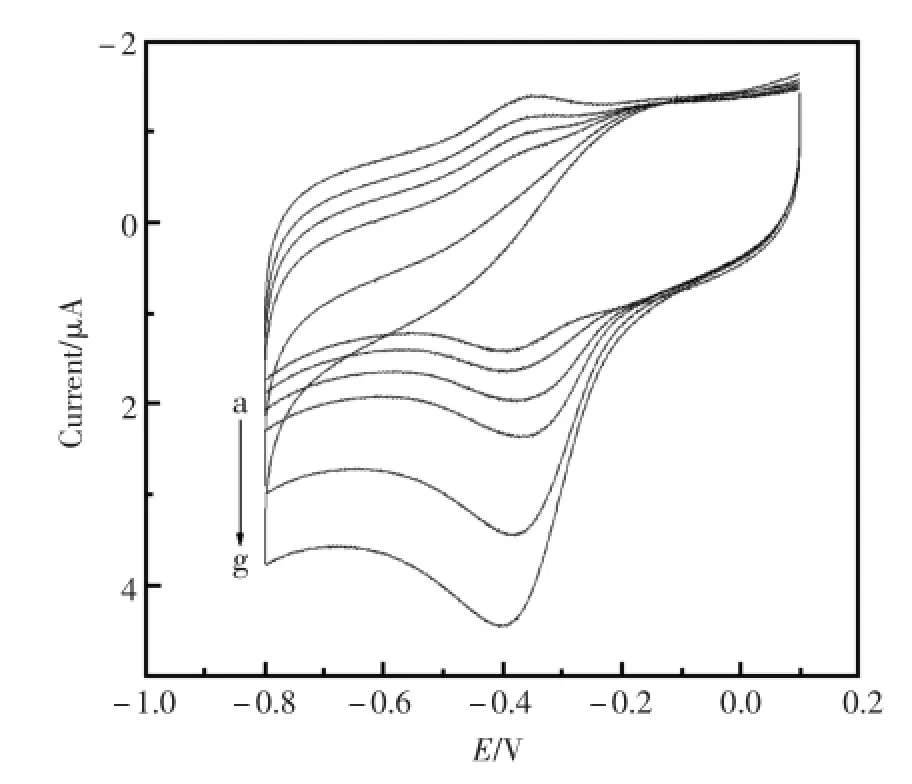
图6 Nafion/HRP-IP6micelles-GNPs/GCE在PBS(pH7.0)中含(a)0,(b)1×10-5,(c)5.0×10-5,(d)1.0×10-4,(e)2.0×10-4,(f)3.0×10-4和(g)4.0×10-4mol/LH2O2的循环伏安曲线。扫速:100mV/sFig.6 CVsofNafion/HRP-IP6micelles-GNPs/GCE in PBS(pH7.0)in the presenceof(a)0,(b)1×10-5,(c)5.0× 10-5,(d)1.0×10-4,(e)2.0×10-4,(f)3.0×10-4and(g)4.0× 10-4mol/LH2O2.Scan rate:100mV/s
2.7 Nafion/HRP-IP6m icelles-GNPs/GCE计时电流
图7是Nafion/HRP-IP6micelles-GNPs/GCE对H2O2的计时电流曲线。内插图:响应电流与H2O2浓度的校正曲线。随着H2O2的不断滴加,还原电流逐级增加并在3 s内达到稳态电流的95%,证明这是一个快速的电催化反应。内插图反映了该传感器对催化电流的线性校正关系,Nafion/HRP-IP6micelles-GNPs/GCE对H2O2的线性浓度范围为5×10-7~1.15×10-5mol/L(线性相关系数r=0.993,n=9),最低检测限为0.1μmol/L(信噪比S/N=3)。由Lineweaver-Burk方程计算得Nafion/HRP-IP6micelles-GNPs/GCE的表观米氏常数(apparentMichaelis-Menten constant,K),K =0.002 4mmol/L,说明固定在IP6micelles-GNPs基底上的HRP具有较高的活性,对H2O2具有良好亲和性。
2.8 稳定性
修饰电极Nafion/HRP-IP6micelles-GNPs/ GCE在PBS中以100mV/s连续扫描50圈,其响应电流无变化。Nafion/HRP-IP6micelles-GNPs/ GCE传感器放置在4℃下储存30 d后,测定其循环伏安电流及峰位置未发生变化。且得到的响应电流为初始电流的94%。
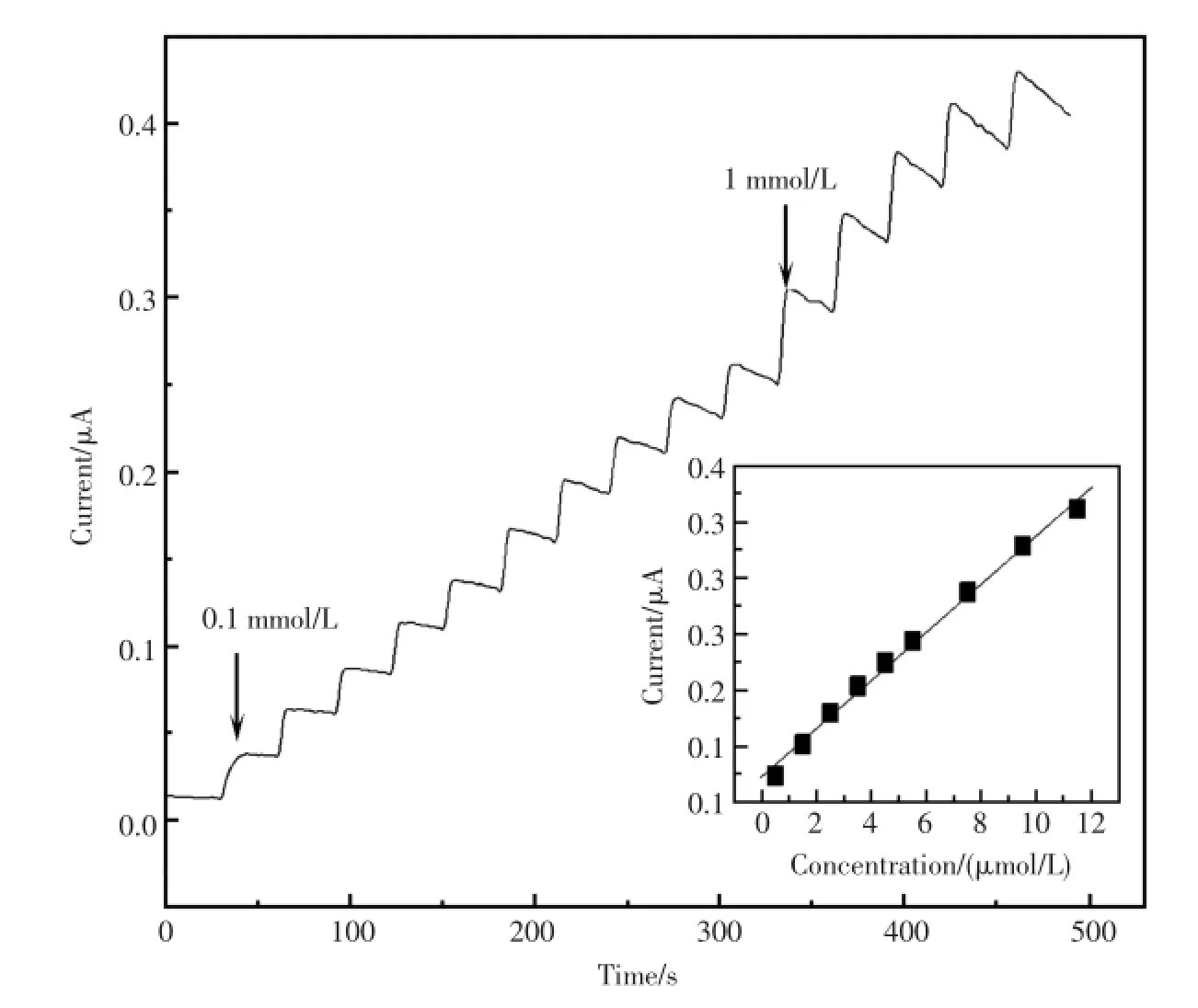
图7 Nafion/HRP-IP6micelles-GNPs/GCE在-0.24V工作电位下在10mLPBS(pH7.0)中连续加10μL 0.1mmol/LH2O2和10μL 1mmol/LH2O2的计时电流响应曲线。内插图:响应电流与H2O2浓度的校正曲线Fig.7 Amperometric responsesof the Nafion/HRP-IP6micelles-GNPs/GCEat-0.24 V to successive addition of 10μL 0.1mmol/LH2O2and 10μL 1mmol/LH2O2in a10mLPBS(pH7.0)under stirring.Inset:plotsof the linear calibration curves
3 结论
该研究工作采用混合组装技术,利用植酸胶束的磷酸酯键络合辣根过氧化物酶和金纳米粒子,形成了具有生物亲和性的纳米复合材料,因此保持了纳米复合材料中辣根过氧化物酶的生物活性,并利用金纳米粒子的高电子密度、介电特性和催化性能,实现了HRP与玻碳电极表面的直接电子转移。以此制备的Nafion/HRP-IP6micelles-GNPs/GCE可以电催化还原H2O2并可用于对H2O2快速检测。
[1]Xiao Y,Ju H X,Chen H Y.Directelectrochemistry of horseradish peroxidase immobilized on a colloid/cysteaminemodified gold electrode[J].Anal.Biochem.,2000,278:22~28.
[2]Yang Y H,Yang H F,Yang M H,et al.Amperometric glucose biosensor based on a surface treated nanoporous ZrO2/Chitosan composite film as immobilization matrix[J].Anal.Chim.Acta,2004,525:213~220.
[3]Milsom EV,Dash H A,JenkinsTA,etal.SnO2-poly(diallyl dimethylammonium chloride)films:Electrochemical evidence for heme protein absorption,denaturation,and demetallation[J].J.Electroanal.Chem.,2007,610:28~36.
[4]Bharathi S,NogamiM,Ikeda S.Novel electrochemical interfaceswith a tunable kinetic barrier by self-assembling organicallymodified silica gel and gold nanoparticles[J].Langmuir,2001,17:1~4.
[5]Wang Y,Qian W,Tan Y,et al.Direct electrochemistry and electroanalysis of hemoglobin adsorbed in self-assembled films of gold nanoshells[J].Talanta,2007,72:1 134~1 140.
[6]Li JX,Zhou LH,Han X,etal.Directelectorcheimsitry ofhemoglobin based on Geminisurfactant protected gold nanoparticlesmodified glassy carbon electrode[J].Sens.Actuators B,2008,135:322~326.
[7]Liu SQ,Leech D,Ju H X.Application ofcolloidalgold in protein immobilization,electron transfer and biosensing[J].Anal.Lett.,2003,36:1~19.
[8]Willner I,Willner B,Katz E.Biomolecule-nanoparticle hybrid systems for bioelectronic applications[J].Bio-electrochemistry,2007,70:2~11.
[9]Wang N,Wen Y,Wang Y,et al.Synthesis ofanti-aggregation silvernanoparticlesbased on inositolhexakisphosphoric micelles for a stable surface enhanced Raman scattering substrate[J].Nanotechnology,2009,20:315 603(6pp).
[10]Brown K R,Fox AP,Natan M J.Morphology-dependent electrochemistry of cytochromec at Au colloid-modified SnO2electrodes[J].J.Am.Chem.Soc.,1996,118:1 154~1 157.
[11]LuX B,Wen ZH,Li JH.Hydroxyl-containing antimony oxide bromide nanorods combined with chitosan for biosensors[J].Biomaterials,2006,27:5 740~5 747.
[12]AlvarezM M,Khoury JT,Schaaff TG,et al.Opticalabsorption spectra of nanocrystal gold molecules[J].J.Phys.Chem.B,1997,101:3 706~3 712.
[13]Kang JW,Li X N,Wu G F,etal.A new scheme of hybridization based on the Aunano-DNAmodified glassy carbon electrode[J].Anal.Biochem.,2007,364:165~170.
[14]Lei C X,Hu SQ,Shen G L,et al.Immobilization of horseradish peroxidase toanano-Aumonolayermodified chitosan entrapped carbon paste electrode for the detection of hydrogen peroxide[J].Talanta,2003,59:981~988.
[15]YamazakiL,Araiso T,HayashiY,etal.Analysisofacidbase properties of peroxidase and myoglobin[J].Adv.Biophys.,1978,11:249~281.
[16]Liu H H,TianZQ,Lu Z X,et al.Direct electrochemistry and electrocatalysis of heme-proteins entrapped in agarose hydrogel films[J].Biosens.Bioelectron.,2004,20:294~304.
[17]Liu SQ,Dai Z H,Chen H Y,et al.Immobilization of hemoglobin on zirconium dioxide nanoparticles for preparation of a novel hydrogen peroxide biosensor[J].Biosens.Bioelectron.,2004,19:963~969.
Hydrogen pero xidebio sensor based on gold nanoparticles-phytic acidm icellem ixed assemble
Guo Xiao-yu,Miao Yun,Yang Hai-feng*
(DepartmentofChemistry,Collegeof lifeand EnvironmentSciences,ShanghaiNormalUniversity,Shanghai 200234,China)
A hybrid and bio-compatible sensor constructed with IP6micelles phosphate bonded horseradish peroxidaseand gold nanoparticles.Thenano-compositematerialsnotonly keep thebiologicalactivity ofhorseradish peroxidase,but also achieve the high electron density,dielectric properties and catalytic performance of gold nanoparticles to facilitate the directelectron transfer.Furthermore,Nafionmembrane can improve the selectivity and stability of sensor.The characterizations of UV-visible absorption spectroscopy and transmission electron microscopy showed that the high conductivity and high catalytic properties of nanoparticles together with the excellent biocompatibility and high enzyme loading IP6micellesmade the adsorption of HRP and maintained its activity.Nafion/HRP-IP6micelles-GNPs/GCE biosensor can electrocatalytically reduce H2O2.The current response with the concentration of H2O2has a linear relationship within the concentration range of 5×10-7~1.15×10-5mol/L(linear correlation coefficient r=0.993,n=9),the detection limitwas 0.1μmol/L(signal to noise ratio S/N=3),Michaelis constantof0.002 4mmol/L.
IP6m icelles;gold nanoparticles;horseradish peroxidase;hydrogen peroxide sensor
国家自然科学面上基金项目(21073121)
*通讯联系人,E-mail:haifengyang@yahoo.com,Tel:Fax:021-64322511
