人脐带间充质干细胞治疗慢性HIV感染者的回顾性研究
2014-04-28王嗣予金磊李元元黄辉煌徐若男福军亮张政王福生
王嗣予,金磊,李元元,黄辉煌,徐若男,福军亮,张政,王福生
人脐带间充质干细胞治疗慢性HIV感染者的回顾性研究
王嗣予,金磊,李元元,黄辉煌,徐若男,福军亮,张政,王福生
目的明确人脐带间充质干细胞(human umbilical cord-derivedmesenchymal stem cells,UC-MSC)治疗慢性HIV感染者的长期安全性和有效性。方法回顾性分析2009年3月—2012年7月在我院接受UC-MSC治疗的57例慢性HIV感染者随访3年的资料。根据UC-MSC治疗前CD4+T淋巴细胞水平,将所有患者分为≤200个/mm3组(免疫重建失败组)和> 200个/mm3组(免疫重建成功组)。分析UC-MSC治疗的长期安全性和有效性。结果2组患者接受UC-MSC治疗1、2、3年,其外周血CD4+T淋巴细胞计数及CD4/CD8比值均较基线水平显著升高。进一步分析发现,免疫重建失败组UC-MSC治疗1年和2年的有效率(以CD4+T淋巴细胞计数较基线水平升高30%为有效)显著高于免疫重建成功组。2组随访中未发现明显不良事件,安全性好。结论UC-MSC治疗慢性HIV感染者3年安全性好,可显著持续升高外周血CD4+T淋巴细胞计数和CD4/CD8比值,UC-MSC治疗免疫重建失败患者疗效更为显著。本研究提示慢性HIV感染者免疫重建失败可能是UC-MSC治疗的适应证。
获得性免疫缺陷综合征;HIV;间充质干细胞;治疗结果
AIDS是由HIV-1感染后引起的一种严重危害人类健康的致死性传染病。在我国HIV-1感染者目前已达78万,并正以每年40%的速度增长[1]。高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)显著抑制了病毒复制,减少了机会性感染和肿瘤的发生,降低了HIV-1感染者的病死率[2-3]。然而,近年来发现,在接受HAART大于2年的患者中,仍有20%的患者即使其病毒复制长期受到抑制,但其外周血CD4+T淋巴细胞数量却始终难以恢复,这部分患者被称为免疫重建失败患者[4-6]。免疫重建失败发生的具体机制目前尚不清楚,可能与胸腺功能障碍[7]、抗病毒治疗前CD4+T淋巴细胞数量[8]、共感染情况以及机体免疫超活化状态有关[9-11]。
对于免疫重建失败患者,目前临床上尚无特异有效的治疗方法。采用白细胞介素-7治疗已经初步显示出良好的治疗前景,但缺乏大样本、随机、对照试验证实其疗效[12-13]。我们前期应用人脐带间充质干细胞(human umbilical cord-derived mesenchymalstem cells,UC-MSC)开展了小样本、随机、对照试验,发现UC-MSC治疗免疫重建失败1年安全性好,能显著增加患者CD4+T淋巴细胞数量,显示出良好的临床应用前景[14-15]。本研究通过回顾性观察接受UC-MSC治疗的57例慢性HIV感染者,旨在阐明UC-MSC治疗免疫缺陷患者的长期(3年)安全性和有效性,为发现UC-MSC治疗的适应证提供科学依据。
1 对象与方法
1.1 对象选择57例2009年3月—2012年7月在解放军第三〇二医院就诊的慢性HIV感染者,其中男51例,女6例,平均年龄39岁(18~55岁);44例感染途径为性传播,13例为血液传播;平均感染时间73个月,接受HAART平均31周。诊断依据《艾滋病诊疗指南》[16],并排除现症机会性感染、肿瘤等并发症。
1.2 治疗和随访本研究获得解放军总后勤部卫生部批准(卫医疗[2009]126号),并在美国国立卫生院临床试验网站完成注册(NCT01213186),得到解放军第三〇二医院医学伦理委员会通过。患者签署知情同意书后,接受静脉回输UC-MSC。首个疗程时,分别于0、1、2个月给予3次回输,每次回输3×107个细胞;部分患者在首次治疗的第2~3年接受第2个或第3个疗程治疗。患者平均接受UCMSC治疗4次。记录患者治疗基线、1年、2年、3年的CD3+、CD4+、CD8+T淋巴细胞计数、血常规和肝肾功能等生化指标,以及病情变化和病史。
1.3 UC-MSC细胞培养参加UC-MSC细胞培养及质量控制的人员均经过良好操作规范(goodmanufacturing practice,GMP)培训和健康查体,符合GMP上岗要求。在符合GMP的实验室条件下,取新生儿脐带剪成0.2~0.5 cm3小块组织,加入无血清培养基,6~10 d UC-MSC贴壁后传代。回输前将细胞悬浮于0.9%氯化钠溶液。具体培养及回输方法见文献[17]。
1.4 实验室检查肝功能检测使用日本Olympus生化分析仪,试剂为英国朗道公司产品。采用荧光定量RT-PCR法检测血清HIV RNA,试剂盒由北京匹基生物制品有限公司提供,PCR仪为美国ABI公司7900型。外周血CD3+、CD4+、CD8+T淋巴细胞绝对计数检测方法参考文献[14-15]。
1.5 统计学处理使用SPSS 13.0软件进行统计分析,定量数据以中位数(最小值,最大值)表示,定性资料以频数或百分比表示。2组定量资料采用Mann-Whiteny U检验,2组1、2、3年时间点数据与基线水平比较采用Wilcoxon配对检验。2组定性资料比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况根据UC-MSC治疗前CD4+T淋巴细胞水平,将患者分为≤200个/mm3组(免疫重建失败组)和>200个/mm3组(免疫重建成功组)。2组患者基线水平的性别比例、年龄、感染途径和接受HAART时间等差异均无统计学意义。但免疫重建失败组CD4+T淋巴细胞最低计数、UC-MSC治疗前CD4+T淋巴细胞计数及CD4/CD8比值均显著低于免疫重建成功组(表1)。

表1 UC-MSC治疗慢性HIV感染者基线数据Table 1 Baseline data of patients w ith chronic HIV infection treated w ith UC-MSC
2.2 长期有效性观察随着随访时间延长,2组均有部分患者失访,其原因主要包括:经济问题不愿随访、工作改变随访不方便以及参加其他临床试验等。进一步分析我们发现:免疫重建失败组患者接受UC-MSC治疗1年和2年外周血CD4+T淋巴细胞计数较基线水平显著升高(P<0.01),而治疗3年CD4+T淋巴细胞计数保持在高水平,但差异无统计学意义。而免疫重建成功组患者接受UC-MSC治疗1、2、3年外周血CD4+T淋巴细胞计数较基线水平均显著升高(P<0.01)。2组在治疗1、2、3年CD4/CD8比值均较基线水平显著升高(P<0.01)。见表2。
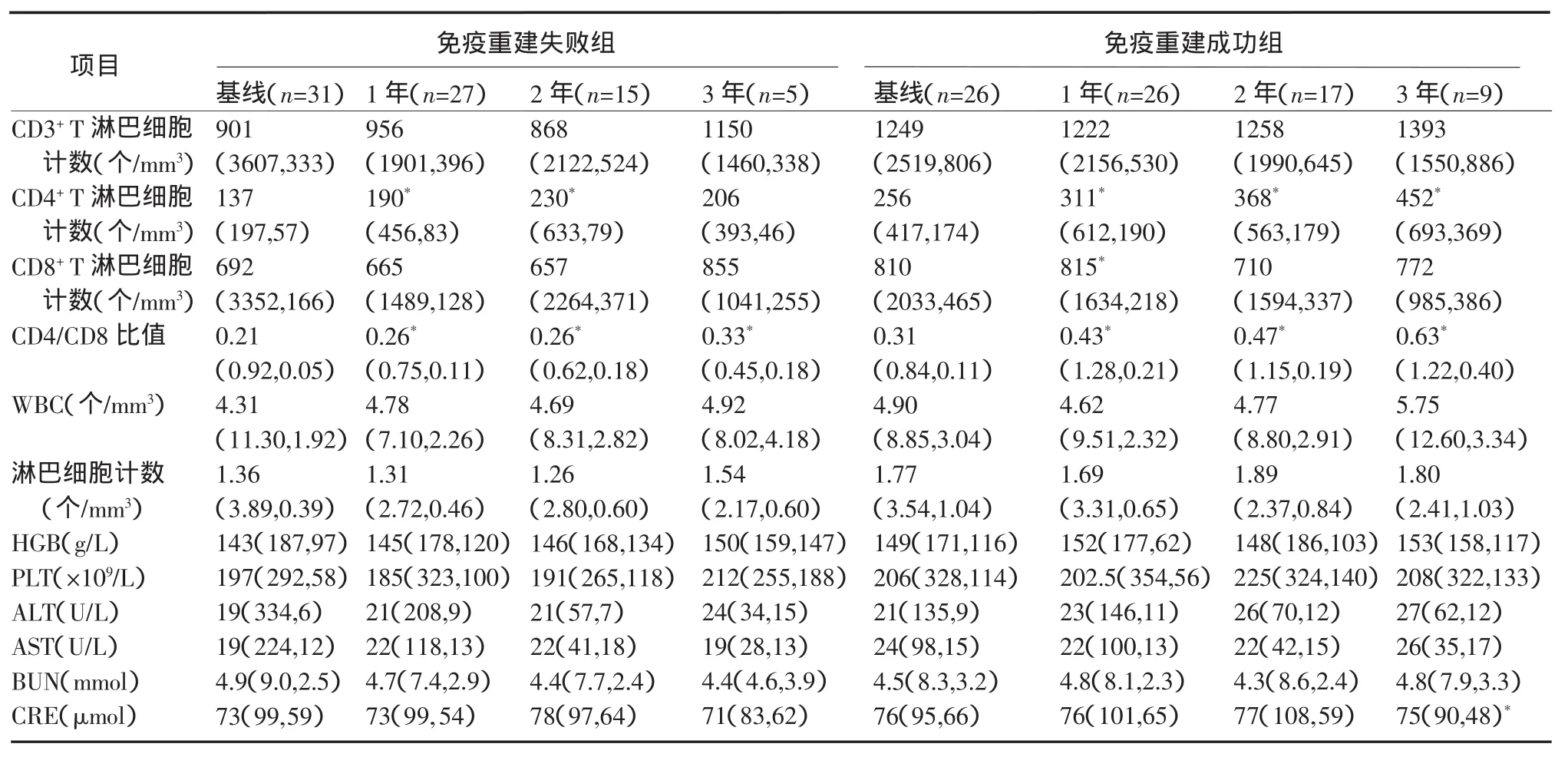
表2 UC-MSC治疗后慢性HIV感染者外周血T淋巴细胞计数及肝肾功能改变Table 2 Changes of peripheral blood T lym phocyte counts and liver and kidney function parameters of patients w ith chronic HIV infection after UC-MSC treatment
2.3 血常规和肝肾功能指标比较基线和治疗1、 2、3年不同时间点免疫重建失败组和免疫重建成功组WBC、淋巴细胞计数、HGB、PLT、ALT、AST、BUN、CRE和肝肾功能等变化情况,结果表明在治疗前及治疗各时间点各指标差异均无统计学意义(表2)。
2.4 UC-MSC治疗有效率我们将UC-MSC治疗后CD4+T淋巴细胞计数或CD4/CD8比值较基线水平升高30%定义为治疗有效,从而进一步比较2组 UC-MSC治疗的有效率。分析发现:免疫重建失败组UC-MSC治疗1、2、3年CD4+T淋巴细胞计数升高有效率分别为16/27、12/15和3/5,而免疫重建成功组分别为7/26、7/17和7/9(表3)。统计学分析发现,免疫重建失败组UC-MSC治疗1年和2年有效率显著高于免疫重建成功组。免疫重建失败组UCMSC治疗1、2、3年CD4/CD8比值升高有效率分别为9/27、10/15和5/5,而免疫重建成功组分别为13/26、11/17和7/9。2组比较差异无统计学意义(表4)。
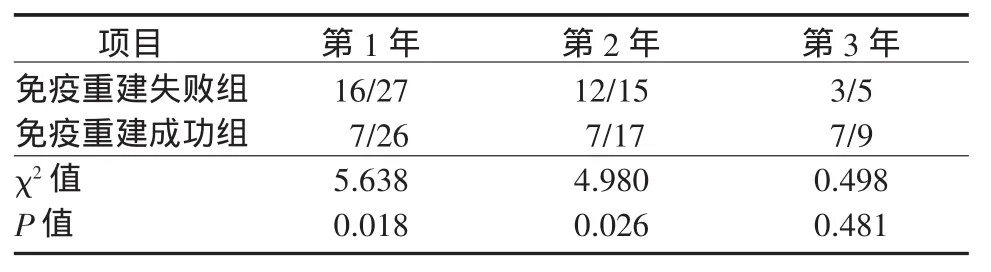
表3 2组接受UC-MSC治疗后各年度CD4+T淋巴细胞计数升高有效率比较(累计有效例数/累计存活例数)Table 3 Comparison of annual efficacy of the increased CD4+T lymphocyte counts between the two groups after UC-MSC treatment(cumulative effective cases/cumulative survival cases)
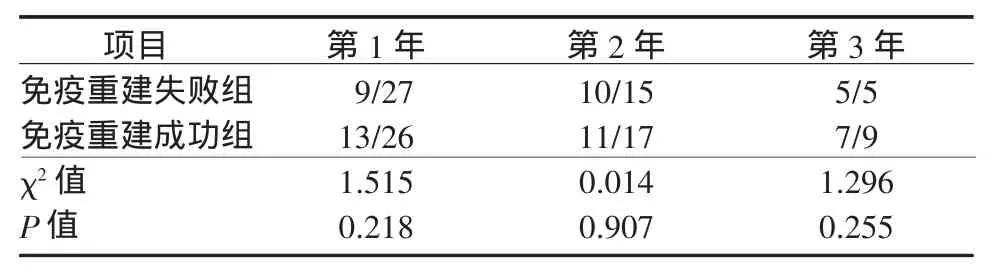
表4 2组接受UC-MSC治疗后各年度CD4/CD8比值升高有效率比较(累计有效例数/累计存活例数)Table 4 Com parison of annual efficacy of the increased CD4/CD8 ratio between the two groups after UC-MSC treatment(cumulative effective cases/cumulative survival cases)
2.5 患者安全性观察2组随访2年,未发现明显不良事件。UC-MSC回输后大部分患者自觉精神状态改善,食欲增强,睡眠改善,体重增加,抗病毒药物导致的乏力、胃肠道不适、皮疹等不良反应减轻。
3 讨论
我们前期应用UC-MSC治疗长期接受HAART的HIV感染者并随访1年,研究发现:UC-MSC治疗免疫缺陷患者安全性好[14],可显著提高免疫重建失败患者CD4+T淋巴细胞计数和CD4/CD8比值,同时降低患者炎症程度,充分显示了良好的治疗前景[15]。本研究通过回顾性观察57例接受UC-MSC治疗的AIDS患者,旨在阐明UC-MSC治疗免疫缺陷患者的长期(3年)安全性和有效性。
UC-MSC治疗在1年内可有效升高免疫重建失败患者的CD4+T淋巴细胞水平[14],但是否有助于免疫重建成功患者CD4+T淋巴细胞水平的恢复尚不清楚。在本研究中,我们根据UC-MSC治疗前患者的CD4+T淋巴细胞计数,将其分为≤200个/mm3组(免疫重建失败组)和>200个/mm3组(免疫重建成功组)。结果发现,免疫重建成功患者在接受多次UC-MSC治疗后,CD4+T淋巴细胞计数可稳定升高,CD4/CD8比值也逐渐升高。结合我们前期的报道,我们的研究提示:UC-MSC对接受HAART的AIDS患者CD4+T淋巴细胞计数均有升高作用;UC-MSC治疗后,免疫重建失败患者1年和2年有效率(较基线水平升高30%视为有效)均显著高于免疫重建成功患者,提示接受HAART的免疫重建失败是UC-MSC治疗的更有效适应证。
UC-MSC治疗对接受HAART的患者是否能长期维持其疗效尚不清楚。我们发现,UC-MSC治疗1~3年,患者CD4+T淋巴细胞计数持续升高;与此同时,CD4/CD8比值也持续稳定升高。值得注意的是,免疫重建失败患者第3年CD4+T淋巴细胞计数较第2年并未进一步升高,其原因尚不清楚,可能与UC-MSC回输人体后不能长久发挥治疗作用有关,也可能与免疫重建失败患者自身的免疫状态有关,因为对于免疫重建成功患者,其第3年CD4+T淋巴细胞计数较第2年进一步升高。将来的研究应该阐明回输的UC-MSC在患者体内的存活时间及半衰期等动力学特征,并探索最佳的临床治疗方案,包括最佳治疗剂量、时机和治疗次数等[18]。
本研究还观察了UC-MSC治疗3年的安全性,发现UC-MSC治疗3年期间患者肝肾功能及血常规均无显著变化,提示UC-MSC治疗具有良好的长期安全性。当然,本研究尚有一些不足之处。首先,本研究是回顾性研究,缺乏很好的对照,因此,UC-MSC治疗AIDS患者的长期安全性和有效性尚需要随机、对照试验进一步证实。其次,本研究中并非所有病例都完成3年随访,也势必影响3年疗效的准确判断。
总之,本研究发现UC-MSC治疗3年安全性好,可持续升高患者外周CD4+T淋巴细胞计数和CD4/ CD8比值;其中,UC-MSC治疗免疫重建失败患者疗效更为显著。该研究为明确UC-MSC治疗AIDS患者的适应证提供了科学的参考依据。
[1]Zhang L,Chow EP,Jing J,etal.HIV prevalence in China:integration of surveillance data and a systematic review[J].Lancet Infect Dis, 2013,13(11):955-963.
[2]Hammer SM,Squires KE,Hughes MD,et al.A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less.AIDS Clinical Trials Group 320 Study Team[J].N Engl JMed,1997,337(11):725-733.
[3]Mocroft A,Vella S,Benfield TL,etal.Changing patterns ofmortality across Europe in patients infected with HIV-1.EuroSIDA Study Group[J].Lancet,1998,352(9142):1725-30.
[4]Vo TT,Ledergerber B,Keiser O,et al.Durability and outcome of initial antiretroviral treatments received during 2000-2005 by patients in the Swiss HIV Cohort Study[J].JInfectDis,2008,197(12): 1685-1694.
[5]Kelley CF,Kitchen CM,Hunt PW,et al.Incomplete peripheral CD4+cellcountrestoration in HIV-infected patients receiving longterm antiretroviral treatment[J].Clin Infect Dis,2009,48(6):787-794.
[6]张政,王福生.HIV感染免疫重建失败患者的治疗:如何破解临床难题[J].传染病信息,2012,25(6):328-331.
[7]LiT,Wu N,DaiY,etal.Reduced thymicoutputisamajormechanism of immune reconstitution failure in HIV-infected patientsafter longterm antiretroviral therapy[J].Clin InfectDis,2011,53(9):944-951.
[8]Baker JV,Peng G,Rapkin J,etal.CD4+countand risk ofnon-AIDS diseases following initial treatment for HIV infection[J].AIDS,2008, 22(7):841-848.
[9]Hunt PW,Martin JN,Sinclair E,etal.T cell activation is associated with lower CD4+T cell gains in human immunodeficiency virus-infected patientswith sustained viral suppression during antiretroviral therapy[J].J Infect Dis,2003,187(10):1534-1543.
[10]Kuller LH,Tracy R,BellosoW,etal.Inflammatory and coagulation biomarkers and mortality in patients with HIV infection[J].PLoS Med,2008,5(10):e203.
[11]Appay V,Sauce D Immune activation and inflammation in HIV-1 infection:causes and consequences[J].JPathol,2008,214(2):231-241.
[12]Levy Y,Lacabaratz C,Weiss L,etal.Enhanced T cell recovery in HIV-1-infected adults through IL-7 treatment[J].JClin Invest, 2009,119(4):997-1007.
[13]Levy Y,Sereti I,Tambussi G,etal.Effects of recombinant human interleukin 7 on T-cell recovery and thymic output in HIV-infected patients receiving antiretroviral therapy:results of a phase I/IIa randomized,placebo-controlled,multicenter study[J].Clin Infect Dis,2012,55(2):291-300.
[14]金磊,福军亮,张政,等.脐带间充质干细胞治疗HIV感染的安全性评价[J].传染病信息,2010,23(6):363-365.
[15]Zhang Z,Fu J,Xu X,etal.Safety and immunological responses to humanmesenchymal stem cell therapy in difficult-to-treat HIV-1-infected patients[J].AIDS,2013,27(8):1283-1293.
[16]中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南[J].中国感染与化疗杂志,2006,6(4):265-279.
[17]Zhang Z,Lin H,ShiM,etal.Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients[J].JGastroenterol Hepatol,2012,27(Suppl 2):S112-S120.
[18]Allam O,Samarani S,Ahmad A.Mesenchymal stem cell therapy in HIV-infected HAART-treated nonimmune responders restores immune competence[J].AIDS,2013,27(8):1349-1352.
(2013-07-19收稿 2013-09-20修回)
(责任编委 赵敏 本文编辑 王姝)
Retrospective study on human umbilical cord-derived mesenchymal stem cell treatment for patientsw ith chronic HIV infection
WANG Si-yu,JIN Lei,LIYuan-yuan,HUANG Hui-huang,XU Ruo-nan,FU Jun-liang,ZHANG Zheng,WANG Fu-Sheng*
Chinese PLA Medical School,Beijing 100853,China
*Corresponding author,E-mail:fswang302@163.com
Objective To investigate the long-term safety and efficacy of human umbilical cord-derived mesenchymal stem cells(UC-MSC)treatment for patients with chronic HIV infection.M ethods The data of 3-year follow-up for 57 patients with chronic HIV infection treated in our hospital from Mar.2009 to Jul.2012 were analyzed retrospectively.According to the CD4+T lymphocyte counts prior to UC-MSC treatment,these patients were divided into two groups,≤200 cells/mm3group(immunological non-responder group)and>200 cells/mm3group(immunological responder group).The long-term safety and efficacy of UC-MSC treatment were analyzed.Results peripheral CD4+T lymphocyte counts and the ratio of CD4/CD8 at 1-year,2-year and 3-year UC-MSC treatmentwere found to increase significantly as compared with baseline level.Further analysis indicated that 1-year and 2-year therapeutic efficacy(defined as a 30%increase of CD4+T lymphocyte counts as compared with baseline level)in immunological non-responder group was significantly higher than that in immunological responder group.UC-MSC treatmentwas found to be safe as no significantside effects occurred in the two groups during 3-year follow-up period.Conclusions UC-MSC treatment iswell tolerant for 3 years.Peripheral blood CD4+T lymphocyte counts and the ratio of CD4/CD8 increase significantly,and UC-MSC treatment ismore effective in improvement of CD4+T lymphocyte counts in immunological non-responders.This study suggests that immunologicalnon-response to HAARTmay be an indication of UC-MSC treatment in patientswith chronic HIV infection.
acquired immunodeficiency syndrome;HIV;mesenchymal stem cells;treatment outcome
R512.91
A
1007-8134(2014)01-0025-04
国家“十二五”科技重大专项(2013ZX10001002001-002);国家优秀青年基金(81222024)
100853北京,解放军医学院(王嗣予);100039北京,解放军第三〇二医院生物治疗研究中心(王嗣予、金磊、李元元、黄辉煌、徐若男、福军亮、张政、王福生)
王福生,E-mail:fswang302@163.com
