多噬伯克霍尔德氏菌WS-FJ9对杨树光合作用和生物量的影响
2014-04-27李冠喜吴小芹叶建仁
李冠喜,吴小芹,叶建仁
(1.南京林业大学森林资源与环境学院,江苏南京 210037;2.连云港市农业科学院,江苏连云港 222006;3.南京林业大学江苏省入侵有害生物预防与控制重点实验室,江苏南京 210037)
多噬伯克霍尔德氏菌WS-FJ9对杨树光合作用和生物量的影响
李冠喜1,2,3,吴小芹1,3,叶建仁1,3
(1.南京林业大学森林资源与环境学院,江苏南京 210037;2.连云港市农业科学院,江苏连云港 222006;3.南京林业大学江苏省入侵有害生物预防与控制重点实验室,江苏南京 210037)
为研究BurkholderiamultivoransWS-FJ9对杨树Populus的促生机制,采用LI-6400XT便携式光合仪对接菌后的杨树叶片的光合指标及荧光参数进行了测定,同时对杨树叶片的叶绿素质量分数及杨树的苗高、地径和生物量进行了测定。结果表明:在处理期内,接种WS-FJ9菌株处理的净光合速率(Pn),蒸腾速率(Tr)和气孔导度(Gs)均呈先上升后下降趋势,胞间二氧化碳摩尔分数(Ci)呈先下降后上升趋势,Pn和Tr在整个处理期均高于对照,Ci在整个处理期均低于对照,Gs在第30天时低于对照,其后均高于对照。荧光参数Fv/Fm和ΦPSⅡ值均高于对照;叶绿素总量及叶绿素a/b比值均高于对照;杨树实生苗接菌处理150 d后的苗高、地径和生物量均显著高于对照。研究结果从光合作用及生物量的角度阐明了WS-FJ9菌株对NL-895杨的促生机制,为生物菌肥的开发与利用提供了参考依据。图4表1参21
植物生理学;促生机制;光合参数;荧光参数;叶绿素;生物量
植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)是指自由生活在土壤或附生于植物根系的一类可促进植物生长及其对矿质营养的吸收和利用并能抑制有害微生物的有益细菌。自1978年Burr等[1]首次报道了马铃薯Solanum tuberosum上存在植物根际促生细菌之后,大量研究证实植物根际促生细菌广泛存在于多种植物的根围。植物根际促生细菌可通过固氮[2]、解磷[3]、分泌酶[4]、产生激素[5]等途径帮助植物对矿质营养的吸收和利用[6],增强植物的光合作用并促进植物生长。光合作用是植物最基本的生理活动之一,是形成植物生产力的根本源泉,光合速率是植物生理性状的一个重要指标,也是估测光合生产能力的主要依据[7-8]。杨树Populus为落叶树种,是世界上栽培史最长,用途最广的树种之一。然而,随着杨树人工林的连作与过频的轮伐,中国杨树人工林发生了严重的地力衰退现象,影响了杨树健康生长。目前,探寻新的生物质肥料,以替代或部分替代化肥营造杨树速生丰产林的研究倍受关注。多噬伯克霍尔德氏菌BurkholderiamultivoransWS-FJ9菌株为江苏省入侵有害生物预防与控制重点实验室(本实验室)在前期研究中从松树Pinus根际筛选获得的1株根际促生细菌。前期的研究表明:该菌具有高效解磷能力,对哺乳动物和植物安全可靠,能够在杨树根际定殖,具有促进植物生长、生物防治和生物降解等多种功能[9-11]。为从光合作用的途径阐述该菌对杨树促生的机制,本研究探讨了接种WSFJ9菌株对NL-895杨光合参数、叶片的叶绿素含量及苗高、地径和生物量的影响,旨在阐明WS-FJ9菌株对NL-895杨的促生机制,为生物菌肥的开发与利用提供参考依据。
1材料与方法
1.1供试菌株及菌悬液的制备
多噬伯克霍尔德氏菌BurkholderiamultivoransWS-FJ9由本实验室采集于松树根际土壤,保藏于中国典型培养物保藏中心CCTCC(No.CCTCC M2011435)[12]。参照的促生菌株Pseudomonas fluorescensJWJS1由本实验室采集于杨树根际土壤,保藏于中国典型培养物保藏中心CCTCC(No.CCTCCM209027)[13]。将上述待测试菌株活化后,用接种环挑取少量菌体接种于装有50mL营养肉汤(nutrient broth,NB)培养基的100m L三角瓶中,28℃,200 r·min-1振荡培养48 h。发酵液(4℃,4 629×g)离心5 min,无菌生理盐水润洗菌体3次后,无菌生理盐水调节成浓度为1×108个·mL-1的菌悬液,备用。
1.2供试植物材料
供试植株为NL-895杨Populus×euramericanaNL-895。将NL-895杨的种子置于1.0 g·L-1的高锰酸钾中浸泡2 h,无菌水漂洗3次,播种在灭菌河沙内进行育苗,待出苗40 d后,选择长势一致的杨树幼苗移栽到花盆中,盆中培养基质为山土和草炭混合(体积比为2∶1),高压蒸汽灭菌,1.5 kg·盆-1,基质中速效氮为30.0 mg·kg-1,速效磷6.0 mg·kg-1,速效钾23.5 mg·kg-1。移栽后的盆栽幼苗置温室内统一管理。杨树苗接种WS-FJ9菌株后第30,60,90,120和150 d后测定光合指标,接种WS-FJ9菌株150 d后分别测定苗高、地径及杨树生物量。以接种JW-JS1菌株和灭菌水为双重对照。
1.3 杨树光合指标的测定
1.3.1 杨树光合参数的测定在接种解磷细菌WS-FJ9处理后30,60,90,120和150 d的典型晴天上午9:00-11:30进行测量,选取各处理NL-895杨上部第4~5个叶片,设3次重复。采用LI-6400XT便携式光合仪(Li-COR,美国)的红蓝光源叶室测定叶片的净光合速率(Pn,μmol·m-2·s-1),气孔导度(Gs,mol· m-2·s-1),胞间二氧化碳摩尔分数(Ci,μmol·mol-1)和蒸腾速率(Tr,mmol·m-2·s-1),设定光强800μmol· m-2·s-1。
1.3.2 杨树叶片叶绿素质量分数的测定采用丙酮提取法测定叶绿素质量分数[14-15]。在接种解磷细菌WS-FJ9处理后30,60,90,120和150 d,采集无病虫害、无机械损伤的叶片,洗净擦干后,剪成1~2 mm细丝,混匀。称取0.2 g鲜叶置入试管中,加入20mL丙酮与无水乙醇等体积混合液,保鲜膜封口后置黑暗处过夜。待试管中细丝完全变白,采用HWλIOSγ型紫外吸收分光光度计测定646 nm和663 nm处的光密度值D(646)和D(663),设3次重复。代入下式即可求出叶绿素质量分数。
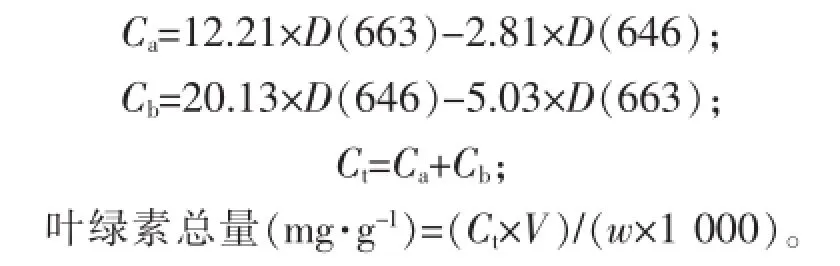
其中:Ca和Cb分别为叶绿素a和b的质量浓度(mg·L-1);Ct为叶绿素提取液的总质量浓度(mg·L-1);V为样品提取液总体积(mL);w为样品鲜质量(mg)。
1.3.3 杨树叶片叶绿素荧光参数的测定在接种解磷细菌WS-FJ9处理后30,60,90,120和150 d,选取各处理NL-895杨上部第4~5个叶片测量,设3次重复。采用LI-6400XT便携式光合仪测定叶片叶绿素荧光参数。主要测定指标:暗适应后的最小荧光(Fo),最大荧光(Fm),可变荧光Fv(Fv=Fm-Fo),PSⅡ原初光能转换效率(Fv/Fm);光适应后的稳态荧光(Ft),最大荧光(Fm′),PSⅡ实际的光化学反应量子效率ΦPSⅡ(ΦPSⅡ=(Fm′-Ft)/Fm′)。
1.4 杨树苗高、地径及生物量的测定
Richard Lange Perpetual Calendar“Terraluna”搭载的专利轨迹月相显示,展现观测者在北半球观望月亮、地球和太阳的位置。显示设备由三个圆盘组成,分别为天体圆盘、其下的月相盘、中间的地球圆盘。此布局中,摆轮即代表太阳的位置。轨迹月相显示准确追踪月球29日12小时44分3秒的朔望轨道,1058年后才出现一天的偏差。
杨树实生苗接种后150 d后测定苗高、地径及植株生物量。植株生物量的测定方法为:将植株取出清洗干净,105℃杀青30 min后在80℃下烘干至恒量后进行称量,4株·处理-1,5次重复。
1.5 数据分析与处理
采用Origin 8.6软件进行数据差异显著性检验及图表绘制。
2 结果与分析
2.1 接种WS-FJ9菌株对杨树叶片光合参数的影响
净光合速率(Pn)是反映作物光合效率的重要指标之一。由图1A可知:在温室条件净光合速率(Pn)总体呈现先升后降趋势。和对照相比,接种WS-FJ9和JW-JS1处理均能显著提高NL-895杨叶片净光合速率。5个测定期中接种WS-FJ9比对照分别增加了39.0%,46.6%,53.0%,68.9%和68.4%,接种JWJS1比对照分别增加了13.6%,22.4%,31.8%,37.7%和43.9%。经差异显著性检验,各时期各处理差异均达显著水平(P<0.05)。结果表明,接种WS-FJ9和JW-JS1处理均能显著提高NL-895杨的净光合速率(Pn),接种WS-FJ9处理优于接种JW-JS1处理。
由图1B可知:在处理期内,NL-895杨的气孔导度(Gs)呈先升后降趋势。和对照相比,接种WSFJ9和JW-JS1处理在30 d和60 d时气孔导度(Gs)差异均不显著,其后各处理差异均达显著水平。在处理90,120和150 d时接种WS-FJ9处理比对照分别增加了28.0%,46.2%和20.7%,接种JW-JS1处理比对照分别增加了16.0%,34.6%和13.8%。
由图1C可知:在处理期内,NL-895杨的胞间二氧化碳摩尔分数(Ci)呈先降后升再降趋势。接种WS-FJ9和JW-JS1处理均低于对照,在处理30 d和120 d时各处理间差异达显著水平,其余处理期各处理间差异不显著。在处理30 d和120 d时接种WS-FJ9处理比对照分别增加了9.0%和6.7%,接种JWJS1处理比对照分别增加了6.0%和3.4%。
蒸腾速率(Tr)是反映蒸腾作用强弱的一个重要指标,也是表征植物水分代谢的状况及水分利用效率的物理量。由图1D可知:在处理期内,NL-895杨的蒸腾速率(Tr)呈先升后降趋势。接种WS-FJ9和JW-JS1处理均高于对照,5个测定期中接种WS-FJ9处理比对照分别增加了22.6%,7.7%,17.4%,18.0%和10.4%,接种JW-JS1处理比对照分别增加了16.1%,5.1%,10.9%,12.0%和4.2%。
2.2 接种WS-FJ9菌株对杨树叶片荧光参数的影响
在荧光动力学参数中,Fv/Fm代表PSⅡ光化学的最大效率或PSⅡ原初光能转化效率,它反映了植物的潜在最大光合能力。ΦPSⅡ[ΦPSⅡ=(Fm′-Ft)/Fm′]表示作用光存在时PSⅡ实际的光化学量子效率。它反映在光照下PSⅡ反应中心部分关闭的情况下的实际光化学效率,常用来反映电子在PSⅠ和PSⅡ的传递情况,是荧光参数的重要组成部分。由图2可看出,在处理期内,接种WS-FJ9菌株处理的Fv/Fm和ΦPSⅡ值均高于接种JW-JS1处理和对照,表明接种WS-FJ9菌株能增强NL-895杨叶片的Fv/Fm和ΦPSⅡ值效应。
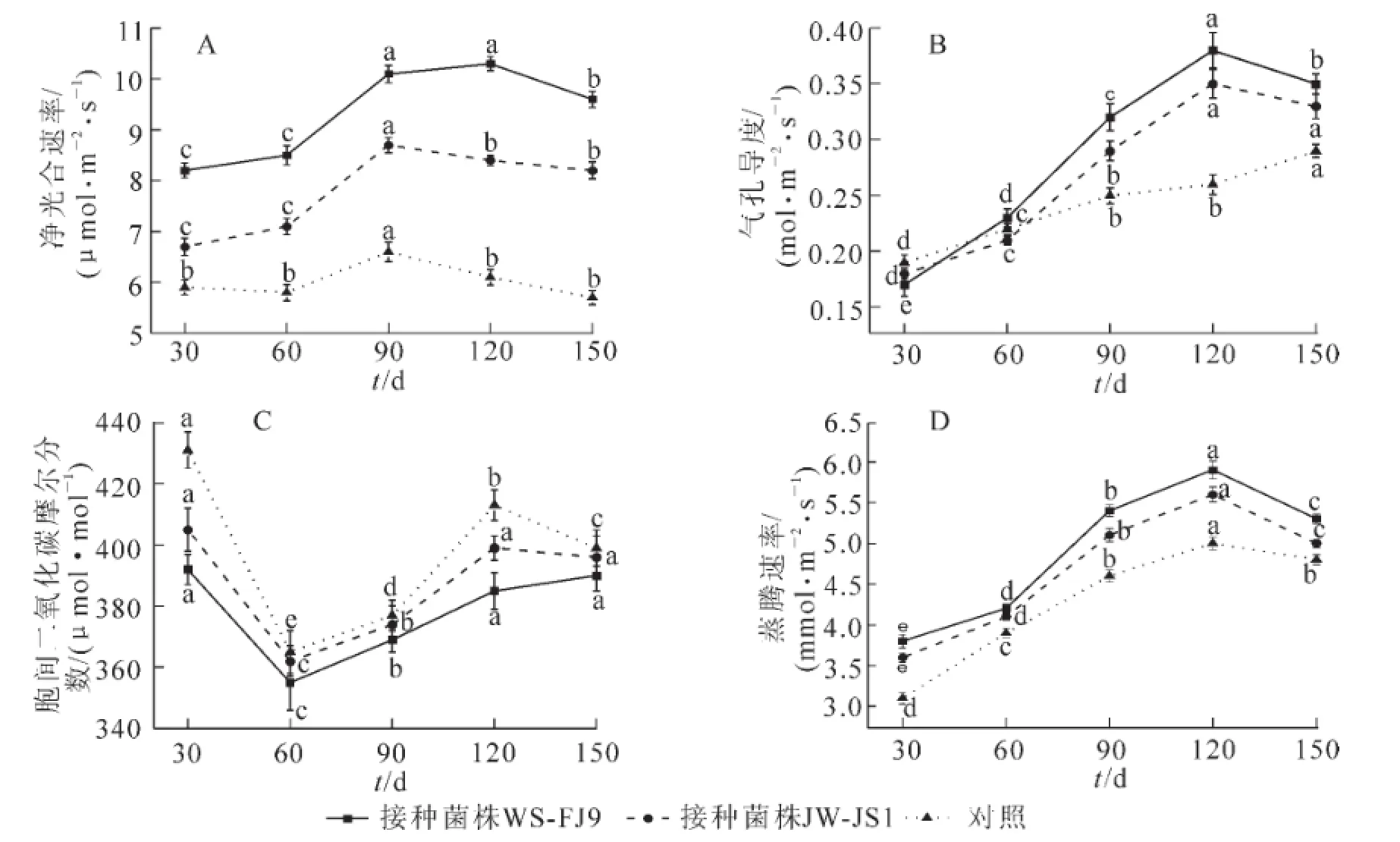
图1 接种WS-FJ9菌株对NL-895杨光合参数的影响Figure 1 Effect of inoculating strain WS-FJ9 on the photosynthetic parameter of NL-895 poplar seedlings
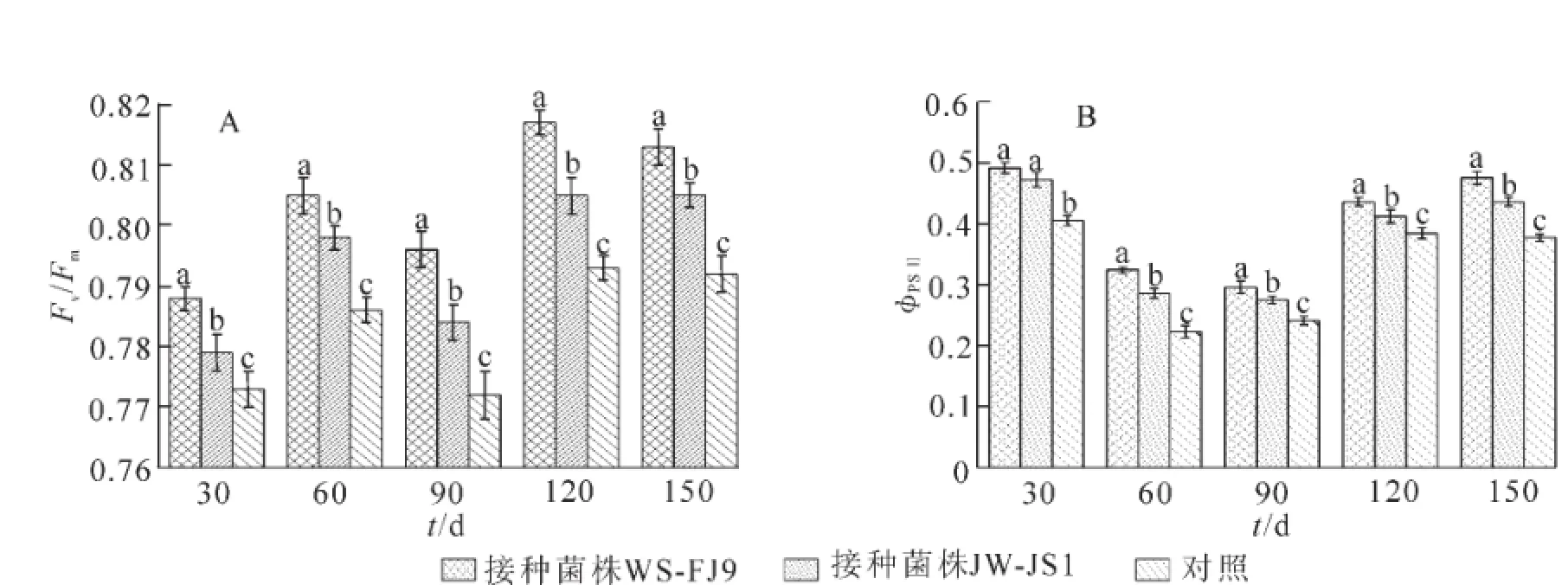
图2 接种WS-FJ9菌株对NL-895杨叶片荧光参数的影响Figure 2 Effectof inoculating strain WS-FJ9 on the fluorescence parameter of NL-895 poplar leaves
2.3 接种WS-FJ9菌株对杨树叶片叶绿素的影响
叶绿素是重要的光合作用物质,叶绿素质量分数在一定程度上反映植物光合作用的高低。由图3A可知:在处理期内,接种WS-FJ9和JW-JS1处理均高于对照,5个测定期中接种WS-FJ9处理比对照分别增加了21.4%,22.2%,20.7%,30.8%和36.0%,接种JW-JS1处理比对照分别增加了14.3%,7.4%,13.7%,23.1%和20.0%。表明接种WS-FJ9和JW-JS1处理均能显著提高NL-895杨的叶绿素总量,接种WS-FJ9处理优于接种JW-JS1处理。
植物叶绿素a/b比值在一定程度上反映了植物对光能利用能力的强弱。由图3B可知:在处理期内,接种WS-FJ9和JW-JS1处理均高于对照。经差异显著性分析,5个测定期中接种WS-FJ9处理叶绿素a/b比值均比其他2种处理显著增高,而接种JW-JS1处理和对照相比在30 d和60 d时差异不显著。表明接种WS-FJ9和JW-JS1处理均能增强NL-895杨对光能利用能力,但WS-FJ9的促生效果优于JW-JS1。
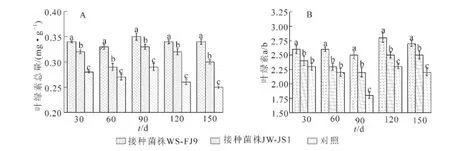
图3 接种WS-FJ9菌株对NL-895杨叶片叶绿素的影响Figure 3 Effect of inoculating strainWS-FJ9 on the chlorophyllof NL-895 poplar leaves
2.4 WS-FJ9菌株对杨树苗高、地径及生物量的的影响
在温室条件下,杨树实生苗接菌处理150 d后结果如表1和图4所示。接种WS-FJ9和JW-JS1处理的植株苗高、地径和生物量均显著地超过了不接种处理,接种WS-FJ9处理的苗高和生物量显著高于接种JW-JS1处理(P<0.05)。以上说明2株解磷细菌WS-FJ9和JW-JS1对杨树苗期均具有明显的促生长作用,施用WS-FJ9的效果优于JW-JS1。
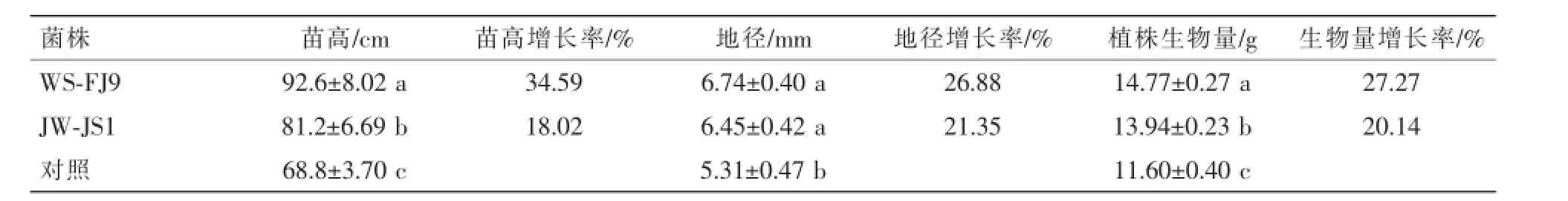
表1 WS-FJ9菌株对NL-895杨实生苗生长的影响Table 1 Effect of strainWS-FJ9 on seedling growth of NL-895 poplar seedlings
3 结论与讨论
光合作用是植物重要的物质积累与生产的代谢活动。近年来的研究表明接种解磷菌剂能增强植物的光合作用。余旋等[16]和吕德国等[17]研究发现:蜡状芽孢杆菌Bacillus cereus能显著提高美国山核桃Carya illinoensis苗和本溪山樱Cerasus sachalinensis苗的净光合速率(Pn)。唐菁[18]研究表明:土壤杆菌Agrbactersp.,微球菌Micrococcussp.,沙雷氏菌Serratiasp.显著增强了I-69杨幼苗的光合作用。刘辉等[13]研究表明:接种荧光假单胞菌Psudomonas fluorenscensJW-JS1及红绒盖牛肝菌Xerocomus chrysenteron显著增强NL-895杨的光合作用。陈丹[19]研究表明,将解磷细菌蜡状芽孢杆菌Bacillus cereusJYZ-SD1与外生菌根真菌红绒盖牛肝菌Xerocomus chrysenteron混合接种于杨树后能明显增强杨树叶片光合作用的各项指标。常河等[20]研究表明:土著丛枝菌根(AM)真菌对荔枝Litchi chinensis实生苗生长的影响与其对光合作用的影响密切相关。可见,生物菌肥可通过增强植物的光合作用促进植物的生长。本研究通过测定接种高效解磷细菌Burkholderia multivoransWS-FJ9对NL-895杨叶片净光合速率(Pn),蒸腾速率(Tr),气孔导度(Gs)等光合参数,从光合作用的角度阐明WS-FJ9菌株对杨树的促生机制。结果表明:接种WS-FJ9处理能显著增加NL-895杨叶片的净光合速率(Pn),蒸腾速率(Tr),气孔导度(Gs)等光合参数,增强了NL-895杨的光合作用,从而促进了杨树的生长。

图4 接种150 d后NL-895杨实生苗生长状况Figure 4 Growth of NL-895 poplar seedling after inoculation of 150 days
叶绿体色素含量是反映植物光合能力的一个重要指标。叶绿素的合成与分解之间存在着动态平衡,它直接影响植物的光合作用及有机物质的积累,进而影响植物的生长速度[21]。在荧光动力学参数中,Fv/Fm代表PSⅡ光化学的最大效率或PSⅡ原初光能转化效率,它反映了植物的潜在最大光合能力;ΦPSⅡ[ΦPSⅡ=(Fm′-Ft)/Fm′]表示作用光存在时PSⅡ实际的光化学量子效率,它反映在光照下PSⅡ反应中心部分关闭的情况下的实际光化学效率,常用来反映电子在PSⅠ和PSⅡ的传递情况,是荧光参数的重要组成部分。本研究结果表明,BurkholderiamultivoransWS-FJ9能显著增加NL-895杨叶片的叶绿素总量及叶绿素a/b比值,增加NL-895杨叶片的Fv/Fm和ΦPSⅡ值等荧光参数。
植物根际促生细菌对宿主植物的影响是多方面的,本研究从光合作用及生物量的途径阐述了B.multivoransWS-FJ9对杨树促生的机制并得出如下结论:通过增加NL-895杨叶片的叶绿素总量及叶绿素a/b比值增强其荧光效应,进而增强了NL-895杨的光合作用,从而促进了杨树的生长。B.multivoransWS-FJ9和Pseudomonas fluorescensJW-JS1均对杨树具有较好的促生效果,均可作为研制杨树专用解磷菌肥的资源菌株。但从测定的各指标看,WS-FJ9的促生效果要优于JW-JS1。因此,多噬伯克霍尔德氏菌B.multivoransWS-FJ9可以作为研发杨树生物菌肥的极有潜力的资源菌株。至于该菌对杨树养分代谢及土壤微环境等的影响,有待于进一步研究。
[1]BURR T J,SCHROTH M N,SUSLOW T.Increased potato yields by treatment of seedpieces with specific strains ofPseudomonas fluorescens and Pseudomonas putida[Bacterization][J].Phytopathology,1978,68:1377-1383.
[2]MISHRA PK,MISHRA S,SELVAKUMAR G,et al.Enhanced soybean(Glycinemax L.)plant growth and nodulation byBradyrhizobium japonicum-SB1 in presence ofBacillus thuringiensis-KR1[J].Acta Agric Scand Sect B Soil Plant Sci,2009,59(2):189-196.
[3]ADESEMOYE A O,TORBERTH A,KLOEPPER JW.Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrientmanagement system[J].Can JMicrobiol,2008,54(10):876-886.
[4]KIM K Y,JORDAN D,McDONALD G A.Effect of phosphate-solubilizing bacteria and vesicular-arbuscularmycorrhizae on tomato growth and soilmicrobial activity[J].Biol Fert Soils,1997,26(2):79-87.
[5]ASGHAR H N,ZAHIR Z A,ARSHAD M.Screening rhizobacteria for improving the growth,yield,and oil content of canola(Brassica napusL.)[J].Crop Pasture Sci,2004,55(2):187-194.
[6]VESSEY JK.Plant growth promoting rhizobacteria as biofertilizers[J].Plant Soil,2003,255(2):571-586.
[7]上官周平,陈培元.水分胁迫对小麦光合作用的影响及其抗旱性的关系[J].西北植物学报,1990,10(1):1-7.
SHANGGUAN Zhouping,CHEN Peiyuan.Effects of water stress on photosynthesis of wheat leaves and their relation to drought resistance[J].Acta Bot Boreal-Occident Sin,1990,10(1):1-7.
[8]黄大国.影响长江中下游滩地杨树净光合速率的生理生态因子的初步研究[J].华东森林经理,2002,16(1):10-13.
HUANG Daguo.Preliminary studies on relationship between the net photosynthesis rate and eco-physiological factors of popular on beach land inmiddle lower reaches area along the Yang-zi river[J].East China For Manage,2002,16(1):10-13.
[9]LIGuanxi,WU Xiaoqin,YE Jianren.Biosafety and colonization ofBurkholderiamultivoransWS-FJ9 and its growth promoting effects on poplars[J].Appl Microbiol Biotechnol,2013,97(24):10489-10498.
[10]李冠喜,吴小芹,叶建仁.杨树根际土自毒物质的积累、毒害及生物修复[J].南京林业大学学报:自然科学版,2013,37(3):71-76.
LIGuanxi,WU Xiaoqin,YE Jianren.Accumulation,toxic properties and bioremediation of autotoxic substance in poplar rhizosphere soil[J].JNanjing F Univ Nat Sci Ed,2013,37(3):71-76.
[11]李冠喜,吴小芹,叶建仁.多噬伯克霍尔德氏菌WS-FJ9对草甘膦降解特性的研究[J].生态学报,2013,33(21):6885-6894.
LIGuanxi,WU Xiaoqin,YE Jianren.Study on the characterization of glyphosate degradation byBurkholderiamultivoransWS-FJ9[J].Acta Ecol Sin,2013,33(20):6885-6894.
[12]侯亮.松树根际高效解磷细菌的筛选及其解磷特性的研究[D].南京:南京林业大学,2012.
HOU Liang.Studies on Screening of Efficient Phosphate-solubilizing Bacteria in the Rhizosphere of Pine Trees and on Their Characteristics[D].Nanjing:Nanjing Forestry University,2012.
[13]刘辉,吴小芹,任嘉红,等.荧光假单胞菌及红绒盖牛肝菌接种对NL-895杨生长和光合特征的影响[J].西部林业科学,2012,41(1):53-59.
LIU Hui,WU Xiaoqin,REN Jiahong,et al.Effect of inoculatingPseudomonas fluorescens and Xerocomus chrysenteronon growth and photosynthetic characteristics of NL-895 poplar[J].JWestChina For Sci,2012,41(1):53 -59.
[14]王晶英,敖红,张杰.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:135-136.
[15]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-137.
[16]余旋,朱天辉,刘旭,等.不同解磷菌剂对美国山核桃苗生长、光合特性及磷素营养的影响[J].果树学报,2010,27(5):725-729.
YU Xuan,ZHU Tianhui,LIU Xu,et al.Effects of different phosphate solubilizing bacteria on growth,photosynthetic characteristics and phosphate nutrition of pecan[J].JFruit Sci,2010,27(5):725-729.
[17]吕德国,于翠,秦嗣军,等.本溪山樱根部解磷细菌的定殖规律及其对植株生长发育的影响[J].中国农业科学,2008,41(2):508-515.
LÜDeguo,YU Cui,QIN Sijun,et al.Colonization regulation pattern of phosphobacteria and its effect on the growth and development ofCerasus sachalinensis[J].Sci Agric Sin,2008,41(2):508-515.
[18]唐菁.杨树施用细菌肥料的增长效应及作用机理研究[D].北京:中国林业科学研究院,2006.
TANG Jing.Studies on Promotion of Bacterial Fertilizers on Poplar Growth and Its Mechanism[D].Beijing:Chinese Academy of Forestry,2006.
[19]陈丹.杨树解有机磷细菌与菌根真菌互作效应研究[D].南京:南京林业大学,2011.
CHEN Dan.Study on the Interacting Effect Between Organophosphate-Degrading Bacteria and Ectomycorrhizal Fungi for Poplars[D].Nanjing:Nanjing Forestry University,2011.
[20]常河,朱红惠,陈杰忠,等.土著AM真菌对荔枝实生苗生长和光合特性的影响[J].热带作物学报,2009,30(7):912-917.
CHANG He,ZHU Honghui,CHEN Jiezhong,et al.Influence of indigenous arbuscularmycorrhizal fungion growth and photosynthesis of litchi seedlings[J].Chin JTropic Crop,2009,30(7):912-917.
[21]刘军辉.中林46杨胶合板用材林施肥与营养诊断研究[D].保定:河北农业大学,2006.
LIU Junhui.The Study on Fertilization and Nutrient Diagnosis of Poplar ZL-46 Plantation for Plywood[D].Baoding:Hebei Agricultural University,2006.
Increasing photosynthesis and biomass of poplars with Burkholderiamultivorans WS-FJ9
LIGuanxi1,2,3,WU Xiaoqin1,3,YE Jianren1,3
(1.College of Forest Resources and Environment,Nanjing Forestry University,Nanjing 210037,Jiangsu,China;2. Lianyungang Academy of Agricultural Sciences,Lianyungang 222006,Jiangsu,China;3.Jiangsu Key Laboratory for Prevention and Management of Invasive Species,Na n jing Forestry University,Nanjing 210037,Jiangsu,China)
To study the growth-promoting mechanisms ofBurkholderia multivoransWS-FJ9 on poplars,photosynthetic indexes[net photosynthetic rate(Pn),transpiration rate(Tr),stomatal conductance(Gs),and intercellular CO2concentration(Ci)]and fluorescence parameters[Fv/Fm,ΦPSII,total chlorophyll(TChl),and Chla/Chlb]of NL-895 poplar(P opulus×euramericanaNL-895)leaves inoculated with a strain ofWS-FJ9 were determined by a portable photosynthetic apparatus(LI-6400XT).Simultaneously,chlorophyll content of poplar leaves,seedling height,ground diameter,and biomassweremeasured.Results showed that during the treatment period(150 days),Pn,Trand Gsall increased earlier and decreased later with Pnand Trhigher,and Cilower than control groups(P<0.05).At the 30th day,Gswas lower and after the 60th day higher than the control groups(P<0.05);whereas Ciwas reversed.The fluorescence parameters Fv/Fm,ΦPSII,TChl,and Chla/Chlb were higher than the control groups(P<0.05).At the 150th day,seedling height,ground diameter,and biomasswere also greater than the control groups(P<0.05).This study illustrated the growth-promotingmechanisms of strain WS-FJ9 on NL-895 poplar from the perspective of photosynthesis and biomass,provided a reference basis for development and utilization of bio-bacterialmanure,and could be of great importance in popularizing sustainable agriculture.[Ch,4 fig.1 tab.21 ref.]
plant physiology;growth-promotingmechanisms;photosynthetic parameters;fluorescence parameters;chlorophyll;biomass
S718.43
A
2095-0756(2014)04-0570-07
2013-10-08;
2013-11-30
国家林业公益性行业科研专项(201004061);江苏省重大科技支撑与自主创新专项项目(BE2008393);江苏省普通高校研究生科研创新计划项目(CXLX11-0552);江苏高校优势学科建设工程资助项目(PAPD)
李冠喜,副研究员,博士,从事微生物学研究。E-mail:guanxili@163.com。通信作者:吴小芹,教授,博士生导师,从事微生物学研究。E-mail:xqwu@njfu.edu.cn
