过氧化物酶体增殖物活化受体-β/δ激动剂GW501516对老龄脓毒症大鼠心功能的影响
2014-04-27王彩蕊周国鹏
王彩蕊,周国鹏
(北京大学第一医院老年科,北京 100034)
脓毒症(sepsis)是重症患者首要的死亡原因之一[1]。每年重症脓毒症的发病率大概为132/100 000,死亡率接近50%[2]。脓毒症的发生率与年龄呈正相关,随着年龄的增长,其发病率和死亡率均增加,并且年龄也成为独立的预后指标[3]。脓毒症是由感染因素引起的全身炎症反应综合征,如果不加以干预,继续发展可以引起重症脓毒症(severe sepsis)及脓毒症休克(septic shock),最终导致多器官功能障碍。此病的发病机制复杂,细胞因子的失控释放、缺血再灌注、缺氧、免疫失调、凝血-纤溶紊乱[4]等都起到作用,但是各种因素互相影响,仅以单一的机制还不能完全解释。
我国目前已进入老龄化社会,老年人的医疗费用支出成为国民经济的重大负担。由于老年人群的特殊性,比如营养状态下降、免疫力下降、基础疾病增加,患脓毒症的风险也增加。因此改善老年脓毒症患者的器官功能,对于提高老年人的生存质量、减轻国家的医疗负担极其重要。
脓毒症诱发性心肌功能障碍(sepsis-induced myocardial dysfunction,SIMD)是脓毒症及脓毒症休克患者常见的并发症,其发生率可高达40%~50%,是造成脓毒症预后不良的重要原因之一[5],合并SIMD的脓毒症患者死亡率可达70%~90%,而不合并SIMD的脓毒症患者死亡率仅为20%[5−7]。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一类配体依赖的转录因子核受体家族成员。PPARs有3种异构形式,分别是PPARα、PPARβ/δ和PPARγ。作为转录因子,PPARs调节脂代谢和糖代谢,同时还与细胞分化和炎症有关[8,9]。目前许多研究均显示PPARα和PPARγ的配体可以减轻休克模型的器官损伤[10,11],PPARβ/δ在这方面的研究还较少。但有研究显示,PPARβ/δ的合成配体在动脉粥样硬化、心肌梗死、急性肾衰竭以及肺炎方面均显示了抗炎活性[12]。本研究通过制作老龄大鼠脓毒血症模型,给予PPARβ/δ激动剂GW501516,初步探索PPARβ/δ对老年脓毒症大鼠心脏功能的影响。
1 材料与方法
1.1 实验动物及模型制备
1.1.1 药品 PPARβ/δ的配体GW501516购自瑞士Alexis公司,预溶于二甲基亚砜。
1.1.2 动物及分组 50只SPF级雄性SD大鼠,24月龄,体质量为(800±50)g,由北京大学医学部实验动物中心提供,所有动物实验均遵循《实验动物保护条例》。动物随机分为4组:空白对照组(Con组,n=5)、假手术组(Sham组,n=6)、盲肠结扎穿孔(cecal ligation and puncture,CLP)组(CLP组,n=19)和CLP手术+GW501516干预组(CLP+GW组,n=20)。
1.1.3 CLP法制作大鼠脓毒症模型 术前6h禁食,自由饮水。术前称重,予3%戊巴比妥钠(0.1ml/kg)腹腔麻醉,沿腹中部做长1.0~1.5cm的切口,分离盲肠,4号丝线在盲肠中上部结扎,用20号针头在盲肠穿孔1次,并挤出稍许粪便,将盲肠还纳,并逐层缝合腹腔。假手术组大鼠不进行盲肠结扎和穿孔,只做开腹、分离盲肠和缝合的步骤。所有大鼠术后均在背部皮下注射生理盐水(37℃,5ml/100g)进行液体复苏,并将二甲基亚砜或溶于二甲基亚砜的GW501516与生理盐水共同注射,以便稀释二甲基亚砜的局部作用。术后让其自由饮食,并密切观察。
1.1.4 GW501516的用量及用法 文献中报道GW501516的EC50=1.1nmol/L时,在人体与其他亚型比有1000倍的高选择性,而EC50=24nmol/L时,在小鼠体内与其他亚型比有500倍的高选择性[13]。由于没有提供大鼠的有效剂量,因此我们取二者的中位浓度即10nmol/L进行计算,进而推出GW501516的有效剂量为0.05mg/100g,且预实验结果(结果未给出)也初步证实这个剂量是有效的。将GW501516按5g/L的浓度溶于二甲基亚砜中,按10µl/100g的量与生理盐水混匀后皮下注射,Sham组和CLP组注射相同剂量的二甲基亚砜。
1.2 超声心动图对心功能的评价
术后48h麻醉(3%戊巴比妥钠0.1ml/kg腹腔注射)后,将大鼠仰卧位放置在超声检查台上,使用Siemens Acuson Sequoia 512超声系统,Acuson8- 20MHz探头,经大鼠心脏左心室乳头肌水平行M型超声检查。每只大鼠的指标均在连续5个心动周期进行测量后取平均值,我们将左心室假想为一个球体并使用超声后处理系统对图像进行测量计算,测量指标包括:心率(heart rate,HR)、左室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end systolic dimension,LVESD)。参照相关文献[14]计算评价左室收缩和舒张功能的指标。左室舒张末期容积(left ventricular end diastolic volume,LVEDV)=LVEDD3,左室收缩末期容积(left ventricular end systolic volume,LVESV)=LVESD3,每搏输出量(stroke volume,SV)=LVEDV−LVESV,心指数(cardiac index,CI)=(SV×HR)/体表面积(body surface area,BSA),左室射血分数(left ventricular ejection fraction,LVEF)=(SV/LVEDV)×100%。
1.3 统计学处理
采用SPSS17.0对所得实验数据进行统计学分析。计量资料以均数±标准差(±s )表示。多组间的比较采用单因素方差分析(One way-ANOVA),两两比较采用Lsd多重比较法,生存曲线比较采用Log-rank(Mantel-Cox)检验。P<0.05为差异有统计学意义。
2 结 果
2.1 GW501516增加CLP术后老年脓毒症大鼠的生存率
CLP术后应用液体复苏模型能很好地模拟人体脓毒症的多种微生物感染状态。在本实验中,老龄大鼠接受CLP手术后,6h左右即出现死亡,且48h内死亡率高达42.1%,而给予GW501516治疗组死亡开始时间延迟至10h左右,且48h内总死亡率仅15.0%(P<0.05),差异有统计学意义。可见GW501516能明显地增加老龄脓毒症大鼠48h内的生存率(图1)。
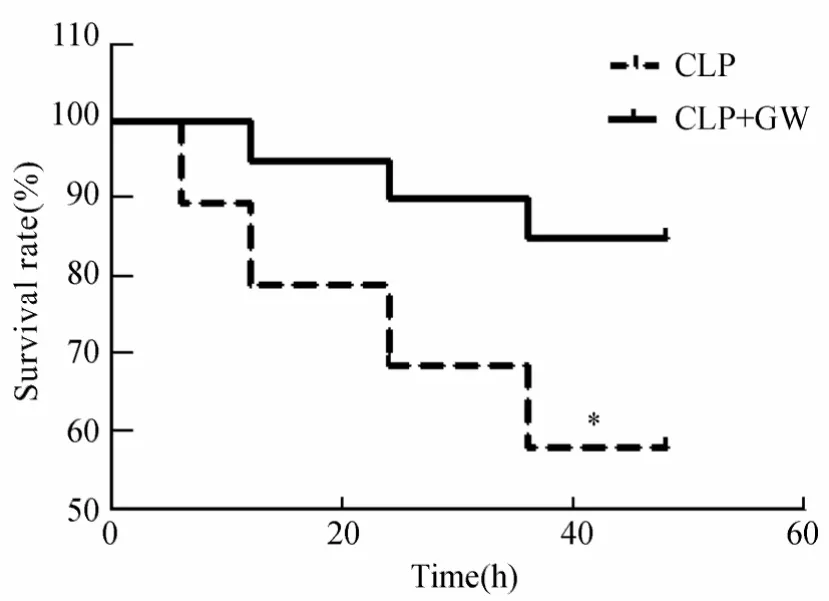
图1 生存曲线Figure 1 Survival curve of rats in CLP and CLP+GW groups
2.2 GW501516改善脓毒症老龄大鼠的心功能
CLP术后48h应用超声心动图评价老龄大鼠心功能,结果见表1。(1)HR和LVEF:CLP组较Sham组HR和LVEF均明显增加,CLP+GW组较CLP组HR和LVEF均下降。(2)SV和CI:CLP组与Sham组比较,SV和CI明显降低,CLP+GW组较CLP组SV和CI明显增加。(3)LVEDD和LVEDV:CLP手术组与Sham组比较,LVEDD和LVEDV均明显降低,CLP+GW组较CLP组LVEDD和LVEDV均明显增加。Con组和Sham组的上述指标差异均无统计学意义。
表1 各组老龄大鼠心功能指标Table 1 Cardiac function indices of aged rats (±s )

表1 各组老龄大鼠心功能指标Table 1 Cardiac function indices of aged rats (±s )
Con:control group; Sham:sham operation group; CLP:cecal ligation and puncture group; CLP+GW:CLP+GW501516 (0.05mg/100g) group; HR:heart rate; LVEF:left ventricular ejection fraction; SV:stroke volume; CI:cardiac index; LVEDD:left ventricular end-diastolic diameter; LVEDV:left ventricular end-diastolic volume.Compared with sham group, *P<0.05, **P<0.01, ***P<0.001; compared with CLP group, #P<0.05; ##P<0.01
Group n HR(beat/min) LVEF(%) SV(ml/beat) CI[ml/(min·mm−2)] LVEDD(mm) LVEDV(ml)Con 05 345.48±18.48 0.71±0.08 457.23±58.47 198.43±25.56 08.6±0.63 6.36±0.67 Sham 06 333.67±22.76 0.69±0.13 433.14±130.70 191.81±56.7 8.56±1.14 6.26±1.31 CLP 19 411.16±10.11** 0.93±0.04* 171.47±39.85* 102.05±19.94* 5.65±0.45* 1.75±0.39***CLP+GW 20 318.55±16.65## 0.89±0.04# 470.71±111.6# 185.00±41.21# 8.02±0.66# 5.13±1.09##
3 讨 论
脓毒血症是临床危重症患者主要的死亡原因之一,在美国,因脓毒症住院的患者已经超过了心肌梗死。心功能障碍是脓毒症和脓毒症休克患者重要的伴随症状。据实验观察,脓毒症幸存者与非幸存者相比,LVEF值降低,而LVEDV却增大,提示这是对心功能的一种保护机制。LVEF值的降低是可逆的,幸存者7~10d可完全恢复。脓毒症导致的心功能不全表现为收缩和舒张功能的联合障碍,涉及多方面的机制,如心脏微循环的改变、心肌抑制因子、线粒体功能障碍、代谢改变、NO、心肌细胞凋亡等,而目前较公认的机制是心肌抑制因子和代谢改变。
本实验中所采用的CLP模型,与临床脓毒症相关性较强[15],因此能很好地模拟脓毒症的病理生理变化。实验中老龄大鼠CLP术后48h死亡率为42.1%,这与文献报道的40%~50%的死亡率相符,并且术后8h左右即出现死亡,而应用PPARβ/δ激动剂GW501516液复苏后,死亡率下降到15.0%,并且开始出现死亡时间推迟至CLP术后10h左右,这说明应用PPARβ/δ激动剂,能改善脓毒症大鼠早期生存率,并推迟死亡时间。同时,超声心动图显示,CLP手术后,老龄大鼠心功能明显受损,HR增快,SV和CI等反映心脏排血功能的指标均明显下降,LVEDD和LVEDV等反映左室舒张功能的指标也明显下降,提示脓毒症导致的心功能不全,既有收缩功能又有舒张功能不全,更主要表现为舒张功能的障碍。由于感染、心律失常等因素使脓毒症患者心率增加,加之心室舒张功能不全,导致左心室充盈受限,虽然这时LVEF增加,左心室过度收缩有部分代偿,但心搏储量较对照组仍然降低,仍然不能满足机体的高代谢状态,且容易导致心肌的能量缺乏。SV和CI降低,意味着CLP组老龄大鼠心脏功能障碍,不能维持机体足够循环血量,从而容易发生休克而影响全身重要脏器的能量供应。应用GW501516复苏后,老龄大鼠HR降低,使得心肌耗氧量减少,心室舒张时间相对延长,有利于心室充分充盈。CLP+GW组的LVEDD和LVEDV均增加,可看成是通过Frank-Starling机制保持心输出量的重要的适应性改变,并且认为这与低死亡率、预后改善有关。心室舒张功能的改善有利于维持充足的SV和CI,因此CLP+GW组较CLP组的SV和CI也增加,这有利于维持脓毒症大鼠的组织灌注,从而减少休克的发生,保证重要器官的血液供应。有研究显示幸存者与非幸存者相比,往往有低的LVEF和高的LVEDV,应用CLP+GW组LVEF较对照组降低,提示这也是预后良好的指标[16]。GW501516明显改善脓毒症大鼠心脏收缩和舒张功能,降低心率,增加心脏做功效率,这对于改善脓毒症大鼠的心功能及改善全身循环状态具有重要的意义,也是其降低老龄脓毒症大鼠死亡率的重要原因。
GW501516为高选择性PPARβ/δ配体,目前还未应用于临床,但在血脂紊乱、糖尿病和动脉粥样硬化等代谢相关疾病中具有重要的调节作用。目前的结果提示GW501516对于改善老龄脓毒症患者的心功能可能具有重要的意义。PPARβ/δ在大多数组织器官均有表达,并且在胚胎早期已经出现,目前认为这类受体主要参与机体能量代谢的调控,而其在炎症方面的作用也正在引起人们的关注。推测GW501516降低脓毒症患者死亡率,改善心功能的作用,主要与其抗炎和调节能量代谢的作用有关,而其具体的分子机制有待于进一步的研究和探讨。
【参考文献】
[1] Annane D, Bellissant E, Cavaillon JM. Septic shock[J].Lancet, 2005, 365(9453):63−78.
[2]Dombrovskiy VY, Martin AA, Sunderram J,et al. Rapid increase in hospitalization and mortality rates for severe sepsis in the United States:a trend analysis from 1993 to 2003[J]. Crit Care Med, 2007, 35(5):1244−1250.
[3]Martin GS, Mannino DM, Moss M. The effect of age on the development and outcome of adult sepsis[J]. Crit Care Med, 2006, 34(1):15−21.
[4]Zheng. GJ, Sun. Q, Li YP,et al. Inflammation,endothelium, coagulation in sepsis[J]. Chin Crit Care Med,2009, 21(9):573−576. [郑贵军, 孙 茜, 李银平, 等.炎症、内皮、凝血与脓毒症[J].中国危重病急救医学,2009, 21(9):573−576.]
[5]Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction[J]. Crit Care Med, 2007, 35(6):1599−1608.
[6]Parrilo JE, Parker MM, Natanson C,et al. Septic shock in humans. Advances in the understanding of pathogenesis,cardiovascular dysfunction, and therapy[J]. Ann Intern Med, 1990, 113(3):227−242.
[7]Vieillard-Baron A, Caille V, Charron C,et al. Actual incidence of global left ventricular hypokinesia in adult septic shock[J]. Crit Care Med, 2008, 36(6):1701−1706.
[8]Duan SZ, Usher MG, Mortensen RM. PPARs:the vasculature, inflammation and hypertension[J]. Curr Opin Nephrol Hypertens, 2009, 18(2):128−133.
[9]Gervois P, Fruchart JC, Staels B. Drug insight:mechanisms of action and therapeutic applications for agonists of peroxisome proliferator-activated receptors[J].Nat Clin Pract Endocrinol Metab, 2007, 3(2):145−156.
[10]Di Paola R, Esposito E, Mazzon E,et al. Absence of peroxisome proliferators-activated receptors (PPAR)alpha enhanced the multiple organ failure induced by zymosan[J]. Shock, 2006, 26(5):477−484.
[11]Marzocco S, Di Paola R, Mazzon E,et al. The cyclopentenone prostaglandin 15-deoxydelta (12,14)-prostaglandin J2 attenuates the development of zymosan-induced shock[J]. Intensive Care Med, 2005,31(5):693−700.
[12]Yang X, Kume S, Tanaka Y,et al. GW501516, a PPARδ agonist, ameliorates tubulointerstitial inflammation in proteinuric kidney disease via inhibition of TAK1-NF-κB pathway in mice[J]. PLoS ONE, 2011, 6(9):e25271.
[13]Oliver WR Jr, Shenk JL, Snaith MR,et al.A selective peroxisome proliferator-activated receptor delta agonist promotes reverse cholesterol transport[J]. Proc Natl Acad Sci USA, 2001, 98(9):5306−5311.
[14]Boluyt MO, Comverso K, Hwang HS,et al.Echocardiographic assessment of age-associated changes in systolic and diastolic function of the female F344 rat heart[J]. J Appl Physiol, 2004, 96(2):822−828.
[15]Zhu XQ, Liu QQ, Yao YM. Research progress of preparation method in sepsis animal modol[J]. Chin Crit Care Med, 2006, 18(2):114−116. [朱雪琦, 刘清泉,姚咏明. 脓毒症动物模型制备方法的研究进展[J]. 中国危重病急救医学, 2006, 18(2):114−116.]
[16]Furian T, Aguiar C, Prado K,et al. Ventricular dysfunction and dilation in severe sepsis and septic shock:relation to endothelial function and mortality[J]. J Crit Care, 2012, 27(3):319. e9−e15.
