老年女性腰椎骨折后骨密度及骨代谢指标的动态变化
2014-04-27张孜君
张孜君,赵 文*,赵 玺,2,孙 璟
(1北京航天总医院骨科,北京 100076;2遵义医学院研究生院,遵义 563003)
随着现代社会人们经济水平和生活水平的提高,人们的预期寿命也大大延长,全世界逐步进入老龄化社会,老龄化问题越来越突出。而这种老龄化问题在中国尤为突出,据统计国内≥60岁老年人已有1.73亿[1]。因为老年人的体内代谢与饮食结构发生了改变,所以他们机体内的骨代谢失去平衡,是骨质疏松症的高危人群。在2006年的统计当中,国内低骨量的人群已经达到2.1亿,而骨质疏松的人群达到了6 944万,老年女性占了绝大多数[2]。骨质疏松症的患者具有骨量减少与骨的微观结构退化的特征,以致骨的脆性增加,从而导致在无外伤或轻微外伤的情况下发生骨折,最常见的部位是锥体、髋部和腕部[3]。在全身骨折中,腰椎骨折后的制动进一步加重了骨质疏松,骨质疏松又增加了患者二次骨折的发生率,从而形成恶性循环。极大地降低了老年女性的日常生活质量,也是老年女性常见的死亡原因。因此,研究老年女性腰椎骨折骨密度变化的规律、阻止其骨量丢失对于提高这类特殊群体的生活质量及生存率具有重要意义。随着骨代谢指标的深入研究,使动态观察骨折后机体骨形成及骨吸收过程成为可能。关于骨折后骨代谢指标及骨密度变化量的前瞻性研究在上世纪60年代就开始有国内外文献报道[4],但主要集中于胫腓骨和踝关节骨折患者,且样本量较低[5,6]。本研究通过连续的随访,观察老年女性腰椎骨折患者骨密度及骨代谢指标在骨折愈合后6~12个月时间内具体的变化情况,为骨代谢指标的临床应用提供理论依据,有效预防二次骨折。
1 对象与方法
1.1 对象
选取北京航天总医院骨科以摔伤后腰部疼痛伴活动障碍为主诉的女性骨质疏松症患者76例。所有受试者均符合以下纳入及排除标准:(1)根据病史、症状、体征、腰椎正侧位X线及腰椎CT+三维重建明确诊断为腰椎骨折;(2)年龄≥65岁,绝经时间≥15年;(3)骨折前6个月内未使用过类固醇类药物、甲状腺激素、利尿药、肝素、抗惊厥药物等;(4)研究对象均排除糖尿病、甲状腺功能亢进、甲状旁腺功能亢进、原发或继发性肾上腺功能障碍、恶性肿瘤;(6)受试者均自愿参加本实验研究。
1.2 研究方法
1.2.1 随访 由于时间及人力有限,未能取得骨折之前各研究对象的骨密度及骨代谢指标的值,而使用骨折后4h内所测得的值代替基线值,可能造成一定误差。但根据Ivaska等[7]的研究,骨折4h内各骨代谢指标血清水平受到创伤应激及皮质醇分泌的影响尚不显著。故本试验在骨折后4h内进行首次骨代谢指标测量,并将其看作近似基线值。
76例受伤到第一次抽取静脉血的时间段内均未进食,每名研究对象于伤后4h内行第一次骨密度检查及抽血测定血清骨代谢指标值;伤后3d,6个月,12个月时行骨密度及血清骨代谢指标复查;骨折后4,6个月复查腰椎CT+三维重建了解骨折愈合情况,对于骨折延迟愈合病例,本文暂不纳入,今后将单独进行研究。
在随访1年的过程中,76例研究对象有12例由于自身原因失访,8例在6个月时仍未达到临床及影像学愈合,7例因诊断出糖尿病、冠状动脉粥样硬化性心脏病、脑梗死等疾病服用抗凝药等影响骨代谢率的药物,1例诊断出恶性肿瘤。其余48例研究对象按要求完成了随访。
1.2.2 骨密度测定 以双光能X线吸收法(美国Lunar公司DPX-L型双能X线骨密度测量仪)测定每个病例的骨密度。测量部位:伤椎、健椎(L1~L4椎体,如包含伤椎则将其剔除)、双侧髋部。
1.2.3 骨代谢指标的测定 采用酶联免疫法(ELISA)(德国IDS公司生产的酶联免疫吸附测试试剂盒,仪器采用Multiskan Mk3酶标仪)测定以下4项骨代谢指标:骨碱性磷酸酶(bone alkaline phosphatase,BAP)、骨γ-羧基谷氨酸蛋白(骨钙素,bone γ-carboxyglutamic acid containing proteins,BGP,osteocalcin)、Ⅰ型胶原交联羧基端肽(C-terminal telopeptide of type Ⅰcollagen,CTX-Ⅰ)、血清抗酒石酸酸性磷酸酶5b(tartrate-resistant acid phosphatase 5b,TRACP5b)。每名研究对象空腹>12h,清晨(除伤后首次抽血不一定为清晨)抽静脉血3.5ml。离心分离血清,-40℃冰冻保存待检。
1.3 统计学处理
采用SPSS统计软件进行数据分析,计量资料采用均数±标准差表示。由于各研究对象所测定的骨密度及骨代谢指标水平均符合正态分布,故创伤时与各随访时间点的骨密度及骨代谢指标值的差异比较采用配对样本的t检验。骨折愈合早期伤椎骨密度改变量与各骨代谢指标血清水平变化的相关性研究采用多重线性相关分析求偏相关系数。P<0.05为差异具有统计学意义。
2 结果
2.1 研究对象骨密度及骨代谢指标在骨折愈合后的变化
患者在伤后6个月,即骨折完全愈合时,伤椎与健椎骨密度显著低于基线(P<0.01),双髋骨密度差异无统计学意义;骨代谢各项指标较受伤时均有明显改变(P<0.05;表1)。患者在伤后12个月,即骨折完全愈合6个月,伤椎与健椎骨密度显著低于基线(P<0.05),而双髋骨密度差异无统计学意义;血清BGP水平仍显著高于基线值(P<0.01),其余骨代谢指标恢复到基线水平(表1)。
2.2 骨折愈合后伤椎BMD与各骨代谢指标血清含量的多元线性回归分析
患者伤后6~12个月,偏回归系数有统计学意义的指标为BGP(b=0.123)。其余3项骨代谢指标血清水平与△Z-score的偏回归系数无统计学意义(表2)。
3 讨论
骨密度是指骨骼矿物质的密度,可以直接反映骨微结构的质量及骨骼的强度,与骨的矿化程度、骨胶原及骨基质的特性以及骨的代谢转化等多种因素有关[8,9]。大量研究表明,骨折后的疼痛和固定会对骨折患者的骨代谢产生影响,加快骨分解的速度,从而导致机体内骨量的丢失。同时骨折愈合时,会加快骨转换,增加骨破坏与骨形成,这种高转换率可以进一步降低骨折局部乃至全身的骨密度[10,11]。本次研究的结果与这种观点一致,所有腰椎骨折患者在伤后6个月都已达到临床及影像学愈合标准,而此时患椎及健椎的骨密度还明显低于基线值,在伤后12个月(即骨折愈合后6个月)患椎及健椎的骨密度仍然低于基线值,说明在骨折愈合半年内骨质量与骨强度没有恢复到正常水平,罹患二次骨折的风险大大增加。
表1 研究对象在伤后6个月及12个月骨密度及骨代谢指标的变化Table1 Changes of bone mineral density and bone metabolism indices in the elderly women 6 and 12 months after vertebra fractures(n=48, ±s )
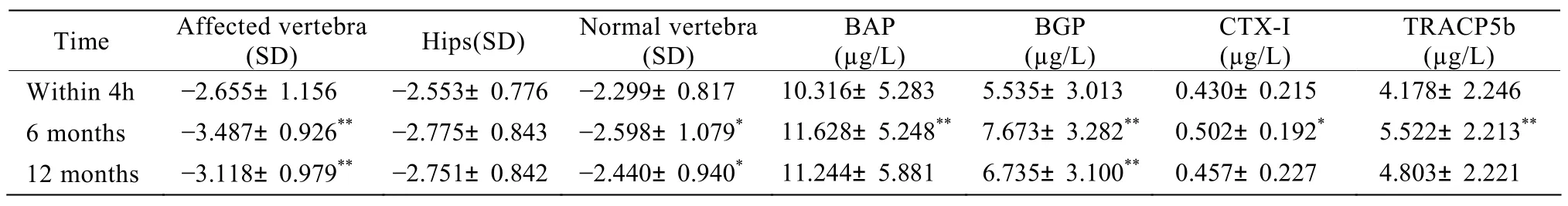
表1 研究对象在伤后6个月及12个月骨密度及骨代谢指标的变化Table1 Changes of bone mineral density and bone metabolism indices in the elderly women 6 and 12 months after vertebra fractures(n=48, ±s )
BAP: bone alkaline phosphatase; BGP: bone γ-carboxyglutamic acid containing proteins; CTX-Ⅰ:C-terminal telopeptide of typeⅠ collagen; TRACP5b:tartrate-resistant acid phosphatase 5b.Compared with within 4h, *P<0.05, **P<0.01
Time Affected vertebra(SD) Hips(SD) Normal vertebra(SD)BAP(µg/L)BGP(µg/L)CTX-I(µg/L)TRACP5b(µg/L)Within 4h -2.655±1.156 -2.553±0.776 -2.299±0.817 10.316±5.283 5.535±3.013 0.430±0.215 4.178±2.246 6 months -3.487±0.926** -2.775±0.843 -2.598±1.079* 11.628±5.248** 7.673±3.282** 0.502±0.192* 5.522±2.213**12 months -3.118±0.979** -2.751±0.842 -2.440±0.940* 11.244±5.881 6.735±3.100** 0.457±0.227 4.803±2.221

表2 骨折愈合后伤椎BMD与各骨代谢指标的多重线性回归分析Table2 Multiple linear regression analysis of bone mineral density and bone metabolic indices of the affected vertebra after fracture healing in the elderly women
骨代谢指标是指骨转换过程中产生出的一些代谢产物,包括骨吸收和骨形成两大类指标,参与到骨转换的各个环节。本文中选取了在两方面具有代表性的BAP,CTX-Ⅰ,TRACP5b和BGP四种指标。骨折后机体启动愈合机制,进入成骨活跃期,骨形成的指标开始升高;另一方面,骨折后的疼痛与制动造成骨量的丢失,骨分解与坏死骨的吸收,使骨吸收的指标升高。本文中所有腰椎骨折患者在伤后6个月都已达到临床及影像学愈合标准,此时骨代谢各指标仍显著高于基线水平,说明患者骨重建的阶段还没有结束,各项骨代谢活动仍然活跃[12]。因此伤后6个月骨代谢指标的升高与患椎和正常椎体骨密度的降低一致,结合起来可以更好地评估二次骨折风险。
BGP是骨基质中的主要非胶原蛋白,通过负反馈机制参与骨重建,并且其代谢活性与血清水平具有一定稳定性,是骨形成的特异性标志物[13,14]。有报道称BGP除了反映骨形成速率外,还可以反映骨吸收速率,故建议将血清BGP值看成反映骨转换速率的指标更合理[16]。本研究中所有腰椎骨折患者在伤后12个月,也就是骨折愈合6个月内,除BGP血清水平仍高于基线值以外,其余骨代谢指标逐渐下降并恢复到基线水平。BGP水平升高说明骨折在达到临床及影像学愈合后,对机体骨代谢水平的影响依然存在。这与Frost[16]和Obrant等[17]的报道相符合。他们认为骨折愈合后局部骨小梁的进一步矿化、重建,以及骨折对于患者肢体运动功能的不利影响,使在骨折恢复后相当长的一段时期内,全身骨转换率仍高于骨折前水平。另外,本次研究通过多元线性回归分析也发现,在骨折达到临床愈合之后,血清BGP水平对于判断伤椎骨密度的变化最有意义。因此,达到骨折临床愈合的患者仍有必要检测血清BGP水平以评估骨量恢复程度。同时促进骨形成的临床治疗措施可能对骨折部位骨密度的恢复有显著疗效,但需临床试验进一步证实[18]。
综上所述,腰椎骨折在骨折愈合后骨折局部乃至全身的骨密度较骨折前明显降低,使患者罹患二次骨折或其他部位骨质疏松性骨折的风险增高[19,20]。在骨折达到临床愈合后仍需要重点监测血清BGP水平,可以提高判断骨密度变化的准确性,从而降低罹患二次骨折的风险。
【参考文献】
[1]Meng XW.Risk factors and risk assessment of primary osteoporosis[J].J Diagnost Concepts Prac, 2012,11(1): 1−4.[孟迅吾.原发性骨质疏松的风险因素和风险评估[J].诊断学理论与实践, 2012, 11(1): 1−4.]
[2]Cai SP, Zhou XL, Huang JL,et al.Correlation research between hip fracture and osteoporosis morbidity in elderly patients[J].China Modern Med, 2013, 22(20):30−31.[蔡树鹏, 周先来, 黄坚霖, 等.老年人髋部骨折与骨质疏松发病率的相关性研究[J].中国当代医药,2013, 22(20): 30−31.]
[3]Lane NE.Epidemiology, etiology, and diagnosis of osteoporosis[J].Am J Obstet Gynecol, 2006, 194(2 Suppl): 3−5.
[4]Smulders E, Weerdesteyn V, Groen BE,et al.Efficacy of a short multidisciplinary falls prevention program for elderly persons with osteoporosis and a fall history: a randomized controlled trial[J].Arch Phys Med Rehabil,2010, 91(11): 1705−1711.
[5]Yesil Y, Ulger Z, Halil M,et al.Coexistence of osteoporosis (OP) and coronary artery disease (CAD) in the elderly: it is not just a by-chance event[J].Arch Gerontol Geriatr, 2012, 54(3): 473−476.
[6]Kouda K, Iki M, Fujita Y,et al.Alcohol intake and bone status in elderly Japanese men baseline data from the Fujiwarakyo Osteoporosis Risk in Men (FORMEN)Study[J].Bone, 2011, 49(2): 275−280.
[7]Ivaska KK, Gerdhem P, Åkesson K,et al.Effect of fracture on bone turnover markers: a longitudinal study comparing marker levels before and after injury in 113 elderly women[J].J Bone Miner Res, 2007, 22(8):1155−1164.
[8]Zhang MM, Li YG, Ma QQ,et al.The relevance of PTH,25(OH)D3, CT, bone metabolism indicator with BMD in 860 females[J].Matern Child Health Care Chin, 2012,27(32): 5054−5056.[张萌萌, 李亚刚, 马倩倩, 等.860例女性PTH、25(OH)D3、CT、骨代谢标志物与BMD相关性[J].中国妇幼保健, 2012, 27(32): 5054−5056.]
[9]Chopin F, Biver E, Funck-Brentano T.Prognostic interest of bone turnover markers in the management of postmenopausal osteoporosis[J].Joint Bone Spine, 2012,79(1): 26−31.
[10]Stofell K, Engler H, Kuster M,et al.Changes in biochemical markers after lower limb fractures[J].Clin Chem, 2007, (53): 131−134.
[11]Herade S, Roden GA.Control of osteoblast function and regulation of bone mass[J].Nature, 2003, (423): 349−355.
[12]Obrant KJ, Merle B, Bejui J,et al.Serum bone-Gla protein after fracture[J].Clin Orthop Relat Res, 1990,(258): 300−303.
[13]Xia WZB.Detection and clinical evaluation of bone biochemical markers[J].J Postgrad Med(Intern Med Ed),2005, 28(5): 3−6.[夏维波.骨转换生化标志物的检测及临床评价[J].医师进修杂志: 内科版, 2005, 28(5):3−6.]
[14]Nakasato YR, Janckila AJ, Halleen JM,et al.Clinical significance of immunoassays for type-5 tartrate-resistant acid phosphatase[J].Clin Chem, 1999, 45(12):2150−2157.
[15]Kleerekoper M.Biochemical markers of bone remodeling[J].South Soc Clin Invest, 1996, 312(6):270−277.
[16]Frost HM.The biology of fracture healing.An overview for clinicians.Part Ⅰ[J].Clin Orthop, 1989(248):283−293.
[17]Obrant KJ, Nilsson BE.Histomorphologic changes in the tibial epiphysis after diaphyseal fracture[J].Clin Orthop,1984(185): 270−275.
[18]Stofell K, Engler H, Kuster M,et al.Changes in biochemical markers after lower limb fractures[J].Clin Chem, 2007(53): 131−134.
[19]Sato Y, Kaji M, Higuchi F,et al.Changes in bone and calcium metabolism following hip fracture in elderly patients[J].Osteoporos Int, 2001, 12(6): 445−449.
[20]Pillai A, Eranki V, Shenoy R,et al.Age related incidence and early-outcomes of hip fractures: a prospective cohort study of 1 177 patients[J].J Orthop Surg Res, 2011, 6: 5.
