双苯乙烯取代噻咯的合成及聚集态诱导发光
2014-04-25刘治田黄卉芬郑乐驰张林骅朱诗瑶
刘治田,黄卉芬,郑乐驰,张林骅,朱诗瑶
(武汉工程大学材料科学与工程学院,湖北 武汉 430074)
0 引 言
荧光材料在传感器和光电功能器件等领域的应用备受瞩目,例如有机发光二极管(OLED),由于OLED在柔性显示方面有巨大的潜在应用价值,近年来受到学者和商业界的高度重视,是当前研究和开发的热点之一.大多数有机发光材料可以在溶液中表现出良好的发光性能,但在聚集态时(如固体状态)却表现发光效率低甚至不发光的现象,即聚集态荧光猝灭(Aggregation-caused quench,ACQ)[1-3].在固体状态下使用的 OLED材料,随着固态薄膜的形成出现聚集态猝灭现象,这阻碍了 OLED技术的发展[4-5].人们已经尝试通过物理、化学等手段阻止分子的聚集,以获得固态发光效率高的材料[6-9]并取得了积极效果,但是复杂的合成路线使这类材料很难工业化应用.2001年,香港科技大学唐本忠的团队发现了硅杂环戊二烯(silole),该化合物在溶液状态下不发光,而在固态时却呈现优良的发光特性,他将这一奇特的现象命名为聚集态诱导发光(Aggregation-induced emission,AIE)[10].具有 AIE性质的化合物从根本上克服了ACQ的难题,引起了广泛的研究兴趣.至今已开发出从蓝光到红光覆盖整个可见波长范围的AIE体系,并利用这些化合物制备出高效的发光器件[11-15].众多研究组通过实验分析和理论计算,已经提出多种可能的机理,包括分子内旋转受限、分子内共平面、抑制光化学或光物理过程、非紧密堆积、形成J-聚集体以及形成特殊激基缔合物等[16].目前具有聚集诱导发光特性的小分子材料主要有吡喃型化合物[8]、硅杂环戊二烯类化合物[17-18]、二苯乙烯型化合物[19]、四苯乙烯型化合物[20]、双芪类化合物[21]等,聚合物材料有含Silole基团的聚合物、聚乙炔类、聚三唑类、聚芴酮衍生物等[8].
Silole是具有AIE性质的环状多烯化合物中最有代表性的一种.本文在Silole分子的2,5位引入苯乙烯基,合成了具有AIE性质的新型化合物1,1-二甲基-3,4-二苯基-2,5-二苯基乙烯 Silole(SSS),利用核磁共振(NMR)、紫外可见分光光度法(UV-Vis)表征了其结构,并且通过光致发光(PL)测试研究其AIE性能.
1 实验部分
1.1 原料和试剂
二甲基双(苯乙炔基)硅烷由文献[22]所述方法合成,并经过重结晶以达到反应所需纯度.萘、锂、氯化锌、对溴苯乙烯、二(三苯基磷)二氯化钯[PdCl2(PPh3)2]从国药集团化学试剂有限公司购买并直接使用.四氢呋喃(THF)从武汉申氏化工仪器网络有限公司购买,经金属钠除水后以二苯甲酮作为指示剂,经蒸馏后使用.
1.2 材料的表征和测试仪器
1H-NMR 谱 使 用 Agilent Technologies 400MR核磁共振仪在400 MHz下测试,氘代氯仿为溶剂,四甲基硅(TMS)为内标.UV/Vis吸收光谱使用Perkin Elmer Lambda 35 UV/Vis紫外光谱仪进行测试.溶液的光致发光光谱(PL)使用Cary Eclipse FL0910M014荧光光谱仪测试.
1.3 1,1-二甲基-3,4-二苯基-2,5-二苯基乙烯Silole(SSS)的合成
将1.58 g萘(12.1 mmol)溶于12 m L四氢呋喃(THF)中,在氮气保护下将0.084 g金属锂(12 mmol)剪成小颗粒加入溶液中,室温下反应5 h,生成萘锂(LiNaph).将0.78 g二甲基双(苯乙炔基)硅烷(3 mmol)溶于8 m L THF中,将其滴加到已经制备好的萘锂溶液中,反应约30 min,即生成1,1-二甲基-3,4-二苯基-2,5-二锂硅杂环戊二烯.然后将该溶液降温至0℃,加入3 g ZnCl2(TMEDA)(12 mmol)和20 m L THF,得到黑色悬浮液.再升温至室温,搅拌1 h,得到1,1-二甲基-3,4-二苯基-2,5-二氯化锌硅杂环戊二烯稀溶液[23].将溶液缓慢滴加到对溴苯乙烯溶液中,之后继续反应24 h.停止搅拌,过滤,将盐酸(1 mol/L)加入反应物溶液中,用乙醚萃取3次.有机层经过饱和盐水洗涤,然后用无水MgSO4干燥,除去溶剂.用二氯甲烷/石油醚(1∶8)混合溶剂进行硅胶柱层析.所得物质再用甲苯/正庚烷混合溶剂重结晶,得到1.02 g黄色固体,产率为73%,产物命名为SSS.SSS的合成路线见图1.

图1 SSS的合成路线Fig.1 Synthetic route of SSS
经1H-NMR谱分析测试表明为目标产物1,1-二甲基-3,4-二苯基-2,5-二苯乙烯硅杂环戊二烯.1H NMR(400 MHz,CDCl3);δ(TMS):7.17(d,4H,phenyl-H),7.02(m,6 H,phenyl-H),6.88(d,4H,phenyl-H),6.82(m,4H,phenyl-H),6.66-6.58(m,2 H),5.65(d,2 H),5.15(d,2 H),0.48(s,6H,CH3).
2 SSS的光致发光(PL)性能测试
二氯甲烷(DCM)和四氢呋喃(THF)为SSS的良溶剂,而甲醇、甲苯、水则为不良溶剂,会使SSS分子处于聚集态.将SSS溶解于其良溶剂中,再往溶液中添加不同比例的不良溶剂,用荧光光谱仪测试SSS的聚集态诱导发光性能.下面以DCM体系为例进行说明.
2.1 SSS在DCM体系中的光致发光(PL)测试
将SSS溶于良溶剂DCM中,再往溶液中添加不良溶剂甲醇(甲苯、水),使混合溶液中DCM与甲醇(甲苯、水)的体积比例分别为100∶0,70∶30,50∶50,20∶80,10∶90,用荧光分度计分别测试不同甲醇(甲苯、水)含量的SSS溶液的光致发光性质.
①取SSS 1 mg溶于5 m L DCM溶剂中,配成质量浓度为0.2 mg/m L的SSS溶液.取出一定体积的SSS溶液装入5个玻璃瓶中,分别加入不同比例的甲醇(甲苯、水),使DCM在混合溶液中的比例保持为100%,70%,50%,20%,10%(见表1).

表1 混合溶液DCM/甲醇比例Table 1 The DCM/methanol ratios of mixed solutions
②用DCM润洗比色皿.装满DCM,用荧光光度计对纯溶剂进行PL测试,校零.
③将DCM配比为100%的溶液倒入比色皿,进行PL测试.
④倒出溶液,用DCM润洗比色皿,对DCM配比为70% 的混合溶液进行PL测试.
⑤重复步骤③和步骤④,测试其他配比的混合溶液的PL性能.
⑥分别用甲苯和水替换甲醇,更换一个比色皿,重复①~⑤的操作.
2.2 SSS在THF体系中的光致发光(PL)测试
SSS在THF体系中的PL测试操作过程可参照SSS在DCM体系中的操作,只需用THF替换DCM进行测试即可.
3 结果与讨论
3.1 SSS的紫外吸收光谱
图2为SSS的溶液和薄膜的UV吸收光谱,图中实线为溶液状态下吸收曲线,虚线为薄膜状态下吸收曲线,SSS分子溶液和薄膜的最大吸收波长都在380 nm.

图2 SSS的二氯甲烷溶液和薄膜的UV吸收光谱Fig.2 UV absorption spectra of dichloromethane solution and film of SSS
3.2 SSS的聚集态诱导发光效应(AIE)

图3 SSS在二氯甲烷和甲醇混合溶液中的荧光光谱Fig.3 PL spectra of SSS in a mixed solution of DCM and methyl alcohol

图4 SSS在二氯甲烷和甲苯混合溶液中的荧光光谱Fig.4 PL spectra of SSS in a mixed solution of DCM and toluene

图5 SSS在DCM和水混合溶液中的荧光光谱Fig.5 PL spectra of SSS in a mixed solution of methylene dichloride and water
3.2.1 SSS在DCM体系中的PL光谱 图3~图5所示的是SSS分别在不同比例的DCM/甲醇、DCM/甲苯和DCM/水的混合溶液中的荧光光谱.从图3~图5可以看出,随着不良溶剂含量的增加,SSS的荧光强度呈递增趋势,SSS的最大发射波长位于420 nm左右.下面以DCM/水体系为例进行详细说明.如图5所示,在良溶剂DCM中的荧光发射强度很弱,当混合溶液中水含量低于50%(质量分数,下同)时,随着水含量的增加荧光强度略有增强;当水含量达到50%时,SSS的发光强度明显增强.随着水含量的增加,当混合溶液中水含量达到80%及以上时,混合溶液的荧光强度急剧上升,当水含量达到90%时,溶液的荧光强度达到最大,约为纯DCM中的5.5倍.这是由于当SSS在纯良溶剂DCM中时处于溶解状态,单个分子中Silole环上3,4位的苯基官能团和2,5位的苯乙烯基团在溶剂分子的作用下可以发生自由协同旋转,消耗了激发态能量,成为一个非辐射衰变渠道,导致SSS分子荧光减弱;水是SSS的不良溶剂,当混合溶剂中水含量超过50%时,部分SSS分子开始聚集成纳米颗粒,处于聚集态,由于空间的限制,这些SSS分子Silole环上2,3,4,5位的基团自由协同旋转受阻碍,即分子内旋转受阻(restricted intramolecular rotation,RIR),非辐射衰减渠道被抑制,激发态分子只能通过辐射衰变回到基态,导致SSS荧光增强[24].
3.2.2 SSS在THF体系中的PL光谱 图6~图8所示的是SSS分别在不同比例的THF/甲醇、THF/甲苯和THF/水的混合溶液中的荧光光谱.从图中可以看出,随着不良溶剂含量的增加,SSS的荧光强度呈递增趋势,原因同样为SSS分子内旋转受阻(RIR).在图6和图7中SSS的最大发射波长位于420 nm左右,PL光谱与前面所示的DCM体系类似.在图8中SSS在414 nm处有一处较弱的发射峰,归属于SSS的单分子发射峰,另外,可以看到SSS的PL光谱出现了非常明显的红移,最大发射波长移动到506 nm,这与前面的PL光谱截然不同,原因可能是混合溶液中SSS的聚集形态发生了变化,当水含量低于80%的时候SSS在混合溶液中呈纳米花状聚集形态;当水含量达到80%的时候,SSS由纳米花向纳米球状聚集形态转变,此时两种聚集形态并存;而当水含量达到90%的时候,SSS聚集加剧,在混合溶液中呈微米球聚集形态[25].在高含水量溶液中,SSS形成了共轭程度、聚集程度高的聚集态,导致了荧光光谱的红移[25].

图6 SSS在四氢呋喃和甲醇混合溶液中的荧光光谱Fig.6 PL spectra of SSS in a mixed solution of THF and methyl alcohol

图7 SSS在四氢呋喃和甲苯混合溶液中的荧光光谱Fig.7 PL spectra of SSS in a mixed solution of THF and toluene
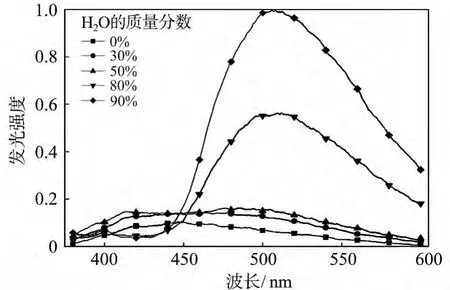
图8 SSS在四氢呋喃和水混合溶液中的荧光光谱Fig.8 PL spectra of SSS in a mixed solution of THF and water
4 结 语
合成了一种双苯基乙烯取代的含硅杂环化合物:1,1-二甲基-3,4-二苯基-2,5-二苯乙烯Silole(SSS),该化合物具有明显的聚集态诱导发光性质.SSS在380 nm处有吸收峰,最大发射波长位于420 nm处.通过往SSS的良溶剂中添加不良溶剂的方法验证了该化合物的AIE特征的产生机理为聚集态分子内旋转受限.该化合物在常见的有机溶剂中具有良好溶解性,其末端带有活泼的苯乙烯基,可以通过自由基聚合或Heck反应制备出含硅杂环的聚合物,是一种非常有潜力应用于发光二极管的材料.
致谢
感谢国家自然科学基金委员会、湖北省科技厅、武汉市科技局对本研究的支持和帮助.
[1]FRIEND R H,GYMER R W,HOLMES A B,et al.Electroluminescence in conjugated polymers[J].Nature,1999,397:121-128.
[2]TOAL S J,JONES K A,MAGDE D,et al.Luminescent silole nanoparticles as chemoselective sensors for Cr(VI)[J].Chemistry of Materials,2005,127:11661-11665.
[3]CACIALLI F,WILSON J S,MICHELS J J,et al.Cyclodextrin-threaded conjugated polyrotaxanes as insulated molecular wires with reduced interstrand interactions[J].Nature Materials,2002,1:160-164.
[4]CHEN C T.Evolution of red organic light-emitting diodes:materials and devices [J].Chemistry of Materials,2004,16:4389-4400.
[5]Kwon T W,Alam M M,Jenekhe S A.N-type conjugated dendrimers:convergent synthesis,photophysics,electroluminescence,and use as electron-transport materials for light-emitting diodes[J].Chemistry of Materials,2004,16:4657-4666.
[6]TANG C W,VANSLYKE S A,CHEN C H.Electrolumine-scence of doped organic thin films[J].Journal of Applied Physics,1989,65:3610-3616.
[7]THOMAS K R J,LIN J T,TAO Y T,et al.Starshaped thieno-[3,4-b]-pyrazines:a new class of redemitting electroluminescent materials[J].AdvancedMaterials,2002,14:822-826.
[8]HE F,XU H,YANG B,et al.Oligomeric phenylenevinylene with cross dipole arrangement and amorphous morphology:enhanced solid-state luminescence efficiency and electroluminescence performance[J].Advanced Materials,2005,17:2710-2714.
[9]FIGUEIRA-DUARTE T M,DEL ROSSO P C,TRATTNING R,et al.Designed suppression of aggregation in polypyrene:toward high-performance blue-light-emitting diodes[J].Advanced Materials,2010,22:990-993.
[10]LAM J W Y,LUO J D,DONG Y P,et al.Functional polyacetylenes:synthesis,thermal stability,liquid crystallinity,and light emission of polypropiolates[J].Macromolecules,2002,35:8288-8299.
[11]WANG M,ZHANG G X,ZHANG D Q,et al.Fluorescent bio/chemosensors based on silole and tetraphenylethene luminogens with aggregation-induced emission feature[J].Journal of Materials Chemistry,2010,20:1858-1867.
[12]钱立军,支俊格,佟斌,等.具有聚集态诱导发光性质的化合物[J].化学进展,2008,20:673-678.QIAN Li-jun,ZHI Jun-ge,TONG Bin,et al.Organic compounds with aggregation-induced emission[J].Progress in Chemistry,2008,20:673-678.(in Chinese)
[13]钱妍,解令海,王双清,等.聚集诱导的荧光增强体系研究进展[J].南京邮电大学学报:自然科学版,2008,28:1-8.QIAN Yan,XIE Ling-hai,WANG Shuang-qing,et al.Progress in organic compounds with aggregation induced enhanced emission[J].Journal of Nanjing University of Posts and Telecomunications:Natural Science,2008,28:1-8.(in Chinese)
[14]ZHAO Y S,FU H B,HU H B,et al.Tunable emission from binary organic one-dimensional nanomaterials:an alternative approach to white-light emission[J].Advanced Materials,2008,20:79-83.
[15]SHIMIZU M,HIYAMA T.Organic fluorophores exhibiting highly efficient photoluminescence in the solid state[J].Chemistry-An Asian Journal,2010,5:1516-1531.
[16]张双,秦安军,孙景志,等.聚集诱导发光机理研究[J].化学进展,2011,23:623-636.ZHANG Shuang,QIN An-jun,SUN Jing-zhi,et al.Mechanism study of aggregation-induced emission[J].Progress in Chemistry,2011,23:623-636.(in Chinese)
[17]CHEN J W,LAW C C W,LAM J W Y,et al.Synthesis,Light emission,nanoaggregation,and restricted intramolecular rotation of 1,1-substituted 2,3,4,5-tetraphenylsiloles[J].Chemistry of Materisls,2003,15:1535-1546.
[18]CHEN J W,PENG H,LAW C C W,et al.Hyperbranched poly(phenylenesilolene)s:synthesis,thermal stability,elctronic conjugation,optical power limiting,and cooling-enhanced light emission[J].Macromolecules,2003,36:4319-4327.
[19]An B-K,Lee D-S,Lee J-S,et al.Strongly fluorescent organogel system comprising fibrillar self-assembly of a trifluoromethyl-based cyanostilbene derivative[J].Journal of American Chemical Society,2004,126:10232-10233.
[20]王筱梅,杨平,施琴芬,等.四(4,4′,4″,4‴-N,N-二乙氨基)四苯乙烯光致发光与分子的构象效应[J].化学学报,2003,61(10):1646-1652.WANG Xiao-mei,YANG Ping,SHI Qin-fen,et al.Study on photoluminescence behavior and conformation effects of tetrakis- (4,4′,4″,4‴-N,N-diethylamino)tetraphenyl ethylene[J].Acta Chimica Sinica,2003,61(10):1646-1652.(in Chinese)
[21]XIE Z Q,YANG B,XIE W J,et al.A class of nonplanar conjugated compounds with aggregation-induced emission:structural and optical properties of 2,5-diphenyl-1,4-distyrylbenzene derivatives with all cis double bonds[J].Journal of Chemical Physics B,2006,110:20993-21000.
[22]YAMAGUCHI S,ENDO T,UCHIDA M,et al.Toward new materials for organic electroluminescent devices:synthesis,structures,and properties of a series of 2,5-diaryl-3,4-diphenylsiloles[J].Chemistry-A European Journal,2000,6:1683-1692.
[23]LIU Z T,WANG L,CHEN J W,et al.Synthesis and optoelectronic properties of silole-containing polyfluorenes with binary structures[J].Journal of Polymer Science Part A:Polymer Chemistry,2007,45:756-767.
[24]刘治田,刘菁,樊强,等.聚合物聚集诱导发光体系及机理研究进展[J].高分子通报,2012,11:40-57.LIU Zhi-tian,LIU Jing,FAN Qiang,et al.Research progress on polymer aggregation-induced emission systems and mechanisms[J].Polymer Bulletin,2012,11:40-57.(in Chinese)
[25]BHONGALE C J,CHANG C-W,DIAU E W-G,et al.Formation of nanostructures of hexaphenylsilole with enhanced color-tunable emissions[J].Chemical Physics Letters,2006,419:444-449.
