响应曲面法优化桑椹黄酮的超声提取工艺
2014-04-24李建华
袁 玲,李建华
(湖北工程学院 生命科学技术学院 特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000)
桑椹 (mulberry)为桑科(Moraceae)植物桑的成熟果穗,在我国资源丰富,能药食两用。桑椹营养丰富,富含多种人体所必需的营养物质[1],被誉为“第三代水果”。桑椹中含有丰富的黄酮类物质,能够抗脂质过氧化,具有延缓衰老及润肤美容的功效[2]。桑椹黄酮还具有降血糖[3-4]活性和降尿酸[5]活性的作用。
随着桑椹黄酮生物活性研究的深入,提取工艺也需优化。常见黄酮提取方法有溶剂法、微波辅助提取法及超临界流体提取法等[6]。其中超声辅助提取法具有提取时间短、无污染、提取效率高及能耗低等优点。响应曲面优化法(Response Surface Method, RSM)集数学和统计学方法于一体,通过描绘效应对考察因素的响应面,选择较佳的响应区,从而最终回推出自变量取值范围,即最优化实验条件[7]。超声法提取桑椹总黄酮的定性研究已有报道[8],但还未见响应曲面优化桑椹黄酮的工艺试验。以桑椹总黄酮含量为考察目标,采用超声波法提取,通过响应曲面分析法探讨提取过程中液料比、超声功率以及提取时间对总黄酮得率的影响,优选最佳工艺,预测最高得率,为桑椹黄酮的开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
试验用桑椹采自湖北省孝感市朋兴乡,45 ℃烘干,粉碎过50目筛备用。芦丁标准品,中国药品生物制品检定所。亚硝酸钠、硝酸铝、氢氧化钠、乙醇等均为分析纯。
1.2 主要仪器与设备
Cary 60紫外可见分光光度计,安捷伦科技有限公司;DL-480B智能超声波清洁器,上海之信仪器有限公司;SHZ-III循环水真空泵,上海亚荣生化仪器厂;HH-4数显恒温水浴锅,江苏金坛市荣华仪器制造有限公司。
1.3 黄酮(以芦丁为标准物)检测波长的确定
首先,准确配制质量浓度为0.20 mg·mL-1的芦丁标准溶液,然后吸取2 mL于10 mL具塞比色管中,加5% 亚硝酸钠溶液0.3 mL,充分摇匀,放置6 min后加入10% 硝酸铝溶液0.3 mL,摇匀,放置6 min,加入4%氢氧化钠溶液4 mL,再加30%乙醇使总体积为10 mL,摇匀后放置10 min,在波长400~700 nm处扫描,确定其最大吸收波长[9]。
1.4 标准曲线的绘制
取7支10 mL具塞试管,分别准确吸取芦丁标准溶液(0.20 mg/mL)0、0.5、1.0、1.5、2.0、2.5、3.0 mL,按前述检定波长的方法处理各管后,以0管为空白,在最佳波长处测定吸光度,绘制芦丁浓度与吸光度的标准曲线[10]。
1.5 试验设计
在前期单因素实验的基础上,使用Design-Expert软件的中心组合设计(Central Composite Design,CCD)模块中的二次回归正交旋转组合设计,设计一组3因素5水平共计20次的实验(full CCD 设计),其中析因部分实验次数为14次,星点数为5,保证均一精密性的中心点重复次数手动调整为6,本试验设计的因素及水平见表1。

表1 中心组合设计因素水平表
1.6 桑椹总黄酮的提取与含量测定
准确称取1.00 g干粉末,按照中心组合设计试验中设置的不同提取条件,分别进行超声提取,3 500 r/min离心5 min,抽滤收集各提取条件下得到的提取液,备用。各提取液按1 : 3处理后在最佳波长处测定吸光值,计算样品中黄酮的含量。
1.7 数据处理
实验数据采用Design Expert 8.0软件进行多元回归及方差分析。
2 结果与分析
2.1 黄酮波长检测
将处理好的芦丁标准溶液倒入直径为1cm的石英比色皿中,在Cary 60紫外可见分光光度计中从450 ~700 nm进行扫描,用随机附带的软件绘制的扫描结果如图1所示。

图1 芦丁波峰检测
从图1可以看出,芦丁在可见光区有一明显的吸收峰,仪器随机软件显示,波峰所在波长为504 nm。
2.2 标准曲线
以芦丁标准液和质量浓度为横坐标,吸光值为纵坐标,可得芦丁标准曲线如图2。吸光度值y与芦丁质量浓度x(μg·mL-1)在10.0~60.0 μg·mL-1内呈良好的线性关系,回归方程为:
y=0.010x+0.01,相关系数(R2)=0.997。

图2 芦丁质量浓度(μg·mL-1)与吸光值的标准曲线
2.3 试验结果
超声功率、液料比以及提取时间三因素影响桑椹黄酮提取的试验结果如表2所示。

表2 响应曲面分析试验设计方案及结果
2.4 模型的建立与方差分析
利用Design-Expert软件对试验结果(表2)进行回归及方差分析,发现本试验结果符合三次方模型,经过响应曲面法的拟合计算得出该模型的决定系数R-Squared为0.961 6,表明该模型具有一定的可信度;校正系数RAdj=0.939 1,表明在黄酮含量总的变异中,有93.91%是由独立变量引起的。失拟项不显著,表明该模型能够对桑椹黄酮的提取进行预测和分析。
桑椹黄酮提取的方差分析结果见表3。通过方差分析可对模型的精确性做进一步的判断,该模型的F值为42.87,因误差而接受该模型的概率不到0.000 1,表明模型的可信度很高,具有重要的参考价值;如果以0.05作为显著性标准的话,在该模型中,A、B、C、B2、ABC和A2B表示显著模型项,表明超声功率、液料比和提取时间是影响桑椹黄酮提取的关键性因素。
优化可得简化的回归方程为:R=0.115 79 + 0.015 620A+0.440 82B+0.097 522C-5.544 79×10-5AC-3.460 05×10-3B2- 5.280 99×10-6ABC-6.318 03×10-8A2B。这里R表示每克干桑椹提取黄酮的mg数。
2.5 参数优化与验证
在Design Expert 8.0软件的优化模块中,将优化标准设置为最大值,求解得R的最优值是18.85 mg·g-1,预测的最佳实验条件为:超声功率315W,液料比60 mL :1 g,提取时间12 min。为检验优化条件的准确性,按照上述优化过的工艺参数,重复试验4次,得其平均值为18.12 mg·g-1,与预测值相差3.87%,实验值与预测值基本吻合。在优化条件下做2次提取,结果表明桑椹黄酮的一次提取得率达81.6%~81.9%。
3 结论与讨论
采用响应曲面分析,研究了超声提取桑椹中总黄酮的影响因素及最佳工艺条件,得到了各因素的最佳范围,验证实验结果表明该条件下黄酮的平均提取率为18.12 mg/g。殷浩等[11]研究发现随着桑椹的发育成熟,红果2号和蜀椹1号中的总黄酮含量呈现双峰变化,含量最高分别达到0.313%、0.444%。吴祖芳[1]采用分光光度法测得桑椹黄酮类物质含量0.41%。本试验中测得黄酮含量较高,可能与桑椹品种和采摘时间有关,也可能与优化工艺有关,可做进一步试验。
与传统法相比,优化后的超声提取显著提高了桑椹黄酮的得率,缩短了提取时间,该提取工艺稳定环保,有明显的优势和较大的应用前景。
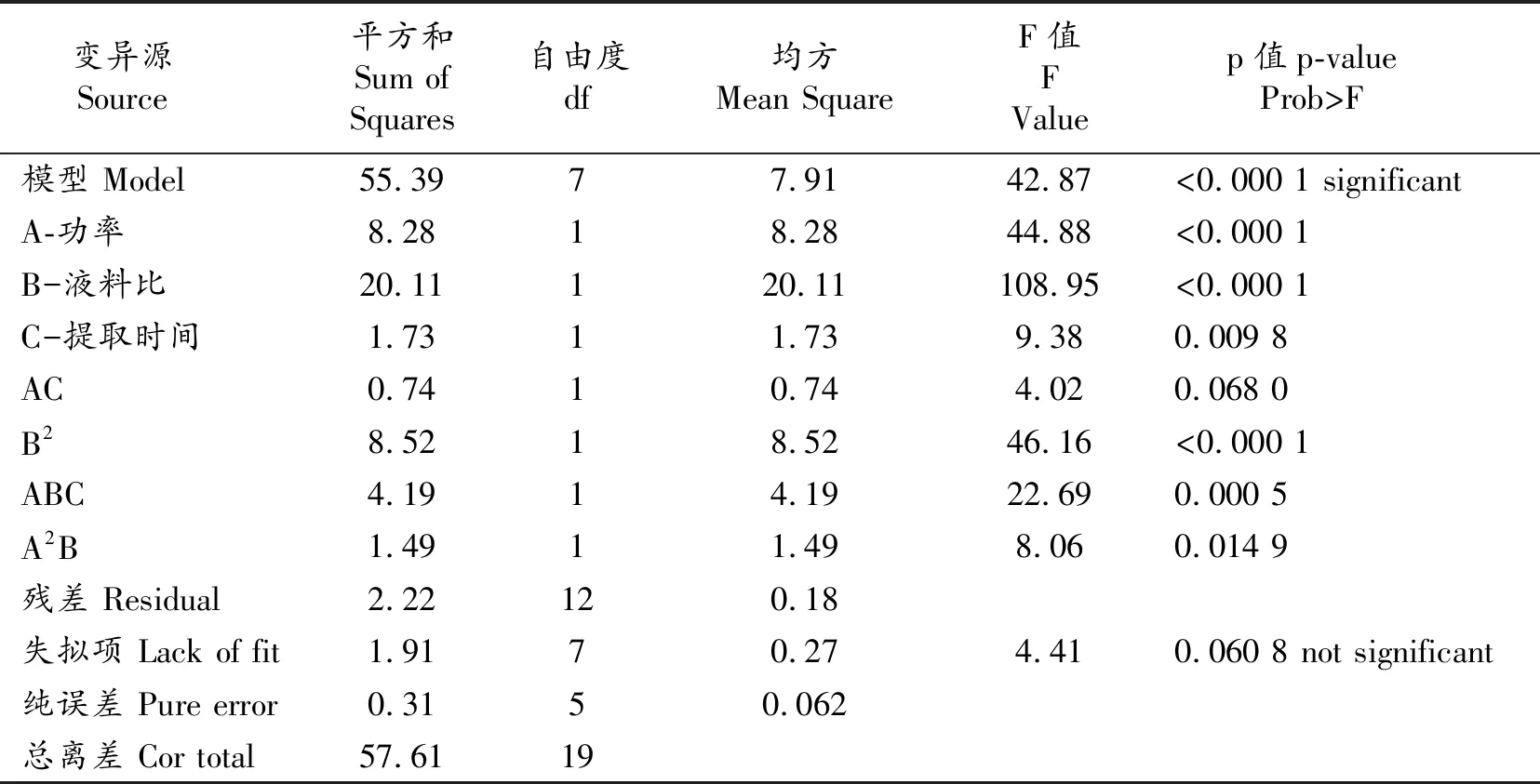
表3 三次多项式模型方差分析表
[参 考 文 献]
[1] 吴祖芳,翁佩芳.桑椹的营养组分与功能性分析[J].中国食品学报,2005,5(3):102-107.
[2] 黄勇,张 林,赵为国,等.桑椹的化学成分及药理作用研究进展[J].广西蚕业,2006,43(3):15-19.
[3] 江正菊,宁琳玲,胡霞敏,等.桑叶总黄酮对高脂诱导大鼠高血脂及高血糖的影响[J].中药材,2011,34(1):108-111.
[4] 王瑞坡,王珂,李姣,等.桑椹乙酸乙酯萃取物对链脲佐菌素致高血糖大鼠的降血糖作用[J].中成药,2011,33(10):1668-1672.
[5] 王珂,王瑞坡,李姣,等.桑叶黄酮对腺嘌呤诱导大鼠高尿酸血症肾损伤的防治作用[J].天然产物研究与开发,2012,24(2):172-175.
[6] 张 岩,曹国杰,张 燕,等.黄酮类化合物的提取及检测方法的研究进展[J].食品研究与开发,2008,29(1):154-158.
[7] 徐向宏,何明珠.试验设计与Design-Expert、SPSS应用[M].北京:科学出版社,2010.
[8] 韦耀东,孙婷婷,刘海花,等.超声波提取桑葚总黄酮及鉴别[J].时珍国医国药,2012,23(11):2811-2812.
[9] 严赞开.紫外分光光度法测定植物黄酮含量的方法[J].食品研究与开发,2007,28(9):164-165.
[10] 唐红军.中国药典2000年版一部检测芦丁含量方法的改进[J].中国医院药学杂志,2002,22(1):60.
[11] 殷 浩,佟万红,王振江,等.桑椹成熟过程中部分活性成分的含量变化[J].中国蚕业,2011,37(6):1106-1110.
