肝性脑病大鼠脑超微结构的改变
2014-04-23李晓青郭民侠
李晓青,种 莉,刘 鹏,刘 玥,唐 鹏,陈 丽,张 欣,侯 辰,李 锐,郭民侠
肝性脑病大鼠脑超微结构的改变
李晓青*,种 莉,刘 鹏,刘 玥,唐 鹏,陈 丽,张 欣,侯 辰,李 锐,郭民侠
(陕西省人民医院神经内三科,西安 710068)
通过观察肝性脑病大鼠脑部分区域及氨对体外培养大鼠神经元超微结构的改变,讨论其病理发生机制。选用健康雄性SD大鼠12只,随机分为肝性脑病模型组和正常对照组两组,每组6只。用电子透射显微镜观察硫代乙酰胺诱导的肝性脑病大鼠和体外氨中毒大鼠皮质神经元的超微结构。肝性脑病大鼠神经元细胞数量减少;神经元线粒体肿胀,尼氏体数量明显减少;可见凋亡各期表现。神经胶质细胞细胞器减少,黑质的超微结构改变程度较基底核略重。体外培养氨中毒神经元变化:神经元细胞数量明显减少;细胞明显水肿,线粒体明显肿胀,尼氏体显著减少;可见不同时期的凋亡表现。肝性脑病大鼠脑超微结构改变明显,其主要机制可能与氨中毒引起的神经元凋亡有关。
肝性脑病;氨;细胞培养;超微结构
肝性脑病(hepatic encephalopathy)是一种由于急、慢性肝功能严重障碍或各种门静脉-体循环分流异常所致的、以代谢紊乱为基础的、轻重程度不同的神经精神异常综合征[1]。其发病机制与病理生理较复杂,迄今仍未完全阐明。目前认为游离氨浓度升高是导致肝性脑病的最主要的因素[2],黑质-纹状体通路形态学及功能改变也起一定作用[3,4]。其神经组织超微结构的改变鲜见报道。本研究分别对肝性脑病大鼠基底节区、黑质以及体外培养的氨中毒神经元超微结构进行观察,以证明肝性脑病神经超微结构改变的主要机制与氨中毒引起的神经元凋亡有关,进一步阐明黑质−纹状体系统损伤在肝性脑病发病机制中的作用。
1 材料与方法
1.1 动物模型
健康雄性SD大鼠12只,西安交通大学医学院实验动物中心,体质量(230±17)g,随机分为两组,每组6只:(1)肝性脑病模型组,硫代乙酰胺350mg/kg腹腔注射,连续3d,急性肝性脑病造模[5],血氨浓度(592±70)μmol/L,显示造模成功;(2)正常对照组,同等剂量生理盐水腹腔注射,连续3d,血氨浓度(34±12)μmol/L(<0.01)。
1.2 肝性脑病大鼠各脑区超微结构改变研究
大鼠麻醉后,用4%多聚甲醛/0.1mol/L磷酸缓冲液,含0.25% 戊二醛灌注固定。断头取出大脑,取基底核和黑质部位标本,切成约1mm3的小块,迅速放入2.5%戊二醛固定液内固定>2h,0.1mol/L磷酸缓冲液浸洗,1%四氧化锇后固定2h。再用磷酸缓冲液浸洗,乙醇梯度脱水,Epon 812包埋、聚合,半超薄切片机切片约1~2µm,光学显微镜下定位后,瑞典LKB超薄切片机切片,厚度为50~70nm,醋酸铀-柠檬酸铅染色,日本日立H-600型透射电子显微镜下观察、拍照。
1.3 神经元培养
新生SD大鼠,西安交通大学医学院实验动物中心,无菌取脑,剥除脑膜。取双侧大脑皮质剪成1~2mm3,0.25%胰蛋白酶消化。终止消化后吹打分散成单细胞悬液,离心,弃上清。加入等体积D-Hanks,吹打重新悬浮细胞,离心,弃上清。加入20%血清的DMEM,轻柔吹打成单细胞悬液。过筛,锥虫蓝(台盼蓝)排斥法检测细胞活力,计数后稀释至1×106个/ml接种入预先经过多聚赖氨酸包被的、放置有处理好的盖玻片的培养皿中。37℃、5%CO2培养箱培养。24h后更换为10%血清DMEM培养液培养,同时加入阿糖胞苷10μmol/L以抑制非神经元细胞生长。以后隔天半量换液。
1.4 氨中毒神经元模型
取培养7d成熟的皮质神经元细胞随机分为两组,氨中毒组和对照组。无血清DMEM洗3次后,氨中毒组加入含0.5mmol/LNH4Cl的无血清DMEM,对照组加入无血清DMEM,培养24h。
1.5 氨中毒神经元超微结构改变研究
终止培养后,取出爬有神经元细胞的盖玻片,用0.1mol/L 磷酸缓冲液洗2min×3次。2.5%戊二醛固定2h,0.1mol/L磷酸缓冲液浸洗,1%四氧化锇后固定2h。再用磷酸缓冲液浸洗,乙醇梯度脱水,Epon 812倒扣包埋、聚合,瑞典LKB超薄切片机切成50~70nm的切片,醋酸铀−柠檬酸铅染色,日本日立H-600型透射电子显微镜下观察、拍照。
1.6 伦理
本文所涉及实验均得到西安交通大学动物伦理委员会批准。
1.7 统计学处理

2 结 果
2.1 肝性脑病大鼠脑基底核及黑质超微结构改变
2.1.1 基底核 神经元细胞数量减少;神经元细胞肿胀,胞浆内可见空泡形成,细胞器减少,尼氏体(Nissl body)数量明显减少(图1A,图1B);部分细胞体积变小,细胞核电子密度增加,细胞核染色质轻度凝集,核周间隙加大(图1C,图1D)。神经胶质细胞核固缩,染色质凝集,边集(图1E,图1F)。微血管管腔扩张,血管周围局部溶解,内皮细胞局部溶解消失,连续性中断(图1G,图1H)。
2.1.2 黑质 神经元细胞数量明显减少;神经黑色素颗粒数量不多,线粒体肿胀明显,嵴断裂溶解,尼氏体数量明显减少,高尔基体扁平囊扩张,核膜连续性中断(图2A,图2B);部分细胞体积变小,细胞质浓缩,电子密度增加,细胞核内染色质高度凝聚,沿核周分布(或边集),核仁肥大边移(图2C,图2D)。可见凋亡小体(图2E)。神经胶质细胞细胞器减少,核形不规则,核内染色质凝集,边集(图2F,图2G)。微血管管腔扩张,血管周围溶解,内皮细胞肿胀,表面皱襞增多,局部内皮细胞膜向管腔膨出,基底膜电子密度降低,局部溶解消失,连续性中断。其程度较基底核略重(图2H,图2I)。
2.2 氨中毒神经元细胞超微结构改变
神经元细胞数量明显减少;细胞肿胀明显,细胞质内空泡增多,线粒体明显肿胀,尼氏体显著减少;部分细胞体积变小,细胞质浓缩,核染色质高度盘结出现空泡结构;也有细胞核染色质高度凝聚,沿核膜内侧排列、边集而形成半月形;细胞核固缩,电子密度增加,核畸形,核膜迂曲;细胞核核碎裂,在细胞内可见多个电子密度增强的胞核碎块(图3A,图3B)。
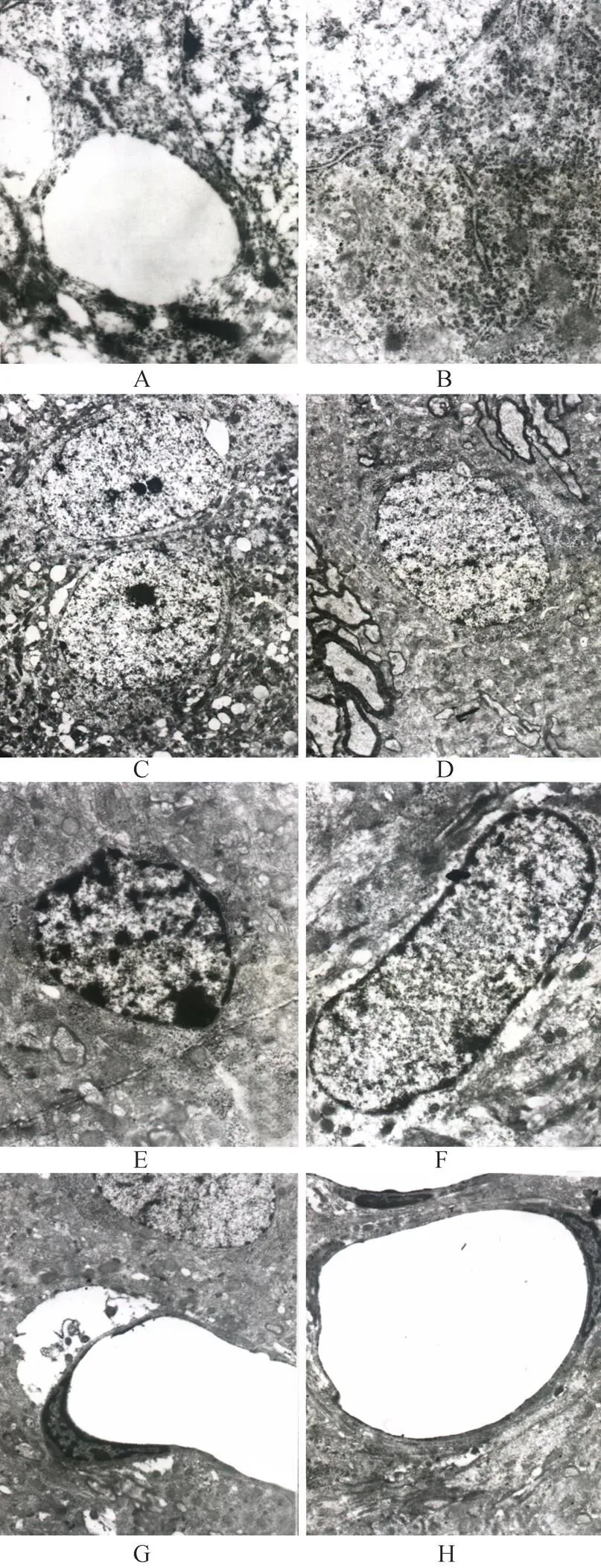
图1 肝性脑病大鼠及正常大鼠脑基底核电镜表现
Figure 1 Ultrastructure of basal nuclei in HE and healthy rats (TEM)
HE: hepatic encephalopathy; A: neuron of basal nuclei in HE rats (×15000); B: neuron of basal nuclei in healthy rats (×20000); C: neuron nucleus of basal nuclei in HE rats (×4000); D: neuron nucleus of basal nuclei in healthy rats (×4000); E: neurogliocyte of basal nuclei in HE rats (×10000); F: neurogliocyte of basal nuclei in healthy rats (×10000); G: capillaries of basal nuclei in HE rats (×5000); H: capillaries of basal nuclei in healthy rats (×5000)
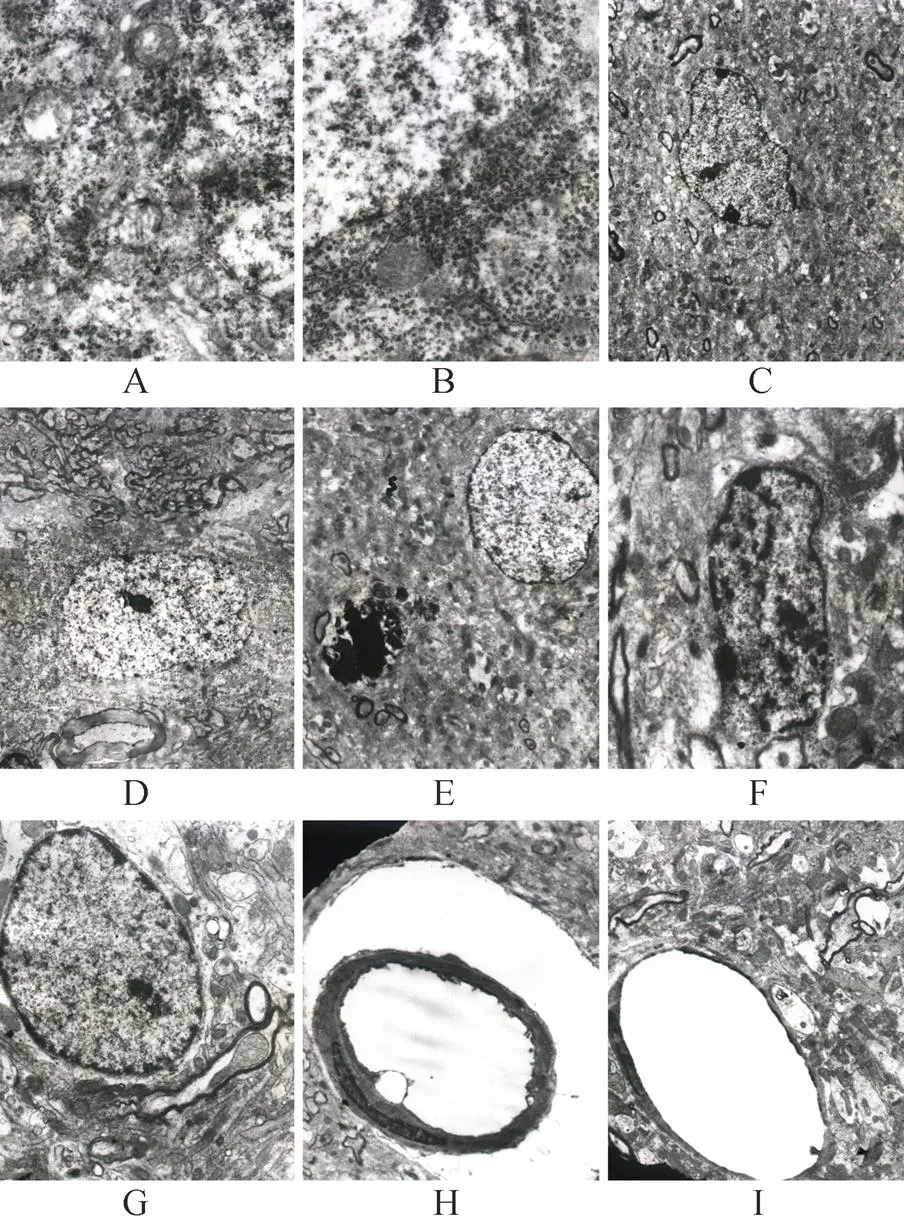
图2 肝性脑病大鼠及正常大鼠黑质电镜表现
Figure 2 Ultrastructure of substantia nigra in HE and healthy rats (TEM)
HE: hepatic encephalopathy; A: neuron of substantia nigra in HE rats(×20000); B: neuron of substantia nigra in healthy rats (×20000); C:neuron nucleus of substantia nigra in HE rats (×4000); D: neuron nucleus of substantia nigra in healthy rats (×4000); E: apoptosis body in neuron nucleus of substantia nigra in HE rats (×4000); F: neurogliocyte of substantia nigra in HE rats (×10000); G: neurogliocyte of substantia nigra in healthy rats (×10000); H: capillaries of substantia nigra in HE rats (×4000); I: capillaries of substantia nigra in healthy rats (×5000)

图3 氨中毒神经元及正常神经元电镜超微结构改变
Figure 3 Ultrastructure ofcultured rat neurons induced by ammonia and healthy neurons (TEM ×4000)
A:cultured rat neurons induced by ammonia; B: healthy neurons
3 讨 论
肝性脑病脑组织病理改变主要表现为水肿、神经元退行性变、尼氏小体溶解、软化灶、神经胶质细胞增生[6]。本研究发现肝性脑病大鼠基底核与黑质的超微结构均有显著改变。主要表现为神经元细胞数量减少;神经元线粒体肿胀,尼氏体数量明显减少;可见凋亡各期表现。神经胶质细胞细胞器减少,可见凋亡Ⅰ期表现。微血管扩张,血管周围溶解,基底膜破坏。黑质的超微结构改变程度较基底核略重,可见细胞凋亡的晚期表现凋亡小体。
有学者研究发现,肝硬变大鼠纹状体中神经元数量减少,染色变浅、尼氏小体减少或消失[7],与本研究结果相符。肝性脑病时神经元数目减少的原因可能为:内毒素、低氧血症使脑内毛细血管内皮肿胀、通透性增加,有害物质易进入脑内,干扰能量代谢,神经细胞受损;肝功不全,血中升高的胆酸亦可损伤内皮细胞。另外,一氧化氮也可能参与了神经元的损伤。尼氏体是由颗粒内质网及游离的多核糖体组成的易染色质,对缺血、缺氧、中毒极为敏感,其数量减少可能与肝性脑病时的缺氧状态有关[8]。
研究表明,肝性脑病的患者脑部可见到明显的大脑皮质萎缩,病理学检查可见大脑或小脑神经元及神经纤维的消失[9]。本研究发现,肝性脑病大鼠基底核和黑质神经细胞均有不同程度的凋亡表现,因此认为神经元及神经纤维的消失与神经细胞凋亡有关。肝性脑病时神经细胞凋亡的原因可能是由于高血氨引起神经细胞产生过量的细胞凋亡。
本研究发现肝性脑病大鼠微血管管腔扩张,基底膜破坏。提示肝性脑病时血脑屏障损伤,通透性增加,是肝性脑病血管源性脑水肿的发生原因。有研究发现肝性脑病患者大脑皮质毛细血管内皮细胞明显肿胀,囊泡增多,基底膜受损[10];肝性脑病大鼠微血管明显扩张,内皮皱褶增多,内皮下基底膜电子密度降低,甚至局部溶解消失;微血管周围星形胶质细胞突起及皮质内胶质细胞明显肿胀,细胞器成分减少,基质溶解,胶质细胞出现水肿[11],与本研究结果相符。但早期有学者在半乳糖胺诱导的暴发性肝衰竭兔脑超微结构研究中发现,毛细血管内皮细胞是正常的[12],其差异可能与不同的建模机制有关。
本研究发现,氨中毒神经元超微结构改变主要为:神经元细胞数量明显减少;细胞明显水肿,细胞质内空泡增多,线粒体明显肿胀,尼氏体显著减少;可见不同时期的凋亡表现。因此可以认为,氨主要导致体外培养的神经元细胞水肿,同时可诱导体外培养神经细胞产生过量的细胞凋亡。有学者通过观察体外培养的大鼠神经细胞在氨作用下的形态学、超微结构的变化,发现一定浓度的氨可以诱导神经细胞产生核染色质浓缩边集及由膜包裹形成的“凋亡小体”的典型细胞凋亡,与本研究结果基本一致[13]。结合项目组前期的细胞存活率研究结果[14],可以认为氨作用下神经元细胞的过量凋亡可能也是细胞存活率降低的原因之一。因此,凋亡在肝性脑病的发生中也起重要作用,进一步证实了氨中毒引起的神经元凋亡可能为肝性脑病大鼠脑超微结构改变的重要机制之一。
γ-氨基丁酸(gamma-aminobutyric acid,GABA)是黑质纹状体通路中最重要的抑制性递质[15]。项目组前期通过对肝性脑病大鼠GABA-A受体亚单位及γ-氨基丁酸转运体的研究发现GABA能使神经张力增高也在肝性脑病的发病中起重要作用[16,17]。其改变均是以黑质网状部改变为最,而基底节区次之。本研究电子显微镜观察发现肝性脑病大鼠基底核与黑质的超微结构均有显著改变,而黑质的改变程度较基底核更重。这些微观结构的改变,进一步表明黑质纹状体通路在肝性脑病发生中发挥作用。
[1] Chinese Society of Gastroenterology and Chinese Society of Hepatology of Chinese Medical Association. Consensus on the diagnosis and treatment of hepatic encephalopathy in China(Chongqing, 2013)[J]. Chin J Hepatol, 2013, 21(9): 641−651. [中华医学会消化病学分会, 中华医学会肝病学分会. 中国肝性脑病诊治共识意见(2013年, 重庆)[J]. 中华肝脏病杂志, 2013, 21(9): 641−651.]
[2] Qureshi MO, Khokhar N, Shafqat F. Ammonia levels and the severity of hepatic encephalopathy[J]. J Coll Physicians Surg Pak, 2014, 24(3): 160−163.
[3] Cauli O, Rodrigo R, Llansola M,. Glutamatergic and gabaergic neurotransmission and neuronal circuits in hepatic encephalopathy[J]. Metab Brain Dis, 2009, 24(1): 69−80.
[4] Choi JM, Kim YH, Roh SY. Acute hepatic encephalopathy presenting as cortical laminar necrosis: case report[J]. Korean J Radiol, 2013, 14(2): 324−328.
[5] Chu CJ, Lee FY, Wang SS,. Establishment of an animal model of hepatic encephalopathy[J]. Zhonghua Yi Xue Za Zhi (Taipei) [Chin Med J (Taipei)], 2000, 63(4): 263−269.
[6] Mustafa HN, El Awdan SA, Hegazy GA. Protective role of antioxidants on thioacetamide-induced acute hepatic encephalopathy: biochemical and ultrastructural study[J]. Tissue Cell, 2013, 45(5): 350−362.
[7] Rivera-Mancía S, Montes S, Méndez-Armenta M,. Morphological changes of rat astrocytes induced by liver damage but not by manganese chloride exposure[J]. Metab Brain Dis, 2009, 24(2): 243−255.
[8] Méndez M, Méndez-López M, Lopez L,. Mammillary body alterations and spatial memory impairment in Wistar rats with thioacetamide-induced cirrhosis[J]. Brain Res, 2008, 1233: 185−195.
[9] Zhang LJ, Qi R, Zhong J,. The effect of hepatic encephalopathy, hepatic failure, and portosystemic shunt on brain volume of cirrhotic patients: a voxel-based morphometry study[J]. PLoS One, 2012, 7(8): e42824.
[10] Kato M, Hughes RD, Keays RT,. Electron microscopic study of brain capillaries in cerebral edema from fulminant hepatic failure[J]. Hepatology, 1992, 15(6): 1060−1066.
[11] Jayakumar AR, Tong XY, Ospel J,. Role of cerebral endothelial cells in the astrocyte swelling and brain edema associated with acute hepatic encephalopathy[J]. Neuroscience, 2012, 218: 305−316.
[12] Traber PG, Dal Canto M, Ganger DR,. Electron microscopic evaluation of brain edema in rabbits with galactosamine-induced fulminant hepatic failure: ultrastructure and integrity of the blood-brain barrier[J]. Hepatology, 1987, 7(6): 1272−1277.
[13] Back A, Tupper KY, Bai T,Ammonia-induced brain swelling and neurotoxicity in an organotypic slice model[J]. Neurol Res, 2011, 33(10): 1100−1108.
[14] Li XQ,Chong L.The study of toxicity by ammonia in rats neurons[J]. Shaanxi Med J, 2009, 38(8): 956−959. [李晓青, 种 莉. 氨对体外培养大鼠神经细胞毒性的研究[J]. 陕西医学杂志, 2009, 38(8): 956−959.]
[15] Salgado M, Cortes Y. Hepatic encephalopathy: etiology, pathogenesis, and clinical signs[J]. Compend Contin Educ Vet, 2013, 35(6): e1−e8.
[16] Li XQ, Dong L, Liu ZH,. Expression of gamma-aminobutyric acid A receptor subunits alpha1, beta1, gamma2 mRNA in rats with hepatic encephalopathy[J]. World J Gastroenterol, 2005, 11(21): 3319−3322.
[17] Li XQ, Dong L. Expression of γ-aminobutyric acid transporter mRNA in rats with hepatic encephalopathy[J]. Chin J Neuromed, 2009, 8(7): 658−660. [李晓青, 董 蕾.肝性脑病大鼠γ-氨基丁酸转运体mRNA的表达[J]. 中华神经医学杂志, 2009, 8(7): 658−660.]
(编辑: 周宇红)
Ultrastructure change of brain in rats with hepatic encephalopathy
LI Xiao-Qing*, CHONG Li, LIU Peng, LIU Yue, TANG Peng, CHEN Li, ZHANG Xin, HOU Chen, LI Rui, GUO Min-Xia
(The Third Department of Neurology, Shaanxi Provincial People’s Hospital, Xi’an 710068, China)
To observe the ultrastructure change of the brain tissues in the rats with hepatic encephalopathy and determine theeffect of ammonia on the ultrastructure of rat neurons in order to investigate the pathological mechanism of these changes.Twelve healthy male SD rats were randomly divided into two groups: hepatic encephalopathy group and normal control group (with six in each group). Transmission electron microscopy was employed to observe the ultrastructure of the brain tissues in rats with hepatic encephalopathy induced by thioacetamide and ofcultured rat neurons induced by ammonia.In rats with hepatic encephalopathy, the neurons were reduced in number, with swollen mitochondria, significantly decreased Nissl body quantity, and arrested in each stage of apoptosis. While, the cell organelles in glial were also decreased, and the ultrastructure changes were more serious in the nigra than in the basal nuclei.Forinjured rat neurons induced by ammonia, the neurons were decreased in number, with edema, swollen mitochondria, and significantly reduced Nissl body quantity, and displayed apoptosis at each stage.Obvious changes are seen in the ultrastructure of nervous cells in rats with hepatic encephalopathy andinjured neurons, which might be associated with neuron apoptosis caused by ammonia.
hepatic encephalopathy; ammonia; cell culture; ultrastructure
(2012KCT-17).
R747.9
A
10.3724/SP.J.1264.2014.000142
2014−06−03;
2014−07−12
陕西省重点领域科技创新团队项目(2012KCT-17)
李晓青, E-mail: goodlxq@sina.com
