虎红定量光度法测定乳糖酸阿奇霉素*
2014-04-22马晓冬马卫兴
马晓冬,秦 浩,马卫兴
(淮海工学院 化学工程学院,江苏 连云港 222005)
0 引言
阿奇霉素是一种含有15元环大环内酯类抗生素药物。阿奇霉素在水中的溶解度很小,无法制成注射剂型。由于阿奇霉素对酸比较稳定,其分子中含有2个具有孤对电子的氮原子,可以与酸形成相应的盐类,后者水溶性好。阿奇霉素与乳糖酸反应形成乳糖酸阿奇霉素,乳糖酸阿奇霉素在水中极易溶解,可以方便地制成注射剂和局部给药制剂。乳糖酸阿奇霉素的测定方法有微生物检定法[1-2]、高效液相色谱法[3-5]和聚天青I修饰电极差分脉冲伏安法[6]。虎红是一种阴离子型的生物染色素,已经用于测定阿米卡星[7]和硫酸卡那霉素[8],但未见用于乳糖酸阿奇霉素的测定。由于乳糖酸阿奇霉素中阿奇霉素被质子化成为阿奇霉素阳离子,因此基于阿奇霉素阳离子与虎红阴离子结合形成离子缔合物的原理,提出测定乳糖酸阿奇霉素的新方法。
1 实验部分
1.1 仪器与试剂
722型分光光度计,万分之一的电子天平。虎红溶液:5×10-4mol/L的虎红溶液。Clark-Lubs缓冲溶液:pH 3.6~4.4。乳糖酸阿奇霉素溶液的配制:准确称取0.100 0g乳糖酸阿奇霉素,置于100mL烧杯中,加20mL蒸馏水溶解后,定量转移至1 000mL的容量瓶中,加蒸馏水定容,摇匀,即配成100g/L的乳糖酸阿奇霉素溶液。
1.2 实验方法
准确吸取质量浓度为100g/L的乳糖酸阿奇霉素溶液1.00mL,置于10mL比色管中,依次分别准确加入2.00mL浓度为5×10-4mol/L的虎红溶液和2.00mL pH 3.8的 Clark-Lubs缓冲溶液,用水定容,摇匀。同时配制相应的试剂空白,以试剂空白为参比,在560nm处测定溶液的吸光度A。
2 结果与讨论
2.1 吸收光谱
准确吸取质量浓度为100g/L的乳糖酸阿奇霉素溶液1.00mL,置于10mL比色管中,依次分别准确加入2.00mL浓度为5×10-4mol/L的虎红溶液和2.00mL pH 3.8的 Clark-Lubs缓冲溶液,用水定容,摇匀。同时配制相应的试剂空白。在480~640nm范围内分别测定含乳糖酸阿奇霉素的样品溶液的吸收光谱和试剂空白的吸收光谱,如图1所示。试剂空白的最大吸收波长在540nm,而乳糖酸阿奇霉素与虎红形成的离子缔合物的最大吸收波长在560nm,是典型的离子缔合显色反应,对比度为20nm。因此选择测定波长为560nm。
2.2 pH的影响
在“实验方法”项下,固定乳糖酸阿奇霉素与虎红溶液的浓度,仅改变体系的pH,考察pH对于体系的影响,结果如图2所示。当pH为3.6~4.0时,乳糖酸阿奇霉素与虎红形成的离子缔合物的吸光度最大,故以pH 3.8Clark-Lubs缓冲溶液作反应介质。试验还发现,pH 3.8Clark-Lubs缓冲溶液用量在1.75~3.00mL范围内时,体系吸光度最大而且稳定。因此选择2.00mL pH 3.8Clark-Lubs缓冲溶液来控制体系pH。

图1 吸收光谱Fig.1 Absorption spectra
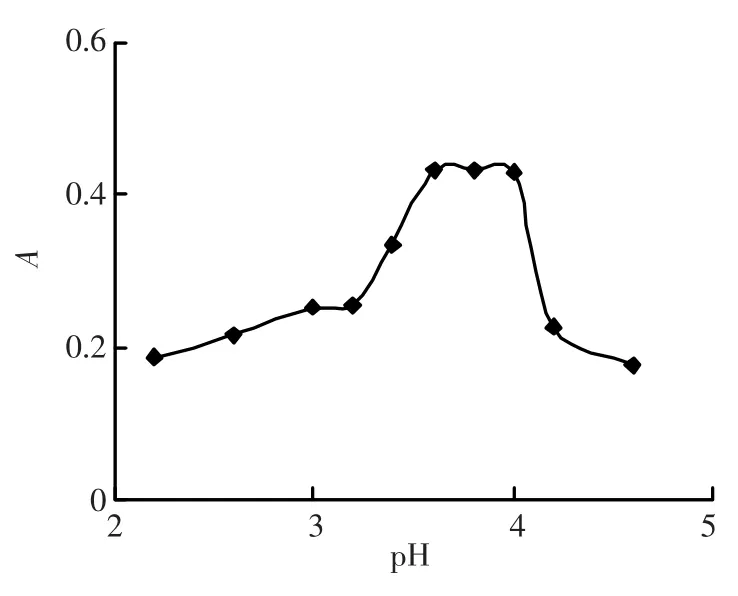
图2 pH的影响Fig.2 Effect of pH
2.3 虎红用量的影响
在“实验方法”项下,固定体系乳糖酸阿奇霉素质量浓度为10g/L和pH 3.7,仅改变虎红溶液的用量,考察虎红溶液用量对于体系的影响,结果如图3所示。随着用量的增加,体系的吸光度增加,当用量在1.50~2.25mL时体系的吸光度最大且趋于稳定。故试验选用2.00mL虎红溶液作为体系的测试条件之一。
2.4 反应时间的影响
在“实验方法”项下,于室温下考察反应时间对体系的影响,结果如图4所示。反应体系的吸光度在20~60min内稳定。故溶液配制好20min后即可以测试。

图3 虎红用量的影响Fig.3 Effect of volume of rose bengal solution

图4 反应时间的影响Fig.4 Effect of reaction time
2.5 工作曲线
准确移取0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00mL质量浓度为100g/L的乳糖酸阿奇霉素溶液,分别置于一系列10mL比色管中,依次准确加入2.00mL浓度为5×10-4mol/L的虎红溶液和2.00mL pH 3.8的 Clark-Lubs缓冲溶液,加蒸馏水定容,充分摇匀。同时配制相应的试剂空白溶液。以试剂空白为参比,在560nm处测定溶液的吸光度A,结果如图5所示。当乳糖酸阿奇霉素质量在50~250μg范围内时,吸光度A与乳糖酸阿奇霉素质量浓度ρ呈现出良好的线性关系,其线性回归方程为A=0.026 9ρ-0.105 9(式中ρ为体系乳糖酸阿奇霉素的质量浓度,g/L),其线性相关系数R为0.999 2。
2.6 干扰试验
在本文最佳实验条件下,考察了可能共存的一些干扰组分的影响,分别向体系中加入不同的干扰组分。当测定的相对误差≤±5%时,干扰因素的影响结果见表1。结果表明,体系只有表中所列物质无影响,其他成分均有一定的影响,说明这些成分可能与体系也有反应。
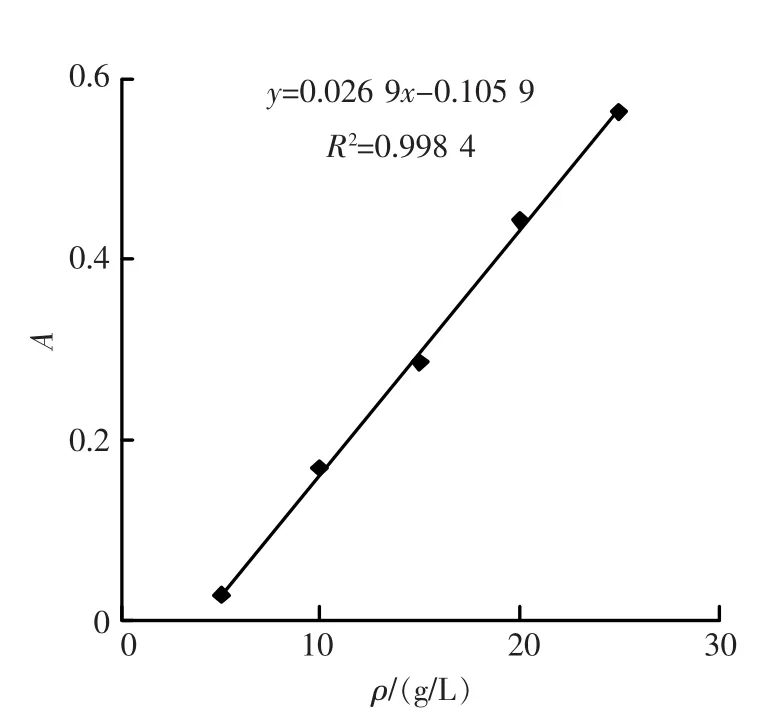
图5 工作曲线Fig.5 Working curve

表1 共存物质的影响Table 1 Effect of coexisting substances
2.7 回收试验
准确称取0.100 0g或0.200 0g乳糖酸阿奇霉素,置于100mL烧杯中,加适量蒸馏水溶解后,定量转移至1 000mL的容量瓶中,得100或200g/L的乳糖酸阿奇霉素溶液。分别准确移取1.00mL此乳糖酸阿奇霉素溶液于系列10mL比色管中,依次准确加入2.00mL浓度为5×10-4mol/L的虎红溶液和2.00mL pH 3.8的 Clark-Lubs缓冲溶液,加蒸馏水定容,充分摇匀。同时配制试剂空白溶液。以试剂空白为参比,测定溶液的吸光度A,根据工作曲线的线性回归方程计算回收率,结果如表2所示。结果表明,回收率在97.95%~101.4%范围内,平均回收率分别为99.01%和99.90%。说明用该方法测定乳糖酸阿奇霉素含量,回收率较高,测定结果准确。

表2 回收率测定Table 2 Determination of recovery
2.8 样品分析
取市售注射用乳糖酸阿奇霉素1瓶(标示量0.25g/瓶),将内容固体粉末全部溶于水,并在100 mL容量瓶中定容,摇匀,备用得样品溶液。使用时准确吸取该样品溶液25.00mL置于250mL的容量瓶中,加蒸馏水定容,摇匀,得样品稀释液。分别准确移取该样品稀释液2.00mL、2.00mL浓度为5×10-4mol/L的虎红溶液和2.00mL pH 3.8的Clark-Lubs缓冲溶液于10mL比色管中,加蒸馏水定容,充分摇匀。同时配制试剂空白溶液。以试剂空白为参比,测定样品溶液的吸光度A,平行测定8次,根据工作曲线的线性回归方程计算出相对于标示量的百分含量,所测定结果如表3所示。RSD在0.93%~1.56%之间,说明本方法用于市售注射用乳糖酸阿奇霉素是可行的。
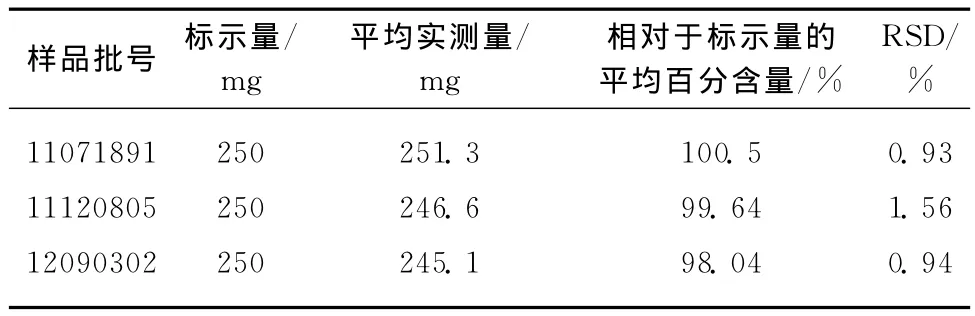
表3 注射剂含量测定结果Table 3 Analytical results of azithromycin lactobionate for injection
[1] 凌真.微生物检定法测定注射用乳糖酸阿奇霉素含量的不确定度评价[J].药物与临床研究,2011,19(6):573-576.
[2] 邹积宏,邹积先,刘红梅,等.注射用乳糖酸阿奇霉素含量测定[J].黑龙江医药,2006,19(6):436-437.
[3] 张集盘,程爱春,卢晶晶,等.HPLC法测定注射用乳糖酸阿奇霉素的含量[J].中国药师,2007,10(11):1067-1069.
[4] 李娜然,孟祥军,齐杰.用HPLC法测定乳糖酸阿奇霉素注射液的含量[J].光谱实验室,2006,23(2):405-408.
[5] 李华刚,张旭春,伍远辉,等.聚天青I修饰电极差分脉冲伏安法测定乳糖酸阿奇霉素[J].西南师范大学学报:自然科学版,2012,37(5):35-38.
[6] 马卫兴,沙鸥,刘英红,等.乳化剂OP存在下蛋白质与虎红的超分子显色反应研究及分析应用[J].分析试验室,2007,26(3):58-62.
[7] 江虹,张孝彬,何树华,等.虎红、曲利本红-阿米卡星的光度法研究[J].中国抗生素杂志,2006,31(10):631-634.
[8] 唐宁莉,杨兰玲,蒋杰,等.虎红光度法测定硫酸卡那霉素[J].桂林理工大学学报,2010,30(1):137-139.
[9] 马卫兴,章健,蔡亚雯,等.对磺基苯偶氮变色酸褪色光度法测定壳聚糖的研究[J].淮海工学院学报:自然科学版,2012,21(1):43-46.
