4A沸石对锰渣渗滤液中Mn2+吸附—解吸研究
2014-04-20徐中慧刘桂江齐一谨
郑 磊,徐中慧,3,刘桂江,肖 博,齐一谨,彭 熙
(1. 西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;2. 西南科技大学非煤矿山安全技术四川省高等学校重点实验室,四川 绵阳 621010;3. 西南科技大学 核废物与环境安全国防重点学科实验室,四川 绵阳 621010)
0 前 言
据统计,我国在2001-2012年期间共生产电解金属锰(以下简称为:电解锰)997.35万t,并产生大约1亿t电解金属锰渣(以下简称为:电锰渣)[1]。巨量堆存的电锰渣经雨淋产生含Mn、Zn、Cu、As和Cr等重金属的渗滤液进入土壤、地表水和地下水环境,对周边人群的身心健康构成威胁[2],亟需无害化和资源化处理。
重金属废水的传统处理方法主要有化学沉淀法、电渗析法、微生物法等。但化学沉淀法产生大量含重金属污泥,易造成二次污染;电渗析法投资及运行成本高,操作较复杂;微生物生长周期长,重金属对微生物活性有抑制作用[3]。近年来,4A沸石作为吸附剂处理重金属废水因其去除效果好、投资成本低和操作简单等优势引起了国内外学者的广泛关注[4-9]。目前的研究成果侧重于4A沸石对目标重金属的吸附性能及其吸附动力学,而关于吸附后沸石中重金属的资源化研究却鲜见报道。
本文在开展4A沸石吸附模拟锰渣渗滤液实验的基础上,进一步研究了化学解吸和化学—物理联合解吸含锰沸石的效果,通过X射线衍射分析(XRD)和红外光谱分析(FTIR)研究4A沸石吸附Mn2+的机制及解吸行为。
1 实验方法
1.1 实验材料及设备
依据《工业固体废物采样技术规范》(HJ/T20-1998),从四川某电锰渣库采集电锰渣样品,样品风干、除杂,过0.37 mm(40目)筛待用。4A沸石分子筛研磨待用(天津科密欧试剂公司生产);采用X射线荧光光谱仪(Axios:管压60 kV,管流100 mA)对电锰渣和4A沸石化学成分进行分析(表1),采用X射线衍射仪[X’Pert PRO:Cu靶2.2 kW,最大电压60 kV,最大电流50 mA,2θ角3(°)~80(°)]对锰渣物相结构进行分析。样品测试均在西南科技大学分析测试中心进行。
表1电锰渣和4A沸石化学组成(质量分数)/%

1.2 模拟酸雨淋溶实验
设计酸雨淋溶实验探索电锰渣中Mn2+在酸雨淋溶条件下的释放规律。按浓H2SO4(98%)∶浓HNO3(69%)摩尔比为1.2∶1,CaSO4∶MgSO4∶(NH4)2SO4∶NaNO3∶KCl摩尔比为0.4∶0.4∶0.4∶1∶1,配制pH为4.5的模拟酸雨[10](所用试剂均为分析纯)。称取电锰渣样35 g,装入直径3.5 cm,高40 cm的淋溶柱中,淋溶柱上部与底部分别铺上2层中速定量滤纸,1层脱脂棉和玻璃纤维,使淋溶尽量均匀,以防渣样和液体溅出,下端出口用锥形瓶收集淋溶液。按照当地的年均降雨量807.6 mm,设计累计淋溶量为842.383 mL,进水流速设计为34.62 mL/h,为更接近自然降水过程,采用间歇式淋溶法,每隔24 h淋溶2 h,收集滤液经过0.45 μm滤膜,并加入2%的HNO3保存待测。实验装置见图1所示。

1 玻璃纤维; 2 砂芯; 3 定性滤纸; 4 柱式试验架;5 蠕动泵; 6 模拟酸雨溶液
1.3 4A沸石吸附—解吸实验
1.3.1 单位4A沸石吸附实验及解吸沸石制备
称取4A沸石各1 g,分别放入1 000 mL Mn2+浓度为150,200,400 mg/L的模拟电锰渣渗滤液中,静态吸附(25℃,80 r/min),0.5,1,2,3,4,24 h后取样离心分离,储备待测。同时称取4A沸石150 g,放入1 000 mL Mn2+浓度为250 mg/L的模拟电锰渣渗滤液中,静态吸附8 h(25℃,80 r/min),离心分离(3 000 r/min,10 min)。用火焰原子吸收光谱仪测试上清液中Mn2+浓度,用X射线衍射和红外光谱对含锰沸石进行表征,按照下式计算Mn2+吸附率:
η=(C0-Ce)/C0
(1)
式中C0——溶液中Mn2+的初始浓度(mg/L);
Ce——溶液的平衡浓度;
η——Mn2+的吸附率。
1.3.2 4A沸石解吸实验
称取5 g吸附沸石,置于50 mL锥形瓶中(除探索浓度影响的实验组外,其他实验组解吸剂[6,11]均为0.1 mol/L),振动频率为120 r/min,每组实验设定3个平行。分别在15,30,45,60,75 min取样2 mL,过滤测试溶液中Mn2+浓度。采用傅里叶红外光谱仪分析吸附和解吸前后的含锰沸石,解吸单因素实验参数设计见表2。

表2 4A沸石解吸实验参数
解吸率通过下列方程进行计算:
ρ=Md/Ma
(2)
式中ρ——解吸率;
Md——解吸的Mn2+质量;
Ma——吸附的Mn2+质量。
2 结果与讨论
2.1 电锰渣特性鉴别
2.1.1 电锰渣矿物学及化学成分分析
电锰渣的XRD图谱见图2。

1 石英; 2 石膏
由图2可知,该锰渣样品中主要矿物成分为石英和石膏。结合表1分析可知,该渣样中主要有毒有害重金属元素Mn、Cr、As和Zn以无定形态赋存于电解锰渣中,他们经过酸雨淋溶作用易释放至环境中,需要对其特性进行进一步分析。
2.1.2 电锰渣浸出毒性及腐蚀性结果
浸出毒性测试是模拟电锰渣中的重金属在较极端环境下的释放行为,结果见表3。

表3 电锰渣浸出毒性及腐蚀性测试结果
电锰渣中的总铬和砷的浸出浓度分别为1.642,0.275 mg/L,锰渣pH为6.3,各项指标均未超出《危险废物鉴别标准》(GB5085.3-2007,GB5085.1-2007),所以电锰渣不属于浸出毒性和腐蚀性的危险废物。浸出液中总铬和砷的浓度并未超过污水排放标准,但Mn2+浓度为263.82 mg/L,是《污水综合排放标准》(GB18466-2005)规定值的130倍,因此仅针对Mn2+开展酸雨淋溶实验和吸附解吸实验,研究其释放规律和吸附解吸行为。
2.1.3 电锰渣酸雨淋溶实验结果
电锰渣浸出液中Mn2+浓度随雨淋时间的变化关系见图3。

图3 Mn2+浓度随雨淋时间的变化
由图3可知,电锰渣在模拟酸雨的作用下,前期1 ~ 4 d释放的Mn2+浓度较高,浓度在200 mg/L之上。随着时间的推移,Mn2+浓度呈现递减的趋势,从第8 d开始,Mn2+浓度不再大幅变化。电锰渣浸出液中Mn2+累积浓度较高,远远超过《废水综合排放标准》(GB18466-2005),若不进行无害化和资源化处置,将对锰渣库周围的土壤、地下水和地表水系构成威胁,危害人类健康。
2.2 4A沸石吸附/解吸行为研究
2.2.1 4A沸石对Mn2+的吸附行为研究
沸石对Mn2+具有高效的吸附能力,3组实验中,单位4A沸石在24 h内趋于动态平衡,最高吸附量分别为92.61 mg/g(150 mg/L)、79.14 mg/g(200 mg/L)和92.84 mg/g(400 mg/L)。而解吸沸石制备实验中,模拟锰渣渗滤液经4A沸石吸附后,Mn2+浓度由250 mg/L降至1.665 mg/L,低于《废水综合排放标准》(GB18466-2005)规定值2 mg/L,去除效率高达99.34%。
2.2.2 4A沸石对Mn2+的吸附机制研究
吸附前后4A沸石的XRD图谱比较见图4,图中X表示X型沸石的杂峰。
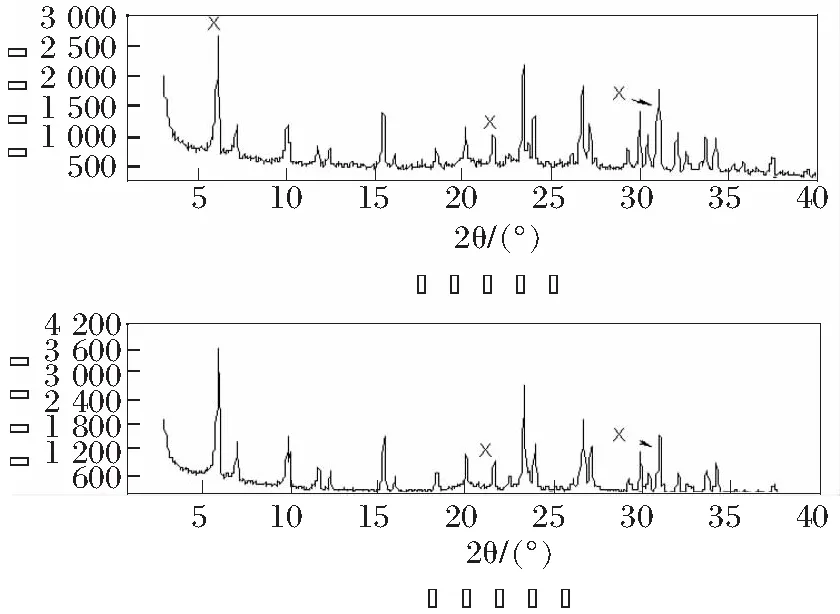
图4 吸附前后4A沸石的XRD比较
由图4分析可知,吸附前后4A沸石中主要以X型沸石为主。由于吸附后沸石中Na+、Mg2+被离子半径较大的Mn2+置换,与Na+、Mg2+相比,Mn2+与Si-O键的静电作用增大,致使X射线衍射叠加后振幅减小,晶体结构因子减小,使得X射线积分强度减小即衍射峰强度降低。吸附后的4A沸石图谱中出现部分弥散峰消失的现象,说明吸附后的沸石发生了一定程度的晶格畸变[12-13]。结合表4可知,4A沸石吸附Mn2+离子后晶胞参数发生相应变化,集中体现在体积V值显著增加。由此说明4A沸石对Mn2+吸附机制主要为离子交换。
2.2.3 化学法及化学—物理联合法解吸效果对比
各组实验的解吸效率对比见图5。
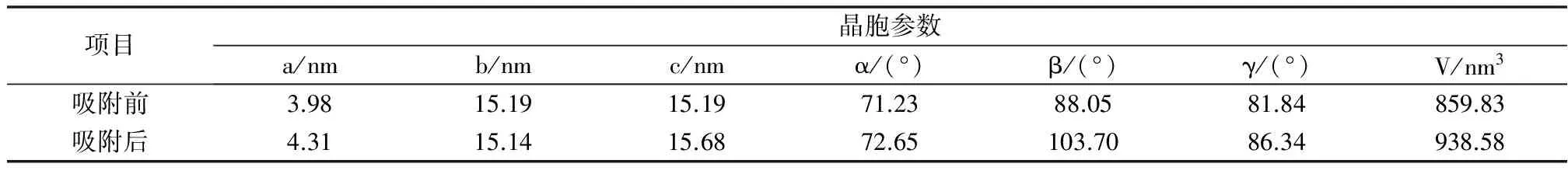
表4 吸附前后4A沸石晶胞参数变化

1,2,3组其他条件:解吸剂0.1mo/L,pH=7;4,5,6组其他条件:温度25℃,pH=7;7,8,9组其他条件:解吸剂0.1mol/L,温度25℃;10组其他条件:解吸剂0.1mol/L,温度25℃,pH=7
利用NaCl溶液解吸含锰4A沸石,其解吸率最高仅为1.48%,在超声波辅助下解吸率提高不明显,仅为1.58%。推断由于Mn2+进入沸石晶格中重新形成更牢固的化学键,使得Na+很难将其置换下来,因此化学解吸效果较差[7,14];超声波作用产生的“空化效应”,并未对沸石晶格中的化学键产生影响[15],仅对少量通过物理作用吸附在4A沸石上的Mn2+有解吸效果,可以判断出物理吸附不是4A沸石对Mn2+主要作用方式;Mn2+的解吸率并未随着pH的降低而升高,表明Mn2+不是以Mn(OH)2的形式沉淀于4A沸石内孔表面而得到去除,pH对解吸效率影响小[12]。 如果单纯用强酸解吸沸石,则会造成沸石原本结构的破坏,三维骨架的断裂,很难再具有吸附能力,再生能力差[9]。以上结果表明,化学解吸和化学—物理联合解吸对于沸石型离子交换吸附的解吸效果不佳。
2.3 不同阶段4A沸石的傅里叶红外光谱分析
4A沸石红外光谱分析结果如图6所示。
吸附前沸石在3 433.95 cm-1发生了结晶水伸缩振动,而吸附后和解吸后沸石的结晶水伸缩振动未发生明显变化(3 434.45 cm-1和3 434.80 cm-1)表明吸附后沸石中的Mn2+与-OH键没有发生作用。吸附前沸石的Si—O伸缩振动发生在1 002.53 cm-1,吸附后和解吸后沸石的Si—O伸缩振动谱带蓝移至1 006.16 cm-1和1 006.64 cm-1;吸附前沸石的Si—O弯曲振动发生在552.48 cm-1,吸附后和解吸后的沸石的Si—O弯曲振动红移至551.27 cm-1和551.61 cm-1[16],表明吸附后沸石中的Mn2+进入了沸石晶格与Si—O键形成了更牢固的化学键,使得Si—O键的极性发生改变,从而导致沸石中硅氧骨架的振动频率发生变化[12,14]。红外光谱分析结论进一步验证了4A沸石对Mn2+的吸附机制主要为离子交换。

1 吸附前沸石; 2 吸附后沸石; 3 解吸后沸石
3 结 论
1)电锰渣不属于具有浸出毒性和腐蚀性的危险废物,但浸出液中Mn2+浓度超出标准限值的130倍,酸雨淋溶实验中前4 d的Mn2+浸出浓度均超标100倍,需对电锰渣渗滤液进行无害化和资源化处置。
2)4A沸石对模拟锰渣渗滤液中Mn2+的去除效率高达到99.34%,吸附量最高可达92.84 mg/g,选择性吸附效果好,但化学解吸和化学—物理联合解吸对于沸石型离子交换吸附的解吸效果不佳,Mn2+解吸率均未超过1.6%。
3)X射线衍射分析表明Mn2+取代Na+和Mg2+进入沸石晶格,4A沸石衍射峰强度下降,晶胞体积增大,晶格发生畸变,4A沸石对Mn2+的吸附机制主要为离子交换;红外光谱分析表明进入晶格中的Mn2+与Si—O键键合,使Si—O键的伸缩振动和弯曲振动谱带发生明显偏移,进一步验证了4A沸石对Mn2+的吸附机制主要为离子交换。
参考文献:
[1] 谭柱中. 2012年中国电解金属锰工业回顾与展望[J]. 中国锰业, 2013, 31(2):1-4.
[2] Li C X,Zhong H,Wang S, et al. Leaching behavior and risk assessment of heavy metals in a landfill of electrolytic manganese residue in western Hunan, China[J]. Human and Ecological Risk Assessment, 2014, 20(5): 1249-1263.
[3] Barakat. M A. New trends in removing heavy metals from industrial wastewater[J]. Arabian Journal Chemistry, 2010, 4(4):361-377.
[4] Myroslav S, Boguslaw B, Artur P T, et al. Study of the selection mechanism of heavy metal (Pb2+, Cu2+, Ni2+, and Cd2+) adsorption on clinoptilolite[J]. Journal of Colloid and Interface Science, 2006, 304(1): 21-28.
[5] Claudia B,Francesco C,Spartaco D G, et al. Removal of Mn from aqueous solution using fly ash and its hydrothermal synthetic zeolite[J]. Journal of Environmental Management, 2014, 137(1): 16-22.
[6] 金兰淑, 高湘骐, 刘洋, 等. 4A沸石对复合污染水体Pb2+、Cu2+和Cd2+的去除[J]. 环境工程学报, 2012, 27(6): 1-4.
[7] Hui K S, Chao C Y H, Kot S C. Removal of mixed heavy metal ions in wastewater by zeolite 4A and residual products from recycled coal fly ash[J]. Journal of Hazardous Materials, 2005, 127(1-3): 89-101.
[8] Mehdizadeh S,Sadjadi S,Ahmadi S J, et al. Removal of heavy metals from aqueous solution using platinum nanopartcles/Zeolite-4A[J]. Journal of Environmental Health Science and Engineering, 2014, 12(7): 7.
[9] Majdan M, Pikus S, Kowalska-Ternes M, et al. Equilibrium study of selected divalent d-electron metals adsorption on A-type zeolite[J]. Colloid Interface Science, 2003, 262: 321-330.
[10] 魏菱,邓新华,刘仲秋. 四川省酸雨污染现状及趋势分析[J]. 四川环境, 2001, 20(4):63-65.
[11] Evina K, Simos M, Myrto T, et al. Regeneration of natural zeolite polluted by lead and zinc in wastewater treatment systems[J]. Journal of Hazardous Materials, 2011, 189(3): 773-786.
[12] 易发成,金承黎,李玉香. 4A沸石吸附模拟核素Sr、Cs后的组分变化和结构表征[J]. 矿物岩石, 2005, 25(2):35-39.
[13] 王海龙,徐中慧,吴丹丹,等. 粉煤灰两步水热步制备人工沸石[J]. 化工环保, 2013, 33(3):272-275.
[14] Wang Z K, Ye C L, Wang X Y, et al. Adsorption and desorption characteristics of imidazole-modified silica for chromium(Ⅵ)[J]. Applied Surface Science, 2013, 287(15): 232-241.
[15] 郭平生,韩光泽,张妮,等. 超声波强化解吸速率的机理及场协同分析[J]. 高校化学工程学报, 2006, 20(2):300-306.
[16] Kim J O, Lee S M, Jeon C. Adsorption characteristics of sericite for cesium ions from an aqueous solution[J]. Chemical Engineering Research&Design, 2014, 92(2): 368-374.
