碳酸盐共沉淀法合成Li1+xNi0.6Co0.2Mn0.2O2Fx正极材料及其电化学性能
2014-04-20卢道焕李普良李华成王春飞陈南雄中信大锰矿业有限责任公司广西南宁53009苏州大学江苏苏州50
卢道焕,李普良,李华成,王春飞,陈南雄,伍 凌(. 中信大锰矿业有限责任公司,广西 南宁 53009;. 苏州大学,江苏 苏州 50)
LiCoO2具有电化学容量较高、循环性能好并且制备工艺简单而成为最早商业化的锂离子电池正极材料[1]。但由于钴资源有限导致价格昂贵,且有一定毒性,所以电池研究者致力于寻找更好的材料来取代LiCoO2[2-5]。近年来,锂镍钴锰氧化物受到了研究者的广泛关注,文献报道的LiNixMnyCo1-x-yO2[6-9]这类材料具有比容量高、结构和热稳定性良好等特点,但大倍率循环性能不佳,进一步提高其循环性能的关键在于提高正极材料的稳定性。一种改善电极材料稳定性的方法是通过阴、阳离子的共掺杂修饰改性来提高其电化学循环性能。通过碳酸盐共沉淀法合成LiNi0.6Co0.2Mn0.2O2样品,本文研究了不同含量的Li、F复合掺杂对LiNi0.6Co0.2Mn0.2O2样品的晶型结构、形貌以及电化学性能的影响。
1 试验部分
1.1 样品制备
按物质的量的比3∶1∶1,分别称取Ni(CH3COO)2·4H2O、Co(CH3COO)2·4H2O、Mn(CH3COO)2·4H2O,溶于去离子水中,搅拌溶液的同时逐滴加入Na2CO3,用氨水控制溶液的pH值在8.5~12.5之间,水浴温度控制在40~80℃之间,反应完成后继续陈化18 h。将所得的沉淀过滤,并用去离子水充分洗涤后,将沉淀物120℃真空干燥12 h,得到前驱体Ni0.6Co0.2Mn0.2CO3。
Li1+xNi0.6Co0.2Mn0.2O2Fx样品的合成:按物质的量的比Ni0.6Co0.2Mn0.2CO3∶LiOH·H2O∶LiF=1∶1∶x(x=0、0.03、0.06、0.09)称取试验成分,混合并研磨均匀后置于电阻炉中,在空气氛围下于800℃烧结12 h,即得到Li1+xNi0.6Co0.2Mn0.2O2Fx样品。
1.2 样品检测
样品的物相分析分析采用荷兰帕纳科公司的X射线衍射仪进行,扫描范围为10(°)~80(°);形貌测试采用JSM-6380LV型扫描电子显微镜(日本电子株式会社)进行,加速电压为20 kV。
将原料按质量分数比80∶10∶10称取所制备的Li1+xNi0.6Co0.2Mn0.2O2Fx、乙炔黑、聚偏氟乙烯(PVDF),以N-甲基吡咯烷酮(NMP)为溶剂进行溶解得到正极浆液,再将浆液涂覆在预处理过的铝箔上,120℃下真空干燥4 h后取出,用专用模具裁成直径为1.2 cm的圆片。在氩气保护的手套箱中,以金属锂片为负极,Celgard2400微孔聚丙烯膜为隔膜,以1 mol/L LiPF6/EC+DMC+EMC(体积比1∶1∶1)为电解液,组装成CR2025型扣式电池。采用深圳新威尔公司的CT-3008W电池性能测试仪进行充放电性能测试,采用上海辰华仪器公司的CHI660D电化学工作站进行循环伏安性能测试。
2 结果与讨论
2.1 掺杂对样品晶体结构的影响
图1为Li1+xNi0.6Co0.2Mn0.2O2Fx样品的XRD图。
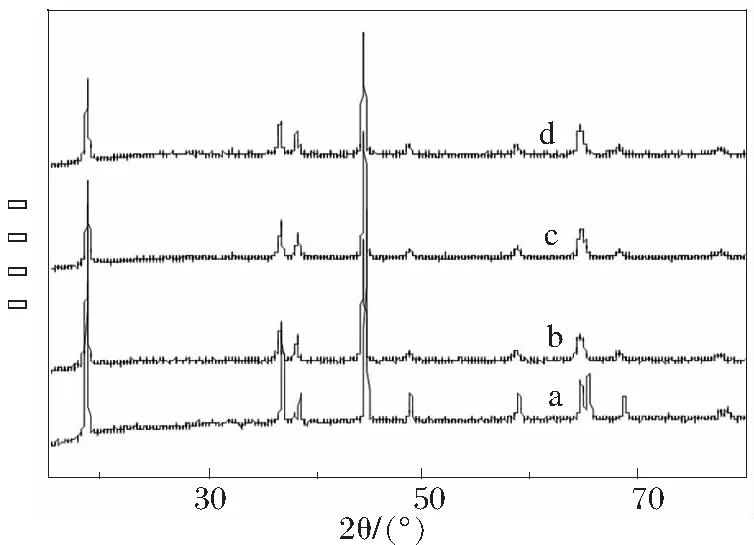
a x=0;b x=0.03;c x=0.06;d x=0.09
由图1可以看出,不同含量的Li、F掺杂的LiNi0.6Co0.2Mn0.2O2样品与未掺杂的LiNi0.6Co0.2Mn0.2O2样品一样,其衍射峰与标准的层状α-NaFeO2晶型的衍射峰相对应。并且随着F、Li掺杂含量的增加,Li1+xNi0.6Co0.2Mn0.2O2Fx样品衍射峰的形貌和位置改变都没有显著的变化,无杂质峰,表明样品为纯相,而且各个衍射峰逐渐变得尖锐,表明正极材料的层状结构趋于完美,晶体中离子扩散均匀,结晶度好。
2.2 掺杂对样品表面形貌的影响
图2为Li1+xNi0.6Co0.2Mn0.2O2Fx样品的SEM形貌。

a x=0;b x=0.03;c x=0.06;d x=0.09
由图2可以看出,随着F、Li掺杂含量的增加,颗粒间孔隙逐渐减小,越来越致密,团聚程度明显增加。这是由于LiF作为一种有效的矿化剂[10],有利于烧结,制备材料时添加少量LiF起着相同的作用。对锂离子电池而言,电极材料的粒径对电极的制作及电化学性能均有较大的影响。掺杂量x=0.06时,Li1+xNi0.6Co0.2Mn0.2O2Fx样品颗粒最小,粒径分布比较均匀。
2.3 掺杂对样品电化学性能的影响
图3~4为Li1+xNi0.6Co0.2Mn0.2O2Fx样品的首次充放电曲线和循环性能曲线,其样品的电化学性能见表1。

表1 Li1+xNi0.6Co0.2Mn0.2O2Fx样品的电化学性能
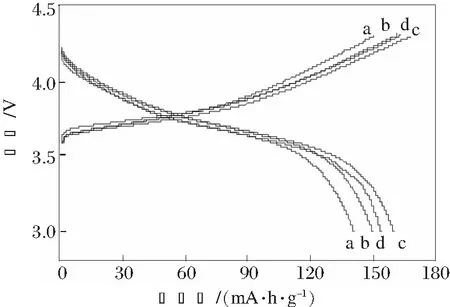
a x=0;b x=0.03;c x=0.06;d x=0.09

a x=0;b x=0.03;c x=0.06;d x=0.09
由图3~4和表1可以看出,不同含量的F、Li掺杂对样品的电化学性能影响较大。随着掺杂F、Li含量的增大,样品的首次充放电性能和循环性能得到改善。x=0.06时,Li1+xNi0.6Co0.2Mn0.2O2Fx样品电化学性能最好。这可能是由于制备材料时添加少量LiF有利于烧结,并且电极材料的粒径对电极的制作及电化学性能均有较好的影响。
2.4 样品循环伏安研究
图5为Li1+xNi0.6Co0.2Mn0.2O2Fx(x=0、0.06)样品电极的循环伏安曲线。

a x=0;b x=0.06
由图5可以看出,2个样品均有1对相似的氧化峰和还原峰。x=0.06时,Li1+xNi0.6Co0.2Mn0.2O2Fx样品由于F、Li掺杂造成氧化峰上移,还原峰下移。未掺杂的样品分别于3.97,3.67 V处出现氧化峰与还原峰,x=0.06时的Li1+xNi0.6Co0.2Mn0.2O2Fx掺杂样品分别于3.9,3.61 V处出现氧化峰与还原峰。显然,Li、F掺杂后样品的氧化峰和还原峰电位差减小,电极反应的可逆性提高,因而掺杂后样品的电化学性能得到提高。
2.5 样品的交流阻抗性能
图6为Li1+xNi0.6Co0.2Mn0.2O2Fx(x=0、0.06)样品电极的交流阻抗谱图。
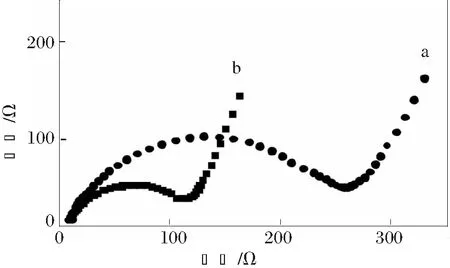
a x=0;b x=0.06
由图6可以看出,x=0.06时的Li1+xNi0.6Co0.2Mn0.2O2Fx掺杂样品的电化学阻抗与未掺杂的样品相比明显变小,这也是Li、F复合掺杂后样品电化学性能得到改善的主要原因。
3 结 论
采用碳酸盐共沉淀法合成Li、F复合掺杂的LiNi0.6Co0.2Mn0.2O2样品,Li、F复合掺杂未改变LiNi0.6Co0.2Mn0.2O2样品的层状结构;掺杂后的样品颗粒细化;电化学循环性能和电极过程的可逆性明显得到提高;电化学阻抗变小。掺杂量x=0.06时Li1+xNi0.6Co0.2Mn0.2O2Fx样品的电化学性能最好,首次充放电比容量分别为168,160 mA·h/g,循环50次后比容量为153 mA·h/g。
参考文献:
[1] Tukaoto H, West A R. Electronic conductivity of LiCoO2and its enhancement by magnesium doping[J]. J. Electrochem. Soc., 1997, 144(9):3164-3168.
[2] Nishida Y, Nakane K, Satoh T. Synthesis and properties of gallium-doped LiNiO2as the cathode material for lithium secondary batteries[J]. J. Power Sources, 1997, 68:561-564.
[3] Xia Y, Yoshio M. Studies on Li-Mn-O spinel system(obtain from melt-impregnation method)as a cathode for 4 V lithium batteries, Part Ⅳ. High and low temperature performance of LiMn2O4[J]. J. Power Sources, 1997, 66:129-133.
[4] Mineo S, Hirokazu O, Kenji Y, et al. Enhancement of discharge capacity of Li3V2(PO4)3by stabilizing the orthorhombic phase at room temperature[J]. Solid State Ionics, 2000, 135:137-142.
[5] Arold G, Garche J, Hemmer R, et al. Fine-particle lithium iron phosphate LiFePO4synthesized by a new low-cost aqueous precipitation technique[J]. J. Power Sources, 2003(119/121):247-251.
[6] Park S H,Oh S W,Sun Y K. Synthesis and structural characterization of layered Li[Ni1/3+xCo1/3Mn1/3-2xMox]O2cathode materials byultrasonic spray pyrolysis[J]. J.Power Sources,2005,146(1/2):622-625.
[7] Liao P Y, Duh J G, Sheen S R. Microstructure and elec-trochemical performance of LiNi0.6Co0.4-xMnxO2cathode materials[J]. J Power Sources, 2005, 143(1/2):212-218.
[8] Li J, He X, Zhao R, et al. Stannum doping of layered LiNi3/8Co2/8Mn3/8O2cathode materials with high rate capability for Li-ion batteries[J]. J.Power Sources, 2006, 158(1):524-528.
[9] Park K S, Cho M H, Jin S J, et al. Structural and electrochemical properties of nanosize layered Li[Li1/5Ni1/10Co1/5Mn1/2]O2[J]. Electrochem. Solid-State Lett., 2004, 7(8):A239-A241.
[10] 李建刚,万春荣,杨冬平,等. LiNi3/8Co2/8Mn3/8O2氟掺杂改性研究[J]. 无机材料学报,2004,19(6):1298-1306.
