早期胚胎体外培养微流控芯片的制备及初步应用
2014-04-19宁博林韩兴龙汪志军王秋实李井春
宁博林,徐 泽,李 悦,韩兴龙,汪志军,王秋实,李井春
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆163319)
随着胚胎生物工程技术的发展,如动物体外受精、克隆、转基因等技术,都面临胚胎体外囊胚发育率低和质量差的问题[1,2],其关系到整个胚胎工程产业的成败。然而,早期胚胎体外培养大多数研究主要集中在胚胎发育所需要的培养液上,却忽略了早期胚胎在体内输卵管中发育所需要的物理性因素,即发育的微环境及机械性力刺激的影响。早期胚胎在输卵管中既需要胚胎生长发育的营养物质,也同时受到输卵管蠕动时的挤压力、输卵管液流动的层流剪切力以及与上皮纤毛接触的摩擦力等的作用。如何在体外模拟输卵管对早期胚胎发育的物理性刺激的微环境成为问题的关键。这样就想到了微流控芯片技术,其是20 世纪90年代初,基于微电子、微机械、生物工程和纳米技术发展起来的一种新的研究技术[3,4]。
Akagi 等[5]利用PDMS 制作显微小室的显微培养盘,利用其培养早期胚胎时,囊胚发育率和内细胞团细胞数明显高于常规的液滴培养法。最近,日本研究者使用振摇胚胎培养刺激装置对小鼠和人的胚胎进行培养,取得良好的培养效果。推测可能是通过振摇物理刺激有利于胚胎自身分泌的促进胚胎发育因子在胚胎间扩散及相互作用,同时也有利于胚胎代谢产物排出[6]。Chae Yun Bae等[7]应用微流控培养装置对牛的胚胎进行体外培养时施加不同大小机械力的刺激,在适当的机械力刺激下能够明显增加囊胚发育率。目前,在国内应用微流控芯片模拟输卵管进行早期胚胎的研究鲜有报道。
本实验应用微流控芯片技术模拟早期胚胎体内发育的微环境制作了胚胎体外培养微流控芯片装置并施加适当的物理性刺激,探究胚胎体外培养微流控芯片对小鼠早期胚胎体外发育率及质量的影响,为早期胚胎体外培养技术改良提供一种新的研究思路。
1 材料与方法
1.1 实验动物
昆明系小白鼠(雄性12 ~16 周龄,雌性6 ~8 周龄) 来自于黑龙江八一农垦大学动物科技学院动物繁殖教研室,自繁,自由饮水,自由采食,12 ~14 h 光照,室温20 ~26 ℃。
1.2 主要试剂与仪器
试剂有m CZB 液(自制) 见表1、孕马血清促性腺激素(PMSG,宁波激素厂) 、人绒毛膜促性腺激素(HCG,宁波激素厂) 、谷胱甘肽、道康宁-184 预聚体和凝固剂(美国产,PDMS) 等; 仪器包括二氧化碳培养箱、真空脱泡器、实体显微镜、干燥箱等。
1.3 实验方法
1.3.1 微流控芯片培养盘的制备
一次性铸模构建微流控芯片胚胎培养装置,预先设计并制作模具,将PDMS 预聚体和凝固剂混合好(v/v 为10 ∶1) ,脱泡处理后,浇铸在模具中,放入干燥箱中升温到75 ℃,30 min,处理后将模具拆下,这样微流控芯片胚胎培养装置就制备完成,备用(制作过程见图1) 。

图1 一次性成型的微流控芯片胚胎培养装置示意图与实物图
1.3.2 微流控芯片胚胎培养装置系统的构成
主要由微流控芯片培养盘、微流控芯片培养装置振动系统等组成,具体见图2。
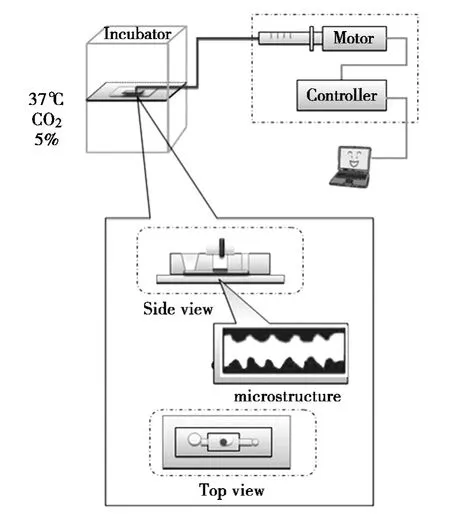
图2 胚胎体外培养微流控芯片装置示意图
1.4 实验设计
1.4.1 微流控芯片培养装置对小鼠早期胚胎体外发育率的影响
将小鼠的受精卵随机分成三组,分别为: 对照组1 为常规液滴培养组(CZB 培养液) 、对照组2 为CZB +谷胱甘肽微滴培养组、微流控芯片培养组。CZB +谷胱甘肽组为在CZB 培养液中添加5 mmol/L 的谷胱甘肽; 微流控芯片培养组培养液为在CZB 培养液中添加5 mmol/L 的谷胱甘肽并且在微流芯片中进行培养。将三组的结果进行比较分析。
1.4.2 微流控芯片培养装置对小鼠早期囊胚总细胞数的影响
将对照组和微流控芯片组培养得到的囊胚经过H33342 染色后,利用荧光显微镜观察,记录细胞数。比较两组的差异性。
1.5 数据分析
利用StatView 5.0 软件对实验测定的各项指标进行方差分析和多重比较,实验结果用平均数±标准差来表示。当P <0.05 时差异显著,肩标字母不同表示差异显著。
2 实验结果
2.1 微流控芯片培养装置对小鼠早期胚胎体外发育率的影响
由表1 可知,对照组1 与对照组2 中2-细胞胚胎发育率、8-细胞胚胎发育率、桑葚胚发育率、囊胚发育率都差异显著(P <0.05) 。对照组1 与微流芯片组中2-细胞胚胎发育率、8-细胞胚胎发育率、桑葚胚发育率、囊胚发育率都差异显著(P <0.05) 。对照组2 与微流控芯片组中2-细胞胚胎发育率差异不显著(P >0.05) ,但是,在8-细胞胚胎发育率、桑葚胚发育率和囊胚发育率都差异显著(P <0.05) 。
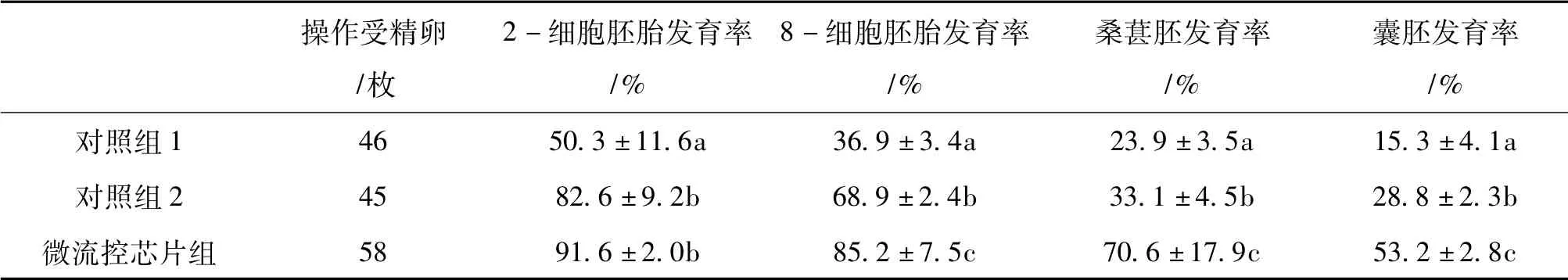
表1 微流控芯片培养装置对小鼠早期胚胎体外发育率的影响
2.2 微流控芯片培养装置对小鼠早期囊胚总细胞数的影响
从表2 可以看出,微流控芯片组与液滴培养组在囊胚总细胞数存在显著差异(P <0.05) 。

表2 微流控芯片培养装置对小鼠早期囊胚总细胞数的影响
3 分析与讨论
我们采用的一次性铸型微流控芯片胚胎培养装置制备方法与常规的制作方法进行比较,操作简单,不需要昂贵的仪器设备,也不会出现培养过程中培养液渗漏的现象。
微流控芯片胚胎培养装置对小鼠早期胚胎体外发育率影响的结果见表1。从实验的结果上可以看出,谷胱甘肽添加到培养液中可以在一定程度上克服小鼠早期胚胎发育阻滞的问题,所以液滴培养法,在添加谷胱甘肽时,与没有添加谷胱甘肽组相比,卵裂率上存在显著差异,这也说明添加谷胱甘肽可以作为一种有效的抗氧化剂克服小鼠早期胚胎发育的阻滞问题。本实验得到的结果与方南洙[8]等发表的结果一致。所以本实验应用微流控芯片培养装置进行小鼠早期培养时,所用的培养液中也添加谷胱甘肽。
有学者报道,多个胚胎在少量的培养液中同时培养有利于胚胎发育,增加囊胚总细胞数目,促进胚胎移植后的存活。主要是因为这些胚胎产生了有益的促生长因子,从而刺激其自身和周围胚胎的发育。当在少量的培养液中增加胚胎的数量时会使促进生长因子的浓度增加,作用更强[9]。当然,过多的胚胎在太少量的培养液中培养也是有害的,会产生更多的氨和氧自由基物质,最佳的范围应该是每个胚胎0.5 ~2 μL[10,11]。而一个动态的微观培养体系可以及时地将有害物质排出去。微流控芯片胚胎体外培养装置可以满足早期胚胎体外发育的微环境的要求。由表1 还可观察出,CZB +谷胱甘肽组和微流芯组在2 细胞期前胚胎发育率差异不显著,但从8-细胞期开始微流芯片组胚胎发育率较高。分析原因应该是微流芯片组施加了适当的机械刺激,促进了胚胎的发育。从表2可以看出,微流控芯片组显著提高小鼠囊胚总细胞数,这可能是利用微流控芯片培养装置进行胚胎体外培养过程中施加一定的物理性刺激有利于胚胎细胞的分裂和生长。同时,也促进各胚胎发育过程中产生的有益生长因子的扩散,彼此之间促进生长。
通过实验可知,利用PDMS 生物相容性好、透明度高、无毒性的材料制作胚胎体外培养装置模拟输卵管结构,微流控芯片胚胎体外培养装置可以满足小鼠早期胚胎体外发育的微环境的要求,也能对胚胎施加适当的机械性刺激,在体外模拟输卵管是可行的。
4 结论
本实验中PDMS 一次铸造成型芯片操作简单,且不易出现培养液外漏的现象。所以PDMS 一次性铸造成型的微流控芯片胚胎培养装置是可行的。应用一次性铸型的微流控芯片胚胎培养装置进行小鼠早期胚胎体外培养,显著提高了小鼠体外囊胚发育率。
[1]马学海,张居农.牛体外受精胚胎的体外培养研究进展[J].中国奶牛,2007,1: 29-31.
[2]周艳华,苏雷.奶水牛卵胞质内单精子注射(ICSI)胚胎体外发育潜能的研究.中国奶牛,2008,10:31-35.
[3]Yi CQ,Li CW,Ji SL,et al.Microfluidics technology for manipulation and analysis of biological cells.2006,560(1-2) : 1-23.
[4]Viravaidya K,Shuler ML.Incorporation of 3T3- L1 cells to mimic bioaccumulation in a microscale cell culture analog device for toxicity studies.Biotechnology Progress,2004,20(2) : 590-597.
[5]Satoshi AKAGI,et al.Culture of bovine embryos on a polydimethylsiloxane (PDMS) microwell plate.Jounal of reproduction and development 2010,56: 475-479.
[6]Koji Matsuura,Keiji Naruse,et al.Improved development of mouse and human embryos using a tilting embryo culture system.Reproductive BioMedicine Online.2010,20(3) : 358-364.
[7]Chae Yun Bae,Minseok S.Kim,et al.Mechanical stimulation of bovine embryos in a microfluidic culture platform.Bihip J.(2011) 5(2) : 106-113.
[8]方南洙,李钟淑,金一,等.活性氧对哺乳动物早期胚胎发育的影响[J].中国畜牧杂志,2005,41(7)36-37.
[9]Lane M,Gardn er DK.Effect of incubation volume and embryo density on the development and viability of mouse embryos in vitro [J].Hum Reprod,1992,7(4) :558- 562.
[10]Paria BC,Dey SK.Preimplantation embryo development in vitro: cooperat iveinteractions among embryos and role of growth factors.Pr Natl Acad Sci USA,1990,87(12) : 4756-4760.
[11]Gil MA,Ab eydeera LR,Day BN,et al.Effect of the volume of medium and number of oytes during in vitro fertilization on embryo development in pigs [J].Theriogenology,2003,60: 767-776.
