香椿离体快速繁殖研究
2014-04-14马宗新兰伟金继良李素梅
马宗新,兰伟,金继良,李素梅
(1.阜阳市农业科学院,安徽阜阳 236065;2.阜阳师范学院生命科学学院;3.阜阳市林业局)
香椿离体快速繁殖研究
马宗新1,兰伟2,金继良3,李素梅1
(1.阜阳市农业科学院,安徽阜阳 236065;2.阜阳师范学院生命科学学院;3.阜阳市林业局)
本文以太和县香椿品种黑油椿为试材进行香椿离体快速繁殖研究,结果表明:茎尖最佳诱导培养基为MS+ BA3.5 mg/L+NAA0.15 mg/L+GA30.1 mg/L;增殖培养基为MS+BA1.5 mg/L+NAA0.08 mg/L+GA30.01 mg/L;生根培养基为MS+IBA0.1 mg/L。初代接种时添加VC300 mg/L,PVP400 mg/L,可以减弱初代接种褐变率,提高接种成活率。
太和县;香椿;组织培养;快速繁殖
香椿(Toonasinensis)属楝科多年生落叶乔木,既可作速生珍贵木材,又是上等的木本蔬菜[1-2]。香椿芽可供鲜食或作为加工原料,鲜食味美可口,香椿芽内含丰富的维生素及香椿油,具有生津解渴的药用价值。因此,香椿在我国作为一种木本经济作物被大面积栽培[3]。
我国香椿品种很多,尤以安徽省太和县的黑油椿及红油椿最负盛名,品质最佳[4-5]。在传统栽培方法中香椿主要以种子繁殖和分株繁殖,由于香椿的种子常因感病而降低萌发率,通常新鲜香椿种子发芽率为60%~80%,存活率仅7~8个月,极易丧失活性[6];分株繁殖效率很低;由于资源有限,通过扦插、埋根等方法繁殖系数较低、周期长[6-7],很难满足生产上的需要,其规模发展因而受到限制。为此笔者研究利用组培方法来提高繁育系数,探索出了一套最佳组培快繁与移植技术。
1 材料与方法
1.1 试验材料及处理
供试材料为太和黑油椿,剪取20 cm长的休眠枝条假植温室,进行催芽,待芽长到5 cm时,剪取顶芽、侧芽分别用0.1%升汞(HgCl2)、0.4%次氯酸钠(NaCLO)进行消毒实验,按照8、10、15 min不同时间处理,分别记录消毒时间和消毒剂处理。然后用无菌水浸泡清洗5次,反复冲洗干净后挑取0.5 mm大小茎尖,接种于诱导培养基中:琼脂6.5 g/L,pH5.8,培养温度25℃,光照度2 000 lx,光照时数14 h/d。经过25~28 d的分化培养,茎尖逐渐长大,茎尖基部略带愈伤组织,此时可以转入增殖培养基进一步培养。
1.2 增殖培养基的确定
以GA3、BA、NAA为三个因素进行试验。选用由茎尖培养生长一致的无菌苗在4种培养基上继代培养,每种处理接种20个,每瓶2个,重复3次。30 d后统计其生长情况。
1.3 不同抗氧化剂对初代接种材料褐化及生长的影响
选取黑油椿嫩头,去除大叶,剥取1.0 cm大小茎尖,分别放置在添加了VC、PVP、柠檬酸、硫代硫酸钠(Na2S2O3)的培养基中,基本培养基为MS+ BA3.5 mg/L+NAA0.15 mg/L+GA30.1 mg/L,以空白做对照。观察抗氧化剂对褐变和生长的影响。
1.4 生根实验
以不同基本培养基为因素进行试验,选取高3 cm、长势好的无菌苗,接种在3种生根培养基上,每一处理接种10瓶,每瓶接种3个,重复2次。一个月后,统计生根率和其他指标。
1.5 移栽炼苗
选取至少长有2条2.0 cm以上不定根的试管苗,移出培养室,在自然光下,先不开盖炼苗3 d,再打开瓶盖炼苗2 d,然后移栽到灭菌基质上。基质分别为:河沙、蛭石、珍珠岩。每隔10 d观察移栽苗生长情况,30 d后统计成活率。
2 结果与分析
2.1 茎尖分化
在初代外植体消毒时间上,升汞的效果最好,0.1%升汞10 min,即可达到好的消毒效果,又降低了污染率。次氯酸钠消毒效果不好,外植体接种24 h后,就发黑、组织受到严重损伤。次氯酸钠容易杀伤组织,造成组织褐变死亡,并且污染率较高(见表1)。

表1 不同消毒剂处理对茎尖生长的影响
将显微镜下剥取的茎尖接种在诱导培养基上,10 d后芽开始萌发,发绿,15 d后茎尖基部开始长少量愈伤组织,叶片开始长大,逐渐形成丛生芽。一般一个茎尖分化出5~6个芽。在诱导分化上顶芽比侧芽既快又好,具体见表2。

表2 不同处理下的茎尖诱导结果
2.2 丛生芽增殖培养基的筛选
由表3可见,增殖培养过程中,BA与NAA配合可以有效促进芽丛的增殖,以处理3培养效果最好,愈伤组织最少,芽数多,长势较好。

表3 BA与NAA最佳浓度的确定
将长大的茎尖转入增殖培养基中,进行增殖培养,通过20 d的增殖培养,茎尖逐渐分化成丛生芽,每个茎尖又可以再分化出2~3个小芽,此时可进行继代繁殖,将芽丛从基部切开,重新接种到继代增殖培养基中。经过一个周期后,又形成2~3个小芽丛。如此反复进行,芽丛逐渐增多,繁殖体系基本建立起来。
2.3 茎段组培快繁
在培养芽丛的过程中,有的芽丛逐渐脱离丛生状态,转向高生长,如果延长培养时间,不转接,少量可以形成根系,此时应将此苗分离出来,单独生根,切段繁殖培养。将高4 cm以上的小苗,剪切成单茎节茎段,转入切段繁殖培养基中进行培养。25 d后,又萌发成一株小苗。这样反复进行,可以获得大量的小苗。香椿分枝性差,特别是一年生的幼苗,只有一个主茎没有侧枝发育。通过摘心抑制顶端优势,促进侧芽发育,对于香椿分枝有一定的促进作用,通过摘心处理使主茎数增加了5%左右,芽数平均增加到5~6个芽。
2.4 不同抗氧化剂对褐变的抑制作用
VC、柠檬酸、PVP、Na2S2O3都有一定程度抑制褐变效果,但以VC和PVP效果最好。在培养基中添加PVP400 mg/L、VC300 mg/L可以有效解决初代接种的褐变问题。培养结果表明,PVP、VC褐化率最小,褐斑最小,具体见表4。

表4 不同抗氧化剂对茎尖培养的效果
2.5 生根培养
选取生长势强、健壮的无菌芽苗切成含有一个节间、长1.0 cm小段转入生根培养基中,25 d左右,有95%以上的植株长出3 cm长的根,展开叶5片,待苗长至35 d时,即可炼苗移栽。在生根阶段,笔者发现,香椿试管苗大致分为三种生根类型:易根型材料10 d生根;中间型45 d生根;难生根型材料,长久不形成根。从太和香椿180份材料中选出易根型的材料36份,观察表明,在生根过程中,茎的生长并不显著,这是由于在生根培养基中,根系的吸收主要供自身生长。
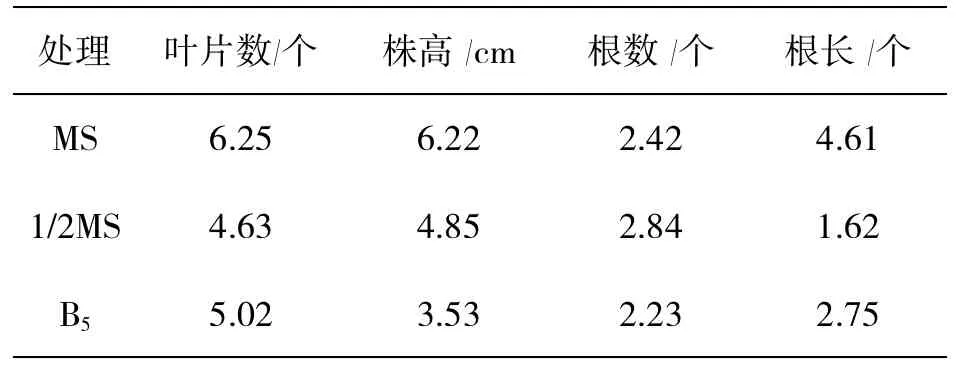
表5 不同基本培养基的生根效果
从表5可见,降低无机盐含量可以促进生根,1/2MS较MS有较多的根发生,但是苗的生长需要较多无机盐,长苗以MS较好。B5培养基培养对生根及长苗均不及MS培养基。
2.6 炼苗移栽
香椿组培苗在长出根以后,就可以出瓶炼苗,待苗高5~7 cm时较易成活。练苗前首先揭开培养瓶的封口膜,然后小心取出小苗,用自来水冲洗净苗基部的培养基,然后移栽到已灭过菌的基质中,前期适当遮阴并保持湿度在85%~95%,逐步降至70%,15 d后去掉薄膜,定期用75%百菌清喷洒杀菌,每7 d一次,成活率在95%以上。冬季炼苗时,为防止休眠,除提高培养温度外,需要在叶片上喷洒GA320 mg/kg 1~2次。

表6 不同基质对移栽成活率的影响
由表6可见,不同基质的移栽成活率不同,蛭石成活率最高。珍珠岩移栽后初期较好,后期苗容易发黄,可能与珍珠岩的碱性较大,缺乏营养元素有关。
3 结论
笔者通过采用黑油椿茎尖组织培养技术可以批量获得优质种苗。利用香椿的茎尖进行组织培养改变了用种子繁殖后代出现严重分化现象,保持了原品种的优良性,确保了种苗纯度。
在初代接种上采用添加抗氧化剂和及时转接解决了褐变问题。茎段快繁中通过摘心可以刺激侧芽萌发,去除顶端优势,解决了香椿初代接种时,污染率高、褐变严重的问题。试管中加入GA(赤霉素)可以幼化试管苗,不使试管苗木质化,可以获得高增殖率的芽丛,便于增殖。
[1]张晓申,邢廷茂,王慧瑜,李晓青,赵海红.香椿组织培养与快速繁殖技术的研究[J].江西农业学报,2011,10: 58-59,62.
[2]周玉玲,余慧琳,刘广卿,李艳萍,张福娟,姜曙光,孙凤岭.红香椿组织培养和快速繁殖研究[J].中国农学通报,2009,10:116-119.
[3]陈实,王小平.香椿种子组织培养研究[J].农技服务,2010,09:1151-1152.
[4]许丽琼,涂炳坤.香椿叶片组织培养和快繁技术的研究[J].湖北农业科学,2007,01:24-26.
[5]韦龙宾.香椿的繁殖与栽培技术[J].中国林副特产,2007,05:47-49.
[6]许丽琼,涂炳坤.香椿茎段组织培养和再生技术研究[J].华中农业大学学报,2007,05:697-700.
[7]吴丽君.香椿组培快繁效率的影响因子[J].中南林学院学报,2005,02:25-29.
(责任编辑:杨婷婷)
Study on Isolated Rapid Propagation of Toona sinensis
MA Zongxin1,LAN Wei2,JIN Jiliang3,LI Sumei1
(1.Fuyang Academy of Agricultural Sciences,Fuyang 236065,Anhui,China;2.College of Life Sciences,Fuyang Normal University;3.Fuyang Municipal Station for Forestry Science&Technology Promotion)
In this paper,the variety Black-oil Toon of Toona sinensis in Taihe County was used as the test material for study on isolated rapid propagation of Toona sinensis.The results showed that the best medium for stem tip induction culture was MS+BA3.5 mg/L+NAA0.15 mg/L+GA30.1 mg/L,the best multiplication medium was MS+BA1.5 mg/L+NAA0.08 mg/L+ GA30.01mg/L andthebestrootingmediumwasMS+IBA0.1mg/L.Additionof VC300mg/LandPVP400mg/Lininitial inoculation could reduce the browning rate and improve the inoculation survival rate.
Taihe County;Toona sinensis,Tissue culture;Rapid propagation
S644.4
:A
:2095-0152(2014)01-0019-03
2013-12-21
2014-01-06
安徽省花木科技专家大院项目(科农(2012)82号);2013年阜阳市科技计划项目(阜科[2013]70号)。
马宗新(1975-),男,高级农艺师,主要从事园艺作物生物技术等方面研究。E-mail:ahfyygp@163.com
