黄芪甲苷抑制糖尿病大鼠足细胞凋亡的作用和机制研究
2014-04-13陈宜方陈建国王虹郑志贵崔晓萌何东元
陈宜方 陈建国 王虹 郑志贵 崔晓萌 何东元
●论 著
黄芪甲苷抑制糖尿病大鼠足细胞凋亡的作用和机制研究
陈宜方 陈建国 王虹 郑志贵 崔晓萌 何东元
目的 探讨黄芪甲苷(AS-IV)抑制糖尿病大鼠足细胞凋亡的作用及其机制,为糖尿病肾病的治疗开辟新途径。方法将体重180~220g健康雄性SD大鼠按配伍法分为正常对照组、糖尿病组和糖尿病AS-IV治疗组,每组10只,链脲霉素(STZ)腹腔注射法建立糖尿病大鼠模型,糖尿病AS-IV治疗组予AS-IV 10mg/(kg·d)治疗,共8周;糖尿病组予等量1%CMC混悬液;正常对照组不予处理。第8周末测量大鼠体重、24h尿白蛋白、血糖、糖化血红蛋白(HbA1c)、ALT、血尿素氮、肌酐水平;PAS、Masson染色,光镜观察肾脏病理变化;肾母细胞瘤基因1(WT-1)免疫组织化学染色观察肾小球足细胞密度变化,TUNEL染色观察足细胞凋亡,real-time PCR及Western blot测大鼠肾皮质凋亡相关蛋白Bcl-2、Bax及其mRNA表达的变化。结果 与正常对照组相比,糖尿病组大鼠血糖、HbA1c和24h尿白蛋白增高,肾小球足细胞数量减少,系膜增生,足细胞凋亡增加,Bcl-2及其mRNA表达下调,Bax及其mRNA表达上调,差异均有统计学意义(均P<0.05)。AS-IV可显著改善糖尿病大鼠蛋白尿,抑制肾小球足细胞数目减少、系膜区增生、足细胞凋亡,上调Bcl-2表达,抑制Bax表达。结论 AS-IV对早期糖尿病大鼠足细胞具有保护作用,可能与其调节凋亡蛋白Bcl-2和Bax,抑制足细胞凋亡相关。
黄芪甲苷 糖尿病肾病 足细胞 凋亡
糖尿病肾病是糖尿病微血管并发症,是糖尿病患者死亡的重要原因之一。在欧美等发达国家和我国沿海发达城市,糖尿病肾病已经成为慢性肾脏疾病的首要病因[1]。足细胞和肾小球基底膜、毛细血管内皮细胞共同组成肾脏滤过屏障,足细胞功能障碍和(或)数量减少直接导致蛋白尿的产生[2]。既往研究显示,足细胞凋亡在糖尿病肾病的发生、发展过程中起重要作用,但目前尚无针对足细胞凋亡的特异性药物[3]。黄芪是祖国中医治疗肾脏疾病的传统中药之一,黄芪甲苷(AS-IV)是黄芪主要活性成分之一。前期研究显示,AS-IV可抑制高糖诱导的足细胞凋亡[4],现进一步探索AS-IV能否抑制糖尿病大鼠足细胞凋亡并探索相关机制,旨在为糖尿病肾病的治疗提供新的思路,现报道如下。
1 材料和方法
1.1 材料 链脲霉素(STZ)、AS-IV单体(TLC纯度达98%)、羧甲基纤维素(美国Sigma公司),Trizol试剂、逆转录试剂盒SuperScript RT kit Total(美国Invitrogen公司),兔源性抗肾母细胞瘤基因1(WT-1)(一抗)、抗Bcl-2、抗Bax、抗β-actin抗体、辣根过氧化物酶标记的山羊抗兔(二抗)、ECL化学发光剂(美国Santa Cruz公司),TUNEL染色试剂盒(美国Roche公司),Triton X-100裂解缓冲液、BCA蛋白检测试剂盒(中国上海联硕生物科技有限公司);便携式血糖仪(美国Roche公司),自动生化分析仪(美国Technicon公司),免疫发光分析仪(美国雅培公司),Bio-Rad2000凝胶成像系统(美国Bio-Rad公司),Rotor-Gene3000 PCR仪(澳大利亚Corbett Research公司)。
1.2 糖尿病模型的建立及处理 体重180~220g健康雄性SD大鼠30只(浙江大学动物实验中心)按照配伍法分为正常对照组、糖尿病组和糖尿病AS-IV治疗组,每组10只。STZ溶于0.1mol/L柠檬酸冲液(pH 4.2)中,65mg/kg一次性腹腔注射法建立糖尿病模型。STZ注射后72h断尾采血,空腹血糖>16.7mmol/L认为糖尿病造模成功。AS-IV溶于1%羧甲基纤维素(CMC)中。糖尿病AS-IV治疗组大鼠在造模成功后予AS-IV 10mg/(kg· d)灌胃,共8周。糖尿病组给予等量1%CMC混悬液。正常对照组不予处理。第8周末收集各组大鼠24h尿液,免疫比浊法测尿白蛋白。测量大鼠体重,戊巴比妥纳麻醉后心脏取血,用于生化指标检测。留取双侧肾脏,用于光镜病理、免疫组化、Western blot及real-time PCR检测,多余组织液氮速冻后-80℃保存。
1.3 生化项目检查 便携式血糖仪检测血糖,化学发光法测血糖化血红蛋白(HbA1c),自动生化分析仪检测ALT、肌酐、尿素氮。
1.4 病理检查 肾组织以4%中性甲醛固定,常规石蜡包埋、切片,分别行PAS和Masson染色,光镜下观察肾组织形态学变化。每张肾脏切片随机观察20个视野。PAS染色观察肾小球系膜增生,用图像分析软件Image-Pro Plus 6.0[5]对肾小球系膜区进行吸光度扫描,计算每个肾小球系膜区与肾小球总面积,以系膜区总面积/肾小球总面积半定量表示系膜增生情况。Masson染色观察间质纤维化,半定量评分标准如下:0,无纤维化;1,纤维化面积<10%;2,纤维化面积10%~25%;3,纤维化面积25%~50%;4,纤维化面积>50%[6]。
1.5 肾小球足细胞密度检测 免疫组化检测足细胞特异抗原WT-1。加入一抗,二氨基联苯胺显色,WT-1阳性的足细胞染成棕色。平均每只大鼠观察20个肾小球,图像分析软件为Image pro plus 6.0,WT-1阳性面积/肾小球面积代表足细胞密度,计算均值和标准差。
1.6 足细胞凋亡检测 根据说明书采用TUNEL染色试剂盒染色大鼠肾组织石蜡切片,凋亡细胞染成棕色。位于肾小球基底膜外侧的阳性细胞为凋亡足细胞。平均每只大鼠观察5个400倍视野,统计凋亡足细胞,计算均值和标准差。
1.7 Western blotTriton X-100裂解缓冲液溶解肾组织并在冰浴中充分匀浆。BCA蛋白检测试剂盒检测肾组织蛋白浓度。SDS-PAGE凝胶电泳分离样品,100V电转膜至PVDF膜。含 2%牛血清白蛋白的TBST(20mmol/L Tris-HCl,150mmol/L NaCl,0.1%Tween 20)室温孵育60min封闭非特异性位点,抗Bax、Bcl-2、βactin抗体4℃孵育24h,加入二抗室温孵育60min,ECL液显色检测蛋白信号,Bio-Rad2000凝胶成像系统扫描蛋白条带的光密度。实验重复3次,计算均值和标准差。
1.8 real-time PCR检测 Trizol法提取肾组织总RNA。根据说明书采用逆转录试剂盒SuperScript RT kit Total合成cDNA。Bcl-2引物上游序列为5'GGGATGCCTTTGTGGAACTATATG3',下游序列为5'CAGCCAGGAGAAATCAAACAGA3'。Bax引物上游序列为5'AGACACCTGAGCTGACCTTGGA3',下游序列为5'CGCTCAGCTTCTTGGTGGAT3';GAPDH为内参,上游序列为5'TCCCTCAACATTGTCAGCAA3',下游序列为 5'AGCTCCACAACGGATACATT3'。采用Rotor-Gene3000 PCR仪进行real-time PCR检测。反应条件为94℃预变性5min,95℃变性10s,59℃退火15s,72℃延伸20s,扩增40个循环最后72℃延伸5min。荧光定量分析软件读取并计算目标mRNA/GAPDH mRNA的比值。实验重复3次,计算均值和标准差。
1.9 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,组间比较采用单因素方差分析。
2 结果
2.1 各组大鼠8周末24h尿白蛋白水平的比较 正常对照组8周末24h尿白蛋白水平为(308.60±41.23)mg,糖尿病组为(3 203.78±492.14)mg,糖尿病AS-IV治疗组为(2 080.52±412.31)mg。与正常对照组相比,糖尿病组、糖尿病AS-IV治疗组大鼠尿白蛋白水平均显著增加,差异均有统计学意义;糖尿病AS-IV治疗组大鼠尿白蛋白水平低于糖尿病组,可见AS-IV能显著降低糖尿病大鼠尿白蛋白水平。
2.2 各组大鼠肾组织光镜及半定量分析结果的比较光镜病理示糖尿病大鼠肾小球系膜增生,部分肾小管间质纤维化,AS-IV治疗后可显著缓解糖尿病大鼠肾脏系膜增生和间质纤维化;与正常对照组比较,糖尿病组、糖尿病AS-IV治疗组的系膜增生比例、间质纤维化指数均明显增高,差异均有统计学意义;AS-IV治疗后系膜增生比例、间质纤维化指数明显低于糖尿病组,差异有统计学意义,详见图1(见插页)、表1。

表1 各组大鼠肾组织系膜增生比例和间质纤维化指数比较
2.3 各组大鼠肾组织WT-1免疫组化染色及足细胞密度半定量分结果析的比较 WT-1免疫组织化学染色结果显示,AS-IV可抑制糖尿病大鼠肾脏足细胞减少;半定量分析结果显示,正常对照组足细胞密度为4.13×10-4±7.62×10-5,糖尿病组为8.67×10-5±1.64×10-5,糖尿病AS-IV治疗组为2.48×10-4±7.29×10-5,糖尿病大鼠肾脏足细胞密度较正常对照组显著降低,而糖尿病AS-IV治疗组足细胞密度高于糖尿病组,差异均有统计学意义,详见图2(见插页)。
2.4 各组大鼠肾脏TUNEL染色和凋亡足细胞半定量分析 TUNEL染色结果显示,AS-IV可抑制糖尿病大鼠足细胞凋亡;半定量分析结果显示,正常对照组凋亡足细胞(0.867±0.571)个,糖尿病组为(7.933±1.388)个,糖尿病AS-IV治疗组为(6.033±1.326)个。糖尿病大鼠足细胞凋亡较正常对照组显著增加,而AS-IV治疗后凋亡足细胞数明显减少,差异均有统计学意义,详见图3(见插页)。

图1 各组大鼠肾组织光镜结果(肾组织PAS和Masson染色,×200)
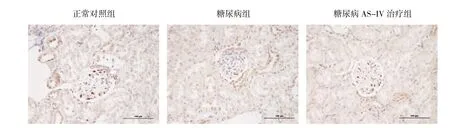
图2 各组大鼠肾组织WT-1免疫组化染色结果(棕色为WT-1阳性足细胞;×200)
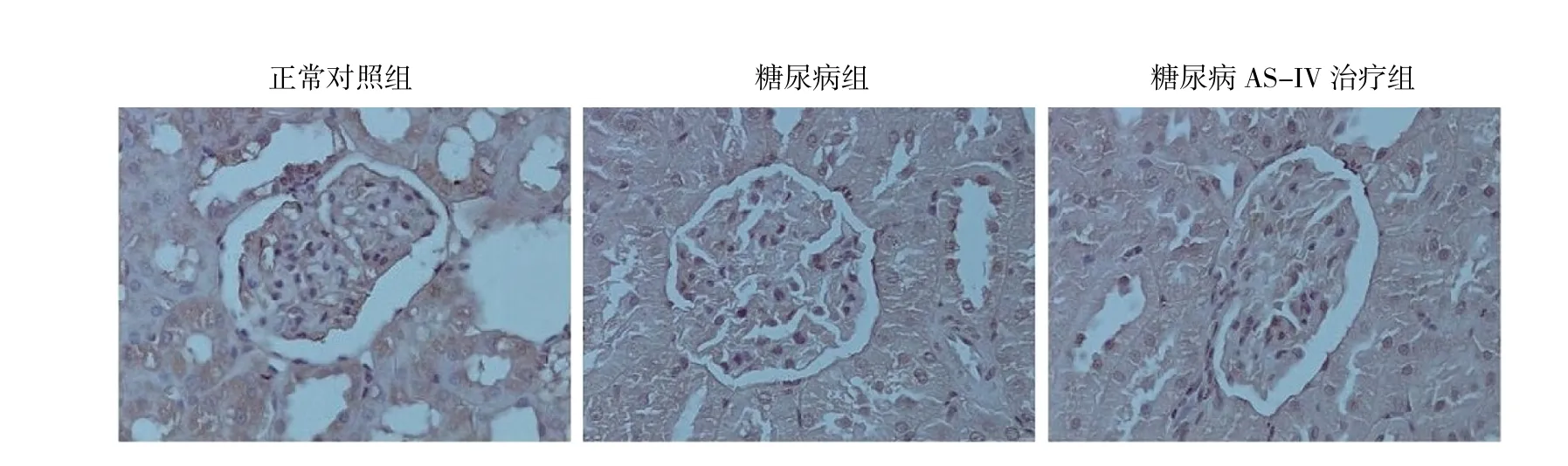
图3 各组大鼠肾脏TUNEL染色结果(位于肾小球基底膜外侧的棕色细胞为凋亡的足细胞;×400)
2.5 各组大鼠肾组织Bax、Bcl-2及其mRNA表达的比较 和正常对照组相比,糖尿病大鼠Bcl-2 mRNA表达降低,Bax mRNA表达增加;AS-IV可部分恢复Bcl-2 mRNA的表达,抑制Bax mRNA表达增加,差异均有统计学意义。Western blot检测显示,各组大鼠肾脏Bcl-2、Bax变化趋势和mRNA表达一致。和正常对照组相比,糖尿病大鼠Bcl-2表达降低,而Bax表达增加,AS-IV治疗可抑制Bax的升高和Bcl-2的降低,详见图4、表2。
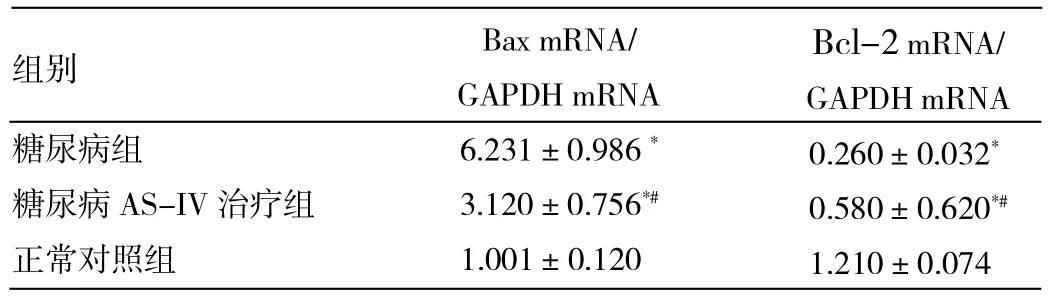
表2 各组大鼠肾组织Bax、Bcl-2 mRNA表达
2.6 各组大鼠8周末体重和生化指标的比较 与正常对照组大鼠相比,糖尿病组大鼠体重明显降低,血糖、HbA1c明显升高,差异均有统计学意义,ALT、尿素氮、肌酐虽有升高,但差异均无统计学意义。AS-IV治疗对血糖、HbA1c、尿素氮、肌酐无显著影响,详见表3。

表3 各组大鼠8周末体重和生化指标的比较
3 讨论
目前糖尿病肾病已经成为终末期肾衰竭的首要病因,其早期表现为微量白蛋白尿,晚期有肾小球滤过率(GFR)的下降以及心血管并发症[7]。糖尿病肾病的主要病理改变有:肾小球基底膜增厚、系膜区扩张、系膜细胞增生、基质增多等。本研究通过STZ腹腔注射法建立糖尿病大鼠模型。糖尿病大鼠血糖、HbA1c和24h尿白蛋白水平显著高于正常对照组,8周末血尿素氮、肌酐也显著升高,光镜病理显示肾脏系膜增生和间质纤维化,说明AS-IV治疗可改善糖尿病大鼠蛋白尿以及肾组织病理学。
足细胞是肾小球滤过屏障的最外层,是高度分化的特异细胞,几乎没有增殖能力。足细胞数目减少直接导致蛋白尿的发生[8-9]。Siu等[10]研究发现糖尿病大鼠足细胞数量和密度从2周起就出现减少,且随着病程的延长而加剧。Steffes等[11]研究发现1型糖尿病患者足细胞数量减少与年龄、病程长短无明显相关。因此,抑制足细胞减少应成为糖尿病肾病的治疗靶点。

图4 各组大鼠肾组织Bax、Bcl-2及其mRNA表达和半定量分析(A:Bax、Bcl-2光密度图;B:Bax表达半定量分析;C:Bcl-2表达半定量分析;与正常对照组比较,*P<0.05;与糖尿病组比较,#P<0.05)
WT-1为足细胞特异性蛋白,与肾脏发育密切相关,出生后仅在于成熟足细胞表达,对足细胞功能的维持起重要作用[12]。本研究中采用WT-1免疫组化染色标记足细胞,并通过图像分析软件对足细胞密度进行半定量分析,结果表明糖尿病大鼠足细胞密度较正常对照组显著降低,而AS-IV治疗可缓解足细胞密度下降。
凋亡是糖尿病肾病足细胞减少的重要原因[13],这一过程伴随着抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的表达变化[14]。高糖的渗透作用不是糖尿病足细胞凋亡的原因,相同渗透浓度的D-甘露醇并不能诱导足细胞凋亡[4]。为探索AS-IV的缓解足细胞丢失的相关机制,笔者观察了足细胞凋亡和Bax、Bcl-2 mRNA的表达变化。Bax介导TGF-β1诱导的足细胞凋亡[7]。在人类IgA肾病中,足细胞Bcl-2表达下降与肾小球进行性损伤及预后不良相关[15]。本研究结果显示糖尿病大鼠足细胞凋亡增加,肾皮质Bax及其mRNA表达增加,Bcl-2及其mRNA表达降低。AS-IV可抑制糖尿病大鼠肾脏足细胞凋亡,抑制Bax、Bcl-2及其mRNA的表达变化,提示可能ASIV通过调节Bax和Bcl-2,抑制足细胞凋亡,抑制足细胞数量的减少。
最后,笔者研究了各组大鼠体重和生化指标的变化。糖尿病AS-IV治疗组和糖尿病组大鼠的血糖、HbA1c、ALT、血肌酐和尿素氮差异均无统计学意义,提示AS-IV抗足细胞凋亡和降低蛋白尿的作用和血糖调控无关,且无明显肝肾毒副反应,表明AS-IV可能成为一种安全有效的药物用于治疗糖尿病肾病。
综上所述,AS-IV可通过调节Bax、Bcl-2的表达,抑制足细胞凋亡,减少蛋白尿,缓解糖尿病肾病,该研究结果对开发直接针对肾小球足细胞的肾脏保护药物提供了实验基础。
[1]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].The Lancet,2012, 379(9818):815-822.
[2]Mundel P,Shankland S J.Podocyte biology and response to injury[J].Journal of the American Society of Nephrology,2002,13 (12):3005-3015.
[3]Marshall S M.The podocyte:a potential therapeutic target in diabetic nephropathy[J]?Current pharmaceutical design,2007, 13(26):2713-2720.
[4]Gui D,Guo Y,Wang F,et al.Astragaloside IV,a novel antioxidant,prevents glucose-induced podocyte apoptosis in vitro and in vivo[J].PloS one,2012,7(6):e39824.
[5]So B I,Song Y S,Fang C H,et al.G-CSF prevents progression of diabetic nephropathy in rat[J].PloS one,2013,8(10):e77048.[6]Fujihara C K,Noronha I D L,Malheiros D M A C,et al.Combined mycophenolate mofetil and losartan therapy arrests established injury in the remnant kidney[J].Journal of the American Society of Nephrology,2000,11(2):283-290.
[7]Parving H H.Diabetic nephropathy:prevention and treatment[J].Kidney international,2001,60(5):2041-2055.
[8]Kim Y H,Goyal M,Kurnit D,et al.Podocyte depletion and glomerulosclerosis have a direct relationship in the PAN-treated rat[J].Kidney international,2001,60(3):957-968.
[9]Shankland S J.The podocyte's response to injury:role in proteinuria and glomerulosclerosis[J].Kidney International,2006,69 (12):2131-2147.
[10]Siu B,Saha J,Smoyer W E,et al.Reduction in podocyte density as a pathologic feature in early diabetic nephropathy in rodents:prevention by lipoic acid treatment[J].BMC Nephrology, 2006,7(1):6.
[11]Steffes M W,Schmidt D,Mccrery R,et al.Glomerular cellnumber in normal subjects and in type 1 diabetic patients[J].Kidney international,2001,59(6):2104-2113.
[12]Michaud J,Kennedy C.The podocyte in health and disease: insightsfromthemouse[J].Clinicalscience,2007,112:325-335.
[13]Xu J,Li Z,Xu P,et al.Protective effects of leukemia inhibitory factor against oxidative stress during high glucose-induced apoptosis in podocytes[J].Cell Stress and Chaperones,2012, 17(4):485-493.
[14]Schiffer M,Bitzer M,Roberts I S D,et al.Apoptosis in podocytes induced by TGF-β and Smad7[J].The Journal of clinical Investigation,2001,108(108(6)):807-816.
[15]Qiu L Q,Sinniah R,Stephen I,et al.Downregulation of Bcl-2 by podocytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy[J].Journal of the American Society of Nephrology, 2004,15(1):79-90.
Inhibitory effects of astragaloside IV on apoptosis of podocytes and its mechanism in diabetic rats
Objective To investigate the effects of astragaloside IV(AS-IV)on apoptosis of podocytes and its mechanism in diabetic rats.Methods Male SD rats were randomly divided into normal control group,diabetes group and diabetes with AS-IV treatment group with 10 in each group.Diabetes was induced by STZ intraperitoneal injection in rats.Rats in treatment group were given AS-IV 10mg/kg/d for 8 weeks.At the end of the 8th week,24h microalbumin,body weight,blood glucose, blood glycated hemoglobin A1c,alanine aminotransferase,blood urea nitrogen and creatinine were measured;renal pathological changes were evaluated by light microscopy with PAS and Masson staining;glomerular podocyte density was examined by WT-1 immunohistochemical staining;podocyte apoptosis was detected by TUNEL;the mRNA and protein expression of Bax and Bcl-2,apoptosis-related proteins in rat renal cortex were determined by Western blot and real time-PCR. Results Hyperglycemia,increased 24h microalbumin,mesangial expansion,interstitial fibrosis,podocyte loss and podocyte apoptosis,increased mRNA and protein expression of Bax and decreased mRNA and protein expression of Bcl-2 were detected in diabetic rats.AS-IV treatment inhibited podocyte apoptosis,ameliorated podocyte loss and renal histopathology,decreased microalbumin,partially restored mRNA and protein expression of Bax and Bcl-2.Conclusion AS-IV may inhibit podocyte apoptosis and ameliorate diabetic nephropathy by inhibiting the expression of Bax and restoring the expression of Bcl-2 in diabetic rats.
Astragaloside IV Diabetic nephropathy Podocyte Apoptosis
2014-07-03)
(本文编辑:严玮雯)
浙江省自然科学基金项目(LY12H05001)
310013 杭州,浙江医院肾内科
何东元,E-mail:hdy331@qq.com
