趋化因子CCL22诱导肺癌细胞转移中ERK/p38MAPK蛋白的表达
2014-04-13管彩虹楼雅芳赵凯朱黎红吴清
管彩虹 楼雅芳 赵凯 朱黎红 吴清
趋化因子CCL22诱导肺癌细胞转移中ERK/p38MAPK蛋白的表达
管彩虹 楼雅芳 赵凯 朱黎红 吴清
目的 探讨趋化因子CCL22诱导肺癌细胞转移过程中ERK/p38MAPK蛋白的表达。方法 以100ng/ml的CCL22诱导肺癌细胞SBC-5后,采用细胞划痕试验和Transwell试验观察细胞迁移和侵袭能力的变化及加入蛋白激酶抑制剂U0126后细胞迁移和侵袭能力的变化。以Western blot法检测细胞中p-ERK和p-p38MAPK蛋白表达情况。结果 加入100ng/ml的CCL22后,对照组、CCL22组、混合组SBC-5细胞平均迁移距离分别为(112.6±27.2)、(351.9±16.4)、(145.1±29.6)μm,CCL22组细胞迁移距离明显大于对照组和混合组(均P<0.05)。对照组、CCL22组、混合组平均侵袭细胞数分别为(199.2±32.8)、(505.5±66.3)、(95.7±19.1)个,CCL22组显著高于对照组和混合组(均P<0.05),而混合组明显低于对照组(P<0.05)。100ng/ml的CCL22诱导后,p-ERK和p-p38MAPK蛋白表达增加,U0126可减低以上蛋白的表达(P<0.05)。结论 ERK/p38MAPK蛋白激酶参与了趋化因子CCL22诱导的肺癌细胞迁移和侵袭。
肺癌 趋化因子CCL22 细胞外信号调节激酶 p38丝裂原活化蛋白激酶 肿瘤转移
肺癌是人类最常见的恶性肿瘤,常发生骨、肝脏等远处转移,迄今为止其侵袭和转移的机制尚未完全明确。以往研究发现,分化的破骨细胞可产生趋化因子CCL22,其相应的受体为趋化因子受体4(CCR4)。CCL22能诱导表达CCR4的人肺癌细胞系SBC-5细胞发生迁移[1],同时研究也发现破骨细胞在分化与激活过程中还产生多种细胞因子,这些细胞因子与不同的调节蛋白结合后能激活多信号传导通路。而目前对于细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)通路是否参与肺癌转移,尚未见报道。本研究以SBC-5细胞为实验对象,观察CCL22诱导下肺癌细胞迁移和侵袭能力的变化,并检测细胞内ERK和p38MAPK蛋白表达的情况,进一步探讨ERK/p38MAPK信号通路在肺癌细胞迁移和侵袭中的作用。
1 材料和方法
1.1 主要材料和仪器 人肺癌细胞系SBC-5细胞购于广州吉妮欧生物科技有限公司。RPMI-1640培养基、蛋白激酶抑制剂U0126购于美国Sigma公司。化学发光试剂(ECL)Plus试剂盒、IP细胞裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白浓度测定试剂盒购于上海碧云天公司。ERK、p-ERK、p38MAPK、p-p38MAPK和GAPDH抗体购于美国Santa Cruz公司。ECLIPSE Ti-S型倒置相差显微镜为日本Nikon公司产品。
1.2 方法
1.2.1 细胞培养及分组 SBC-5细胞复苏后以含10% FBS的RPMI-1640培养基常规培养,并调整细胞状态。本研究预实验中采用不同浓度CCL22诱导SBC-5细胞,侵袭实验及Western blot均显示100ng/ml作用24h诱导效果最明显(本文中未显示相关结果),因此本研究CCL22浓度选择100ng/ml。设对照组、CCL22组(100ng/ ml)、混合组(100ng/ml CCL22+10μmol/L U0126),分别培养24h后进行检测。
1.2.2 划痕实验观察细胞迁移能力 取对数生长期细胞,以1×106/孔细胞接种于6孔板,待细胞贴壁后,同步化培养24h。用200μl移液器尖端垂直6孔板底部划线,以无血清RPMI-1640培养基漂洗两遍。各组细胞培养24h后,在倒置相差显微镜下选择背景最好的3个视野拍照(×100)。
1.2.3 Transwell试验观察细胞侵袭能力 取对数生长期细胞,同步化培养24h。以无血清RPMI-1640培养基稀释,取100μl稀释液加到24孔transwell上室,下室加入600μl各组培养基。每组加入相应药物,培养24h后用棉签擦去上室非侵袭细胞,移去transwell,予倒置风干,取4个视野(×100),染色、照相后计数穿膜细胞数。1.2.4 Western blot检测细胞中p-ERK和p-p38MAPK蛋白表达 收集各组细胞,提取蛋白质,分别加入1:500稀释的ERK、p-ERK、p38MAPK、p-p38MAPK和GAPDH抗体,4℃过夜后加入HRP标记的二抗,室温摇动2h。TBS-T漂洗,ECL显色。
1.3 统计学处理 采用SPSS 13.0统计软件,计量资料以表示,组间比较行多个样本均数比较的方差分析。
2 结果
2.1 CCL22对SBC-5细胞迁移能力的影响 100ng/ml的CCL22诱导后,对照组SBC-5细胞平均迁移距离(112.6±27.2)μm,CCL22组细胞平均迁移距离(351.9± 16.4)μm,混合组细胞平均迁移距离(145.1±29.6)μm。CCL22组细胞迁移距离明显大于对照组和混合组(均P<0.05),混合组和对照组相比无统计学差异(P>0.05),见图1。
2.2 CCL22对SBC-5细胞侵袭能力的影响 100ng/ml的CCL22诱导SBC-5细胞24h后,对照组平均穿膜细胞数(199.2±32.8)个,CCL22组平均穿膜细胞数(505.5±66.3)个,混合组平均穿膜细胞数(95.7±19.1)个。CCL22组显著高于对照组和混合组(均P<0.05),混合组明显低于对照组(P<0.05),见图2。
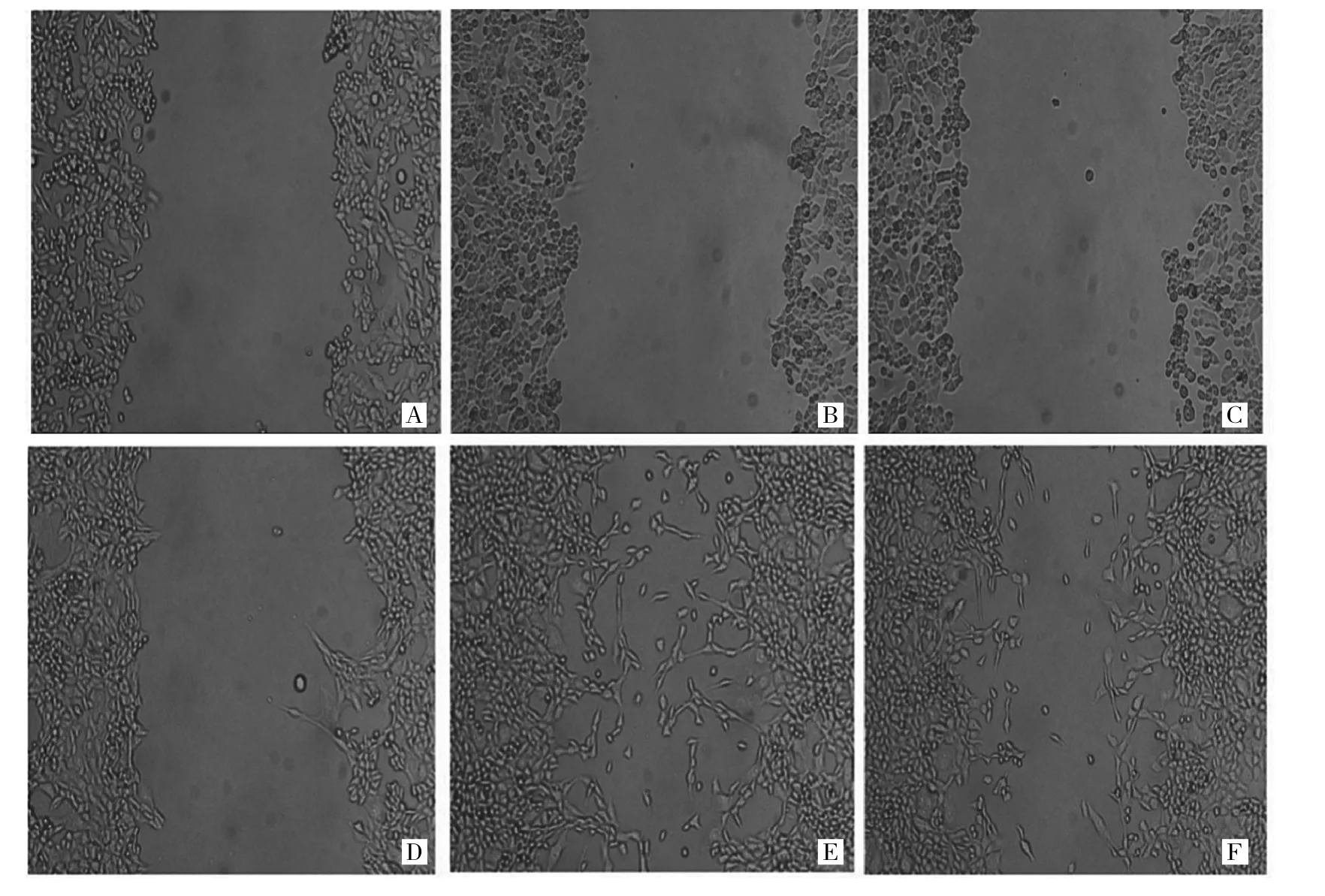
图1 培养24h后各组SBC-5细胞迁移能力的变化(A:对照组0h;B:CCL22组0h;C:混合组0h;D:对照组24h;E:CCL22组24h;F:混合组24h;×100)

图2 培养24h后各组SBC-5细胞侵袭能力的变化(A:对照组;B:CCL22组;C:混合组;HE染色,×100)
2.3 CCL22对SBC-5细胞p-ERK和p-p38MAPK蛋白表达的影响 100ng/ml的CCL22诱导12h和24h后,SBC-5细胞p-ERK和p-p38MAPK蛋白表达呈上升趋势,并呈时间依赖性,而U0126可显著性减低CCL22引起的蛋白表达增高(P<0.05),见图3。

图3 培养12h和24h后各组SBC-5细胞内p-ERK和p-p38 MAPK蛋白表达
3 讨论
在肿瘤细胞转移的过程中,靶器官的趋化作用至关重要。肿瘤的转移不是随机的,而是具有嗜器官性的,趋化因子在其中发挥着重要的作用。近年来的研究证实,靶器官产生的一些细胞因子,如白介素、细胞核因子κB配基受体激活剂、趋化因子等与肿瘤细胞表达的特异性受体结合,在肿瘤细胞的迁移侵袭过程中发挥着重要作用[2]。
趋化因子家族是一类由免疫或非免疫细胞分泌的一级结构相似的小分子蛋白,具有多种生物学活性。根据其氨基酸序列上前两个半胱氨酸相对位置不同可分为4类,CCL22就是其中一类,在人体中由位于16号染色体的CCL22基因编码,由树突状细胞和巨噬细胞分泌产生。Nakamura等[1]研究发现分化的破骨细胞也可以产生趋化因子CCL22,其相应的受体为CCR4。本实验发现用100ng/ml的CCL22处理肺癌SBC-5细胞24h后,细胞迁移和侵袭能力明显增加,说明趋化因子CCL22对肺癌细胞有明显的趋化作用,加入蛋白激酶抑制剂U0126后,肿瘤细胞的迁移和侵袭能力则明显减弱。
MAPK是细胞内广泛存在的丝/苏氨酸蛋白激酶超家族,是将细胞质的信号传递至细胞核并引起细胞核发生变化的重要物质。MAPK信号传导通路调节着机体细胞的生长、分化、分裂、死亡以及细胞间功能同步化。在目前人类鉴定的4条MAPK通路(ERK、JNK/SAPK、BMK和p38MAPK)中,ERK和p38MAPK途径为MAPK级联途径的原型,在信号传导过程中起重要作用。既往研究发现U0126主要是抑制ERK磷酸化,ERK可将细胞外刺激传递至细胞内,参与细胞的生长、发育、分化等一系列生理活动,并在细胞的恶性转化和肿瘤的发展中起重要作用[3]。
目前对于肿瘤组织中ERK和p38MAPK蛋白表达的研究结果尚存在争议。Bang等[4]在胃癌组织中检测到ERK蛋白表达增强;Price等[5]对神经胶质瘤和前列腺癌组织的研究则发现,肿瘤组织中ERK/p38MAPK蛋白表达未见明显增加。韩艳春等[6]在乳腺癌组织和乳腺癌细胞系MDA-MB-231细胞中发现p-ERK和p-p38MAPK表达显著升高,且两者表达与肿瘤的预后显著相关。赵凯等[7]研究发现人可溶性核因子κB受体活化因子配体(shRANKL)诱导MDA-MB-231细胞24 h后,细胞内ERK和p38MAPK蛋白表达均显著增加。本实验中发现,CCL22作用SBC-5细胞后,p-ERK和p-p38MAPK蛋白表达明显上升,U0126可显著削弱CCL22引起的蛋白表达增加,由此推测CCL22诱导肺癌SBC-5细胞迁移和侵袭能力增加,可能是通过ERK磷酸化引起的。
综上所述,本研究发现趋化因子CCL22对肺癌细胞有明显的趋化作用,该作用可能是通过ERK磷酸化实现的,蛋白激酶抑制剂可显著抑制肺癌细胞的迁移和侵袭,本研究结果可能会为肺癌转移的治疗提供新的实验依据。
[1]Nakamura E S,Koizumi K,Kobayashi M,et al.RANKL-induced CCL22/macrophage-derived chemokine produced from osteoclasts potentially promotes the bone metastasis of lung cancer expressing its receptor CCR4[J].Clin Exp Metastasis,2006,23(1): 9-18.
[2]Vander Griend D J,Rinker-Schaeffer C W.A new look at an old problem:the survival and organ-specific growth of metastases [J].Sci STKE,2004,2004(216):3-9.
[3]Aisa Y,Miyakawa Y,Nakazato T,et al.Fucoidan induces apoptosis of human HS-sultan cells accompanied by activation of caspase-3and down-regulation of ERKpathways[J].AmJHematol,2005,78(1):7-14.
[4]Bang Y J,Kwon J H,Kang S H,et al.Increased MAPK activity and MKP-1 overexpression in human gastric adenocarcinoma [J].Biochem Biophys Res Commun,1998,250(1):43-47.
[5]Price D T,Della Rocca G,Guo C,et al.Activation of extracellular signal-regulated kinase in human prostate cancer[J].J Urol,1999, 162(4):1537-1542.
[6]韩艳春,曾宪旭,王睿,等.p39MAPK信号通路与uPA在乳腺癌细胞及组织中表达的相关性[J].癌症,2007,26(1):48-53.
[7]赵凯,谭群亚,杨翀,等.干扰ERK/p-38 MAPK信号通路对乳腺癌骨转移的影响[J].中华实验外科杂志,2011,28(2):311.
Express of ERK/p38MAPK protein in lung cancer cell migration and invasion induced by chemokine CCL22
Objective To investigate the express of ERK/p38MAPK proteins in lung cancer cell migration and invasion induced by chemokine CCL22.Methods Lung cancer SBC-5 cells were cultured with 100ng/ml CCL22(CCL22 group)or CCL22 and protein kinase inhibitor U0126(CCL22+U0126 group).Cell migration and invasion was measured by Transwell method and scratch assay;the expression of p-ERK and p-p38MAPK in SBC-5 cells was determined by Western blot.Results The distances of cell migration in control,CCL22 and CCL22+U0126 groups were(112.6±27.2)μm,(351.9±16.4)μm and(145.1±29.6) μm,respectively(P<0.05);the numbers of migrant cells in three groups were(199.2±32.8),(505.5±66.3)and(95.7±19.1),respectively(P<0.05).The expression of p-ERK and p-p38MAPK protein was significantly higher than that in control and CCL22+U0126 groups(P<0.05).Conclusion The expression of ERK/p38MAPK protein is up-regulated,indicating that ERK/ p38MAPK proteins may be involved in CCL22 induced lung cancer cell migration and invasion induced by chemokine CCL22.
Lung cancerChemokine CCL22 ERK P38MAPK Cancer migration
2014-06-11)
(本文编辑:胥昀)
杭州市医药卫生科技计划资助项目(2011A046);浙江省医药卫生科技计划资助项目(2011KYA138)
310009 杭州市中医院呼吸科(管彩虹、楼雅芳、朱黎红、吴清);杭州市红十字会医院普外科(赵凯)
赵凯,E-mail:zhaokaiguan@126.com
