响应面分析法优化雨生红球藻产虾青素培养基
2014-04-12徐建春张睿钦耿兆艳
徐建春,孙 翰,张睿钦,管 斌 *,孔 青,耿兆艳,李 霞
(1.青岛琅琊台集团股份有限公司,山东青岛,266400;2.中国海洋大学食品科学与工程学院,山东青岛,266003)
虾青素(astaxanthin,AX)是一种酮式类胡萝卜素[1],化学名称为3,3’-二羟基-4,4’-二酮基-β,β’-胡萝卜素,分子式为C40H52O4。虾青素具有极强的抗氧化活性,极易与自由基反应而清除自由基[2-5],其抗氧化性是β-胡萝卜素的10倍,维生素E的500倍[6],被誉为超级维生素。其在食品、水产养殖及医药方面有着广泛的应用前景[7-9]。
雨生红球藻(Haematococcus pluvialis)是虾青素的良好来源[10],而且雨生红球藻所含虾青素是3S-3’S异构体,与水生动物所含虾青素极为相似,易被生物体吸收[11],雨生红球藻被认为是自然界积累天然虾青素能力最强的生物。这是通过化学合成以及利用红发夫酵母发酵的虾青素所不具备的优势[12]。
培养基质是雨生红球藻生长和虾青素积累的重要因子,是影响雨生红球藻培养及虾青素扩大工业化生产的要素[13-14]。本研究采用响应面分析法,对雨生红球藻混合培养过程中的转化培养基的碳源、氮源和磷源进行优化,以获得更大的生物浓度和虾青素产量。
1 材料与方法
1.1 材料与试剂
1.1.1 藻种
雨生红球藻(Haematococcus pluvialis)诱变菌株:中国海洋大学生物工艺学研究室保存。
1.1.2 培养基
微藻培养基为改良的MCM培养基:葡萄糖3 g/L,KNO30.5 g/L,KH2PO40.02 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.08 g/L,Fe-EDTA 100 μL/L,微量元素100 μL/L,pH值调至8.0。
Fe-ED TA 溶 液:EDTA·2Na 3.72 g/L,FeSO4·7H2O 4.17g/L。
微量元素母液:H3PO412.37 mg/L,ZnSO471.89 mg/L,MnSO4·H2O 84.51 mg/L,CuSO4·5H2O62.42mg/L,Na2MoO4·2H2O 7.26 mg/L,CoCl2·2H2O4.76 mg/L。
微藻的生长培养基中加入1.6 g/L NaAc或者葡萄糖3 g/L,其余成分与藻种培养基相同,pH调至8.0。
转化培养基:乙酸钠1.5.g/L,KNO30.5 g/L,KH2PO40.02 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.08 g/L,Fe-EDTA 100 μL/L,微量元素100 μL/L,pH值调至8.0。
试验所用的化学试剂均为国产分析纯。
1.2 仪器与设备
QHX-250BS-Ⅲ人工气候箱:上海新苗医疗器械制造有限公司;SPS202F电子天平:梅特勒-托利多(常州)设备有限公司;PHS-2F数字pH计:上海精密试验设备有限公司;722N可见分光光度计:上海精科仪器有限公司;JY92-Ⅱ型超声波细胞破碎器:宁波新芝生物科技股份有限公司;UV-2802PC紫外分光光度计:尤尼柯仪器有限公司。
1.3 试验方法
1.3.1 培养基主要成分对虾青素积累的影响
(1)碳源对虾青素积累的影响
本研究为培养及转化基质提供了乙酸钠和葡萄糖两种碳源,并对比选择最优转化碳源。固定氮源为0.01 g/L KNO3,磷源为0.01 g/L KH2PO4,设置乙酸钠质量浓度分别为0.2 g/L、0.5 g/L、0.8 g/L、1.0 g/L、1.5 g/L、2.0 g/L,葡萄糖质量浓度分别设置为2.0 g/L、3.0 g/L、4.0 g/L,培养7 d后,然后将微藻液分别装入50 mL离心管,5 000 r/min离心10 min,除去上清液,将微藻细胞分别转接入装有不同乙酸钠和葡萄糖的培养基(每份50 mL)中进行藻细胞的转化,将在原培养基中转化的组别作为对照组,测定不同碳源对虾青素含量的影响。
(2)KNO3的含量对虾青素积累的影响
在转化培养基中固定碳源为0.5 g/L 乙酸钠,磷源为0.01 g/L KH2PO4,设置KNO3质量浓度分别为0、0.005 g/L、0.01 g/L、0.04 g/L、0.07 g/L、0.10 g/L。培养基其余成分及其他试验条件不变。雨生红球藻在生长条件下,培养7 d后,然后将培养藻液分别在5 000 r/min条件下离心10 min,除去上清液,将藻细胞分别转接入转化培养基中进行藻细胞的转化,测定虾青素含量。
(3)KH2PO4含量对虾青素积累的影响
在转化培养基中固定碳源为0.5 g/L 乙酸钠,氮源为0.01g/LKNO3,设置KH2PO4质量浓度分别为0、0.01g/L、0.1g/L、0.2 g/L、0.3 g/L。培养基其余成分含量不变。其他试验条件不变。雨生红球藻在生长条件下,培养7 d后,然后将培养藻液分别在5 000 r/min条件下离心10 min,除去上清液,将藻细胞分别转接入转化培养基中进行藻细胞的转化,测定虾青素含量。
1.3.2 中心组合试验设计(CCD)优化转化培养基
雨生红球藻在生长条件下,培养7 d后,然后将培养藻液分别在5 000 r/min条件下离心10 min,除去上清液,将藻细胞分别转接入转化培养基中进行藻细胞的转化,测定虾青素含量。在单因素试验的基础上,设计二因素三水平的中心组合试验设计(central composite design,CCD)优化培养基成分。选取乙酸钠、KNO3添加量两个因素三个水平进行中心组合试验,因素与水平见表1。

表1 雨生红球藻转化培养基优化CCD试试验的因素与水平Table 1 Factor and levels of central composite design for transformation medium optimization
1.3.3 微藻细胞培养、转化方法及指标测定
培养方法:以10%的接种量将藻种接入100 mL培养液中,22 ℃,光照1 000~1 500 lx,光周期12∶12(光照培养时间12 h∶暗培养时间12 h),培养7 d。转化方法:30 ℃,光照强度5 000~5 500 lx,全天光照,转化5 d。
细胞密度的测定:利用722N可见分光光度计测定680 nm波长处的吸光度值。
细胞形态的观察:显微镜放大160倍进行观察。
虾青素含量的测定:参考文献[15]的方法,并进行适当修改。移取5 mL孢子态的藻体,4 000 r/mim离心10 min,除上清,收集藻体,加入2 mL甲醇/KOH溶液(30%甲醇和5%KOH等体积混合液)振荡,使藻体均匀分散后置于65 ℃恒温水浴中加热15 min,4 000 r/min离心15 min,去除上清液,沉淀加蒸馏水洗涤2次,去除残留碱液。上述藻体加入5 mL二甲基亚砜,200 W超声波破碎10 min,离心收集上清液,沉淀加入二甲基亚砜重复提取,直至藻体沉淀变白,40 ℃振荡提取20 min,红色上清液于波长490 nm条件下测定吸光度值。

式中:C为虾青素含量,mg/L;OD490为波长490 nm条件下的吸光度值;Va为提取液体积,mL;Vb为藻液体积,mL;f1为测吸光度值时的稀释倍数;f2为转化过程中水蒸发带来的浓缩倍数。
2 结果与分析
2.1 碳源对虾青素积累的影响
(1)乙酸钠含量对虾青素积累的影响
雨生红球藻细胞在一定培养以及转化条件下,不同乙酸钠浓度对虾青素积累的影响,结果如图1所示。

图1 乙酸钠含量对虾青素生成量的影响Fig.1 Effect of sodium acetate content on astaxanthin production
由图1可值,当乙酸钠含量<1.5 g/L范围内,虾青素含量随乙酸钠含量增加而增加;当乙酸钠含量为1.5 g/L时,虾青素含量达到最高(10.25 mg/L),是对照的10.48倍;当乙酸钠含量>1.5 g/L,虾青素含量随乙酸钠含量增加而减少。利用乙酸钠进行异养培养可显著促进虾青素生物转化。
(2)葡萄糖含量对虾青素积累的影响
雨生红球藻细胞在一定培养以及转化条件下,不同葡萄糖含量对虾青素积累的影响,结果如图2所示。

图2 葡萄糖含量对虾青素生成量的影响Fig.2 Effect of glucose content on astaxanthin production
由图2可看知,随着葡萄糖含量增加,虾青素含量减少;当葡萄糖含量为2.0 g/L时,虾青素含量达到较高水平(2.94 mg/L)。与对照相比,虾青素含量增加较多(是对照的3.01倍)。利用葡萄糖进行异养培养可促进虾青素生物转化。
由图1与图2对比分析可看出,转化培养基中以乙酸钠作碳源,比以葡萄糖作碳源时虾青素含量高(以乙酸钠作碳源时进行转化时虾青素含量为10.25 mg/L;以葡萄糖作碳源时进行转化时虾青素含量为2.94 mg/L)。利用乙酸钠作为碳源与葡萄糖相比,异养培养过程对虾青素生物转化作用更加显著。
2.2 KNO3含量对虾青素积累的影响
雨生红球藻细胞在一定培养以及转化条件下,不同KNO3含量对虾青素积累的影响,结果如图3所示。
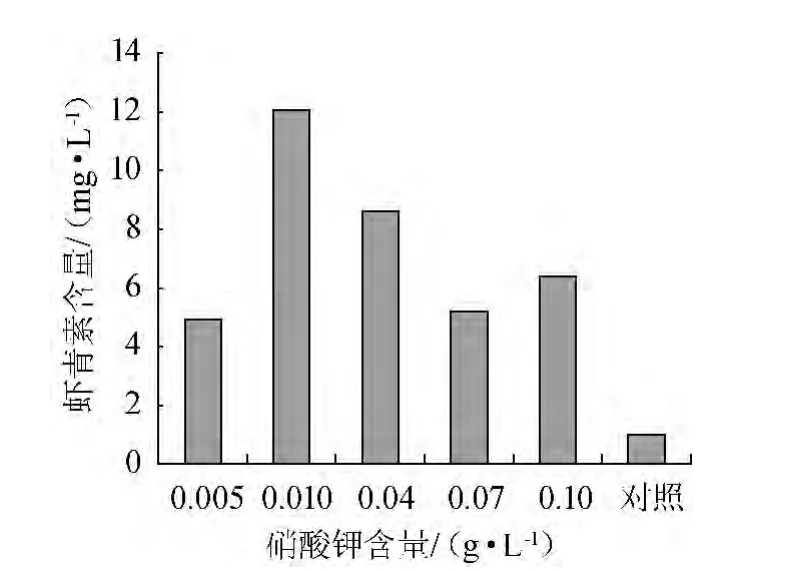
图3 硝酸钾含量对虾青素生成量的影响Fig.3 Effect of potassium nitrate content on astaxanthin production
由图3可知,当KNO3含量<0.01 g/L范围内,虾青素含量增加;当转化培养基中硝酸钾含量为0.01 g/L时,虾青素含量最高(12.09 mg/L),是对照中的虾青素含量的12.37倍,后随硝酸钾含量的增加虾青素含量快速下降。这个结果与BOROWITZKA M A等[16]的结论一致,在转化培养基质中氮源相对缺乏时可促进虾青素生物转化。
2.3 KH2PO4含量对虾青素积累的影响
雨生红球藻细胞在一定培养以及转化条件下,不同KH2PO4含量对虾青素积累的影响,结果如图4所示。

图4 磷酸二氢钾含量对虾青素量生成的影响Fig.4 Effect of potassium dihydrogen phosphate content on astaxanthin production
由图4可知,当KH2PO4含量在0~0.3 g/L范围内,磷含量对虾青素影响并不大,且磷酸二氢钾含量>0.1 g/L时培养基中开始出现白色浑浊(磷酸根与其他金属离子相结合产生白色浑浊),所以在后面响应面试验的设计中只考虑硝酸钾和乙酸钠含量,而磷含量保持不变,即0.01 g/L。
2.4 响应面试试验
在单因素试验基础上,应用响应面分析法确定转化培养基中NaAc含量(X1)和KNO3含量(X2),以虾青素含量的平均值为响应值Y。中心组合试试验结果、方差分析分别如表2、表3所示。
对表2的试验结果进行回归分析获得如下的回归方程:

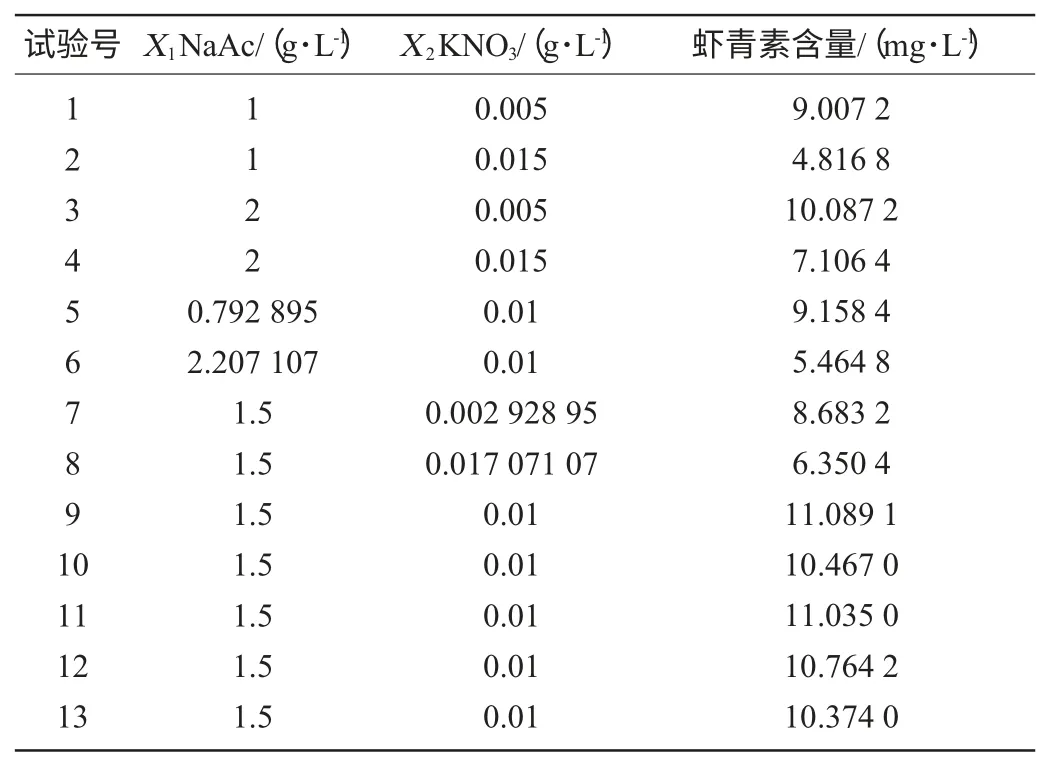
表2 雨生红球藻转化培养基优化CCD试验结果Table 2 Results of CCD experiment for transformation medium optimization
为考察影响雨生血球藻转化程度及试验结果的可靠性,对试验结果进行了方差分析,如表3所示。由表3可知,该方程对虾青素含量的决定系数(R2)为0.794 0,这表明总变量中有79.4%的变量符合该模型。在考察的两个因素中,乙酸钠含量和KNO3含量对雨生血球藻转化生成虾青素具有显著影响。

表3 雨生红球藻转化培养基优化CCD试验结果方差分析Table 3 Variance analysis of CCD experiment for transformation medium optimization
为了进一步说明乙酸钠和硝酸钾含量的交互作用和决定两个因素的水平对虾青素产量的影响,根据统计结果利用Statistica 7.1获得了三维响应面曲线,如图5所示。

图5 乙酸钠和硝酸钾含量对虾青素生成量影响的响应面Fig.5 Response surface plots of effects of interaction between sodium acetate content and nitrate content on astaxanthin production
由图5可看出,在乙酸钠含量在1.460 5 g/L,硝酸钾含量在0.008 4 g/L时,虾青素含量达到了最高值11.046 0 mg/L。
2.5 验证试验
为了检验模型预测的准确性,在中心组合试验得出的最优点进行重复试验,所得虾青素含量为10.908 mg/L,与预测值拟合较好,说明模型能较好地预测虾青素含量。
3 结论
通过本研究发现,对雨生红球藻转化产虾青素影响较大的是硝酸钾含量、乙酸钠含量,而磷酸二氢钾的含量对虾青素产量影响不大。通过中心组合试验进行优化,优化后的转化培养基中乙酸钠含量为1.460 5 g/L,硝酸钾含量为0.008 4 g/L,磷酸二氢钾0.01 g/L,通过对预测模型的反复验证试验,虾青素产量为10.908 mg/L,与模型预测值基本一致,使得虾青素产量比对照培养基提高了9.16倍。
[1]MIKI W.Biological functions and activities of animal carotenoids[J].Pure Appl Chem,1991,63(1):141-146.
[2]SCHROEDER W A,JOHNSON E A.Antioxidant role of carotenoids inPhaffia rhodzyma[J].J Gen Microbil,1993,139(5):907-912.
[3]殷明焱,刘建国,张京浦,等.雨生红球藻和虾青素述评[J].海洋湖沼通报,1998(2):53-62.
[4]NAGUIB Y M A.Antioxidants activities of astaxanthin and related carotenoid[J].J Agr Food Chem,2000,48(16):1150-1154.
[5]王菊芳,吴振强.虾青素的生理功能及其应用[J].食品与发酵工业,1999,26(2):66-69.
[6]刘子贻,沈奇桂.虾青素的生物活性及开发[J].中国海洋药物,1997(3):46-49.
[7]REZA R,RYOTA I,HIRONORI S,et al.High efficiency production of astaxanthin by autotrophic cultivation ofHaematococcus pluvialisin a bubble column photobioreactor[J].Biochem Eng J,2008,39:575-580.
[8]HARKER M,TSAVALOS A J,YONG A J.Autotrophic growth and carotenoid production of in 30L air-lift photobioreactor[J].J Ferment Bioeng,1996,82(2):113-118.
[9]游 泳,管 斌,孔 青,等.混合培养对雨生红球藻虾青素产量的影响[J].中国酿造,2011,30(6):38-41.
[10]朱劲华,张成武,李朝军.利用雨生红球藻生产天然虾菁素的研究进展[J].天然产物研究与开发,2003,15(3):268-272.
[11]张睿钦,管 斌,孔 青,等.雨生红球藻异养转化产虾青素的条件研究[J].浙江大学学报,2011,37(6):624-630.
[12]张京浦,刘建国.温度对雨生红球藻光合作用的影响[J].植物生物学学报,1994,4(1):6-10.
[13]庄惠如,陈必链,王明兹,等.雨生红球藻混合营养与异养培养研究[J].微生物学通报,2000,27(3):198-201.
[14]董庆霖,赵学明,邢向英.乙酸钠诱导雨生红球藻合成虾青素的机理[J].微生物学通报,2007,34(2):256-260.
[15]董庆霖.利用雨生红球藻和红发夫酵母代谢过程中的协同效应提高虾青素产量[D].天津:天津大学博士论文,2004.
[16]BOROWITZKA M A,HUISMAN J M,OSBORN A.Culture of the astaxanthin-producing green algaHaematococcus pluvialis[J].J Appl Phycol,1991,3:295-304.
