五种磺酰脲类除草剂分离检测方法的建立及其在土壤样品中的应用
2014-04-11汤凯洁周志娥余瑞龙陈尚卫
汤凯洁,周志娥,余瑞龙,陈尚卫
(1.江西农业大学 南昌市农产品加工与质量控制重点实验室,江西 南昌 330045;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
随着我国现代农业的快速发展和近年来农村劳动力向城市转移,农业栽培耕作方式趋向于规模化和集约化发展,我国农村对除草剂的需求量日渐增大,除草剂对土壤和水体的污染及其在农作物中的残留日益严重。磺酰脲类除草剂对禾本科杂草、阔叶杂草、莎草、看麦娘、稗草等都有较好的防除效果,可用于水稻、玉米、大豆、油菜、麦类等多种作物田防除杂草[1-2]。随着该类除草剂使用量及使用范围的不断加大,其在农作物中的残留、对环境的污染及对人类健康潜在的危害也越来越为各国政府和专家所重视[3-6]。我国目前广泛应用的磺酰脲类除草剂品种有苄嘧磺隆、吡嘧磺隆、烟嘧磺隆、苯磺隆、胺苯磺隆、氯磺隆、甲磺隆、醚磺隆等。美国、欧盟、日本等专门针对多种磺酰脲类除草剂制定了在食品、饲料中的最高残留限量,韩国和中国台湾省分别制定了吡嘧磺隆和苄嘧磺隆的在大米中的最大残留限量,吡嘧磺隆最大残留限量分别为0.05 mg/kg(韩国)0.5 mg/kg(中国台湾),苄嘧磺隆的最大残留限量分别为0.02 mg/kg(韩国)0.5 mg/kg(中国台湾)[7-8],成为我国大陆农产品贸易面临的又一个技术壁垒。由于苄嘧磺隆、吡嘧磺隆常混用于水稻田防除禾本科杂草,烟嘧磺隆常用在玉米田防除禾本科杂草,苯磺隆常用于小麦和大麦田防除阔叶杂草,而甲磺隆是近年来禁用农药,但其对阔叶杂草防除的高效性,不法生产和销售商仍在非法销售。由于水田和旱地的相互轮作,因此这五种磺酰脲类除草剂可能会在土壤和农作物中同时残留,因为这几种物质的极性比较接近,要良好分离有一定的难度,虽然其他磺酰脲类除草剂检测也有文献报道[9-12],但同时分离检测吡嘧磺隆、苄嘧磺隆、苯磺隆、甲磺隆、烟嘧磺隆方法未见报道,由于轮作和农药混用的原因,而这五种磺酰脲类物质在水体和土壤中的残留现状值得关注。因此本文研究了这五种常用磺酰脲类除草剂的高效液相分离检测条件和检测土壤样品残留的预处理方法。
1 材料与方法
1.1 材料与试剂
吡嘧磺隆(pyrazosulfuron,PS)、苄嘧磺隆(bensulfuron-methyl,BSM)、苯磺隆(tribenuron-methyl,TBM)、甲磺隆(metsulfuron-methy,MSM)、烟嘧磺隆(nicosulfuron,NS)(标准品98%,上海农药研究所);甲醇(MeOH)、乙腈(MeCN)(色谱纯,江苏汉帮化学试剂公司),磷酸(phosphoric acid)(分析纯,上海国药集团),硅藻土(上海国药集团),硅酸镁(天津傲然精细化工研究所,60~100目)。实验用水为Mill-Pore超纯水。
1.2 仪器与设备
Waters 1525高效液相色谱仪:配置双波长紫外检测器(Waters 2487,USA),二元泵(Waters 1525,USA)、采用Waters 1525化学工作站;
METTLER DELTA 320 pH计:梅特勒-托利多上海有限公司;真空固相萃取装置:北京京科瑞达科技有限公司;Milli-Q integral 15超纯水处理器:法国密理博公司;KD200型氮气吹扫仪:杭州奥盛仪器有限公司;KQ3200型超声波清洗机:昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 HPLC 分离条件的优化 色谱柱为 C18柱(250mm×4.6mm,i.d.,5 μm,,Waters Co,USA),柱温为30℃,流速为0.8mL/min,进样量为10μL,检测波长241 nm。流动相 A为 V(乙腈)∶V(水)=20∶80,0.01%磷酸调pH),流动相B为V(乙腈)∶V(水)=80∶20,0.01%磷酸调pH)。实验设计了3种不同的洗脱梯度程序,考察不同梯度对五种磺酰脲类分离效果的影响,以分离度为考察指标,从而选择最佳洗脱梯度。梯度设计见表1~3.

表1 流动相梯度洗脱程序1Tab.1 Liquid chromatography separation conditions mobile phase gradient elution procedure 1

表2 流动相梯度洗脱程序2Tab.2 Liquid chromatography separation conditions mobile phase gradient elution procedure 2

表3 流动相梯度洗脱程序3Tab.3 Liquid chromatography separation conditions mobile phase gradient elution procedure 3
1.3.2 试剂的配制 分别准确称取吡嘧磺隆0.0228 g,苄嘧磺隆0.0165 g,烟嘧磺隆0.0102 g,甲磺隆0.0182 g,苯磺隆0.0107 g置于100mL容量瓶中,加入甲醇溶解并定容至刻度,摇匀,配制成溶度为228,165,102,182,107 μg/mL的标准储备液。使用前再用甲醇将储备液稀释成适当浓度的标准工作液。将以上储备液用封口膜密封后置于冰箱中存放备用,可保存一个月。
1.3.3 标准曲线 分别取配制好的标准储备液,用甲醇逐级稀释,配制成适合的浓度梯度的标准溶液,供HPLC分析。以配制的浓度为横坐标,其对应的峰面积为纵坐标,绘制标准曲线并求出线性回归方程。
1.3.4 SPE柱的选择 配制10 μg/mL的PS、NS、MSM、BSM和TBM 5种标样,用不同的SPE柱富集和净化,硅酸镁柱和硅胶柱(汉邦公司)的洗脱程序参考肯定列表标准[7],SPE C-18柱(汉邦公司)和SPE-ENVITM-18柱(Sigma公司)柱的洗脱程序为先用乙腈2×2.5mL活化,然后用乙腈提取溶液上样,再加2.5mL乙腈洗脱,收集洗脱液,氮吹干,加1mL甲醇超声溶解留待HPLC定量分析,比较不同柱的回收率。
1.3.5 土壤样品的制备 土壤样品取自江西农业大学实验田。称取经粉碎混匀后过50目筛的土壤样品约5 g,置于50mL离心管中,加入20mL水,放置2 h。加入20mL乙腈,搅拌10min后,超声辅助提取30min,然后以4000 r/min离心20min,采用0.45 μm有机相滤头过滤,残渣按上述方法重复操作,合并滤液于离心管中,氮吹干,加标溶解留待过ENVITM-18柱。
1.3.6 样品的净化 ENVITM-18小柱(3mL,500 mg)中分别注入乙腈2.5mL和水2.5mL活化,弃去流出液。然后往柱中注入1.3.5提取方法所得的溶液后,用2×2.5mL水淋洗,弃去流出液,继续加入2×2.5mL乙腈洗脱,收集乙腈洗脱液并过孔径0.45 μm滤膜,洗脱液用氮吹干,加甲醇1mL超声溶解留待HPLC进样分析,计算样品加标的回收率和精密度实验。
2 结果与分析
2.1 流动相和洗脱梯度的优化
在HPLC多残留分析中流动相的选择和优化很关键,好的洗脱程序不仅应使各种除草剂组分基线分离,而且还应考虑除草剂组分与干扰物质分离,为将各种磺酰脲类除草剂与干扰物质分离,必须要达到合适的分离度(Rs>1.5),分离度受容量因子(k),选择因子(a)和柱效(N)的影响[13]。笔者在实验中比较了甲醇-水(冰醋酸调pH),甲醇-水(未调pH),乙腈-水(未调pH),乙腈-水(磷酸调pH)等4种流动相。结果发现在同一梯度下,流动相中酸度对磺酰脲类除草剂的保留值起十分重要的作用,流动相中不含磷酸时,磺酰脲类除草剂的保留时间相对较长,当流动相中添加0.01%的磷酸时,5种磺酰脲类除草剂的分离较大地改善,且基线平稳。其主要原因是,当用磷酸调节pH,能抑制磺酰脲类除草剂-NH上的氢电离,使PS、BSM、MSM、NS和TBM保持分子形态,使它们与C18柱之间的相互作用减弱[14]。用改变流动相的配比来改变k值以增加分离度是最方便的方法,等梯度洗脱不能将以上五种磺酰脲类除草剂完全分离,因此实验中比较了3种不同的梯度洗脱模式,调整溶剂的强度使所有谱带符合1<k<20的范围[15],能获得较好的分离度。
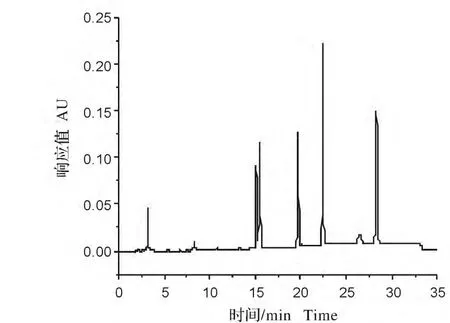
图1 洗脱程序(1)色谱图Fig.1 Chromatography with elution procedure(1)
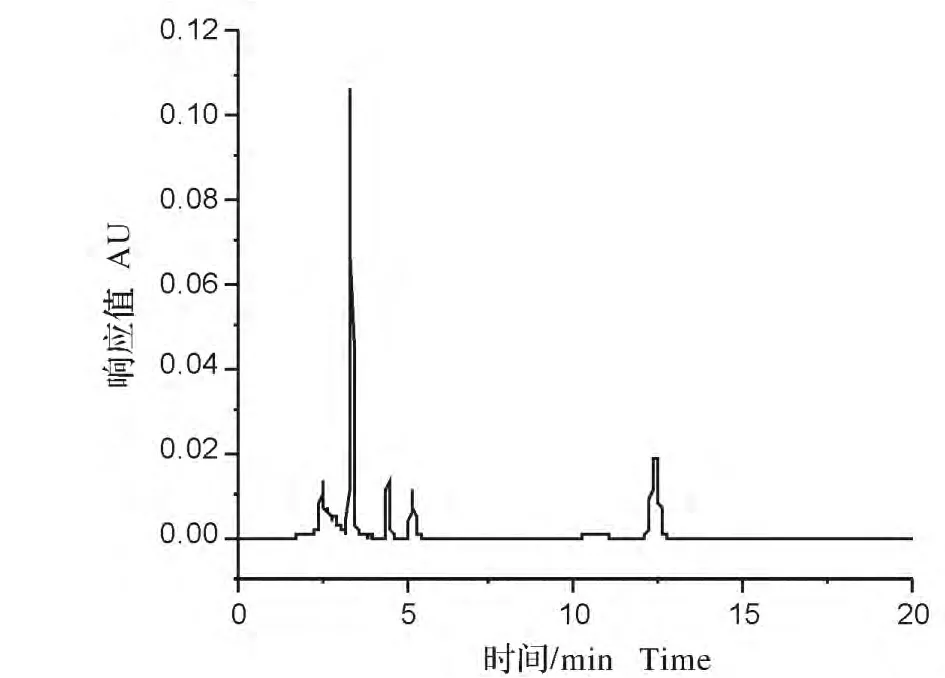
图2 洗脱程序(2)色谱图Fig.2 Chromatography with elution procedure(2)
比较3种梯度洗脱的液相色谱图可见,采用梯度程序1分离得到的液相图谱图1,有3种除草剂完全分离开来,但有两种峰没有达到基线分离;而采用梯度2洗脱程序得到的液相色谱图2,发现只有4个峰,其中有一个峰在20min后仍没有出现;从梯度程序3洗脱的色谱图可以看出,5种磺酰脲类除草剂在18min内得到良好的分离,峰型和出峰时间都比较理想,因此后面的实验都采用梯度3洗脱程序进行分离和定量。
2.2 标准曲线
在上述确定的梯度程序3的分离条件下,配制5个不同浓度的混合标准溶液进行 HPLC 色谱测定(10.0,6.0,3.5,0.3,0.1 μg/mL),以各组分的 3 次平均峰面积(Y)对浓度(X,μg/mL)绘制标准曲线,5种除草剂标准曲线的线性关系和相关系数见表4。从表4可以看出,五种磺酰脲类除草剂在0.1~10 μg/mL范围内线性良好,相关系数(R2)均在0.998以上。可以满足定量分析的要求。5种磺酰脲类除草剂的HPLC线性方程见表4。
采用本方法对同一标准品平行测定6次,测得各物质的相对标准偏差均小于1%,表明本方法精密度很好。配制3个相同浓度的标准液,每个浓度重复进样3次,检验方法的重现性,测得RSD<5.0%,符合高效液相标准偏差要求,本方法能用于实际样品的检测。
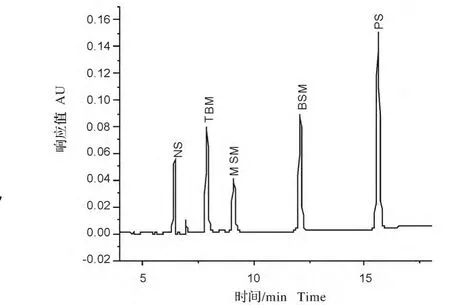
图3 洗脱程序(3)色谱图Fig.3 Chromatography with elution procedure(3)
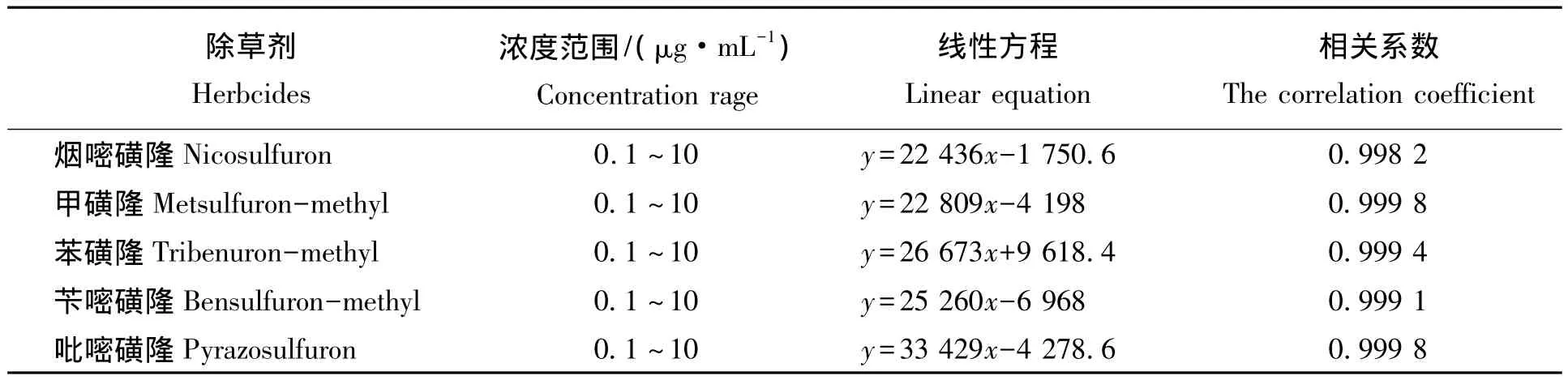
表4 五种除草剂在高效液相色谱仪上测定的线性关系与相关系数Tab.4 The linearity of sulfonylurea herbicides with HPLC
2.3 土壤样品前处理方法的选择
本实验比较了文献报道中的几种SPE柱对PS,NS,MSM,BSM和TBM标样回收率的影响,比较了SPE-C18 和 SCX[16]、硅胶柱[17]、硅酸镁柱[7]、ENVITM-18 柱[18-19]和 Florisil层析柱[20]。在没有干扰成份的影响下,对5种标样回收率最高的是ENVITM-18柱,其中对PS,NS,MSM,BSM和TBM的回收率分别为:88.9%,76.4%,89.6%,83.6%和 86.5%。本实验中采用的 ENVITM-18 柱较 Fang 等[21]采用的MWCNTs柱使用更简单。因此后面土壤样品的富集和净化就采用ENVITM-18柱。
2.4 加标回收率、精密度和检出限
在土壤空白样品中添加5种磺酰脲类除草剂的3个浓度混合标准溶液,按照上述步骤进行回收率实验,并且,每个添加浓度平行操作6份,测定精密度,结果见表5,由表5可以看出,5种磺酰脲类除草剂加标3.5 mg/kg浓度回收率最高,加标回收率介于89.1% ~98.6%,而加标0.1 mg/kg的回收率介于74.5% ~80.9%,其多次测定的RSD介于1.9% ~5.7%,方法的准确度和精密度均符合残留分析的要求。

表5 土壤中五种磺酰脲类除草剂的加标回收率(n=6)Tab.5 Recoveries of five sulfonylurea herbicides in spiked rice
根据信噪比(S/N=3)计算得出五种磺酰脲类除草剂的检出限分别是:PS为0.05 μg/mL,NS为 0.09 μg/mL,MSM 为 0.03 μg/mL,TBM 为 0.07 μgmL,BSM 为 0.02 μg/mL。以每次进样体积为10μL 计算,定量限(S/N=10)如下:PS 为 3.43 μg/mL,NS 为 4.45 μg/mL,MSM 为 3.32 μg/mL,TBM为4.41 μg/mL,BSM 为 4.37 μg/mL。在实际土壤样品中 PS、NS、MSM、TBM 和 BSM 的定量限分别为 2.60,3.92,3.67,3.30,2.95 μg/mL。
3 结论
通过洗脱梯度的优化,5种磺酰脲类除草剂得到了良好的分离,建立了5种磺酰脲类除草剂的高效液相色谱检测方法,对标样的检测限在0.02~0.09 μg/mL,能满足国内外相关标准对该类除草剂残留限量的检测要求。
[1]杨德义.磺酰脲类除草剂分析方法研究进展[J].化学工程师,2006,132(9):48-49.
[2]刘长令.世界农药大全:除草剂卷[M].北京:北京化工出版社,2002:15-75.
[3]Dasgupta S,Meisner C,Wheeler D,et al.Pesticide poisoning of farm workers-implications of blood test results from vietnam international[J].Journal of Hygiene and Environmental Health,2007,210:121-132.
[4]Ding F,Liu W,Zhang X,et al.Identification of pyrazosulfuron-ethyl binding affinity and binding site subdomain IIA in human serum albumin by spectroscopic methods[J].Spectrochimica Acta Part A,2010,75:1088-1094.
[5]Dasgupta S,Meisner C,Wheeler D,et al.Pesticide poisoning of farm workers-implications of blood test results from vietnam international[J].International Journal of Hygiene and Environmental Health,2007,210:121-132.
[6]Rao A N,Johnson D E,Sivaprasad B,et al.Weed management in direct-seeded rice[J].Advances in Agronomy,2007,93:153-255.
[7]中国检验检疫科学院.日本厚生劳动省食品中农用化学品残留检测方法[S].北京:中国标准出版社,2006.
[8]Luc1'a P,Ferna'ndez-Alba A R,Vero'nica C,et al.Analytical methods for pesticide residues in rice[J].Trends in Analytical Chemistry,2011,30(2):270-291.
[9]李辉,李娜,张玉婷,等.粮食中磺酰脲类除草剂的UPLC/MS/MS测定方法[J].分析试验室,2012,31(6):63-69.
[10]吴岩,杨长志,刘永,等.气相色谱-质谱法测定大豆中的豆磺隆的残留量[J].分析试验室,2008,27(3):80-83.
[11]Polati S,Bottaro M,Frascarolo P,et al.HPLC-UV and HPLC-MS multiresidue determination of amidosulfuron,azimsulfuron,nicosulfuron,rimsulfuron,thifensulfuron methyl,tribenuron methyl and azoxystrobin in surface waters[J].Analytica Chimica Acta,2006,579(1):146-151.
[12]Wu Q H,Wang C,Liu Z M,et al.Dispersive solid-phase extraction followed by dispersive liquid-liquid microextraction for the determination of some sulfonylurea herbicides in soil by high-performance liquid chromatography[J].Journal of Chromatography A,2009,1216:5504-5510.
[13]施奈德L R,格莱吉克J L.实用高效液相方法的建立[M].王杰,赵岚峰,王树力,等译.2版.北京:科学出版社,2000.
[14]Bottaro M,Frascarolo P,Gosetti F,et al.HPLC-UV and HPLC-MS multiresidue determination of amidosulfuron,azimsulfuron,nicosulfuron,rimsulfuron,thifensulfuron ethyl,tribenuron methyl and azoxystrobin in surface waters[J].Analytica chimica acta,2006,579(2):146-151.
[15]傅若农.色谱分析概论[M].北京:化学工业出版社,1999:198.
[16]Ramezani M,Simpson N,Oliver D,et al.Improved extraction and clean-up of imidazolinone herbicides from soil solutions using different solid-phase sorbents[J].Journal of Chromatography A,2009,1216:5092-5100.
[17]Fang G Z,Chen J,Wang J P,et al.N-Methylimidazolium ionic liquid-functionalized silica as a sorbent for selective solidphase extraction of 12 sulfonylurea herbicides in environmental water and soil samples[J].Journal of Chromatography A,2010,1217:1567-1574.
[18]岳霞丽,张新萍,董元彦,等.固相萃取-高效液相色谱法测定水体中苄嘧磺隆的残留量[J].光谱实验室,2006,23(2):321-323.
[19]隋凯,李军,卫锋,等.固相萃取-高效液相色谱法同时检测大米中12种磺酰脲类除草剂的残留[J].色谱,2006,24(2):152-156.
[20]祁彦,李淑娟,占春瑞,等.高效液相色谱2质谱法测定大豆中磺酰脲类除草剂多残留量的研究[J].分析化学,2004,32(11):1421-1425.
[21]Fang G Z,Wang X N,Wang S.Multiwalled carbon nanotubes as SPE adsorbents for simultaneous determination of seven sulfonylurea herbicides in environmental water by LC-MS-MS[J].Chromatographia,2010,72:403-409.
