ALKBH2基因RNA干扰慢病毒载体的构建与鉴定
2014-04-09龚隽葛京平杨斌孙颖浩
龚隽,葛京平,杨斌,孙颖浩
0 引言
ABH2为ALKBH蛋白质家族中的一个亚型,是一个上游的癌蛋白-黏蛋白1(mucin 1,MUC1)分子,可导致膀胱尿路上皮癌。质粒介导的RNA干扰(RNA interference,RNAi)技术可抑制目标mRNA,但难以稳定均一地下调靶基因。文中构建了ABH2基因的慢病毒载体,提供了相关的稳定的病毒载体系统。
1 材料与方法
1.1 材料Platimum HIFI Taq Polymerase高保真扩增酶,线性化U6载体,Platinum Taq DNA Polymerase,100 mmol/L dNTPs,DH5α感受态细胞,stbl3感受态细胞,包装质粒Packaging Mix,293T细胞,oligo dT/随机引物/特异性引物(诺百生物);限制性内切酶(MBI公司);T4 ligase连接酶(NEB公司);U6质粒(诺百预制);Trizol Reagent,DEPC H2O,0.1 mol/L dTT,SYBR Green I,Rnase out(我科实验室);慢病毒干扰载体PL/shRNA/F(Invitrogen);0.05%Trypsin、Opti-MEM、DMEM、FBS(GIBCO);Lipofectamine 2000(Invitrogen)。
1.2 方法
1.2.1 全基因合成及表达载体构建①对ABH2基因的全序列进行分析;②根据基因序列分析的结果,进行单链oligo的设计及合成,并在序列的5′端添加限制性酶切位点及Kozak序列GCCGCCACC,在序列的3′端添加限制性酶切位点;③利用PCR将合成的oligo拼接成完整的基因;④将合成好的序列装入pcDNA3.1(+)载体并转化至感受态细胞DH5α;⑤测序验证重组克隆中基因序列是否与要求相符。
1.2.2 shRNA干扰载体构建设计shRNA干扰序列3对,见表1。将3对oligo(连同阴性对照链)退火成双链。然后连接线性化的U6载体,并转化至感受态细胞stbl3,退火、连接和转化的具体方法如下:①oligo退火,将3对合成好的oligo用双蒸水溶解成100 μmol/L,互补单链各取5 μL两两混合,按shRNA oligo退火体系(100 μmol/L top strand oligo 5 μL,100 μmol/L bottom strand oligo 5 μL,10×oligo annealing buffer 2 μL,双蒸水8 μL,共计20 μL)进行退火。然后将3份oligo混合物在95℃加热5 min,再放置室温自然冷却20 min,形成双链oligo。②连接,将退火的双链oligo继续稀释成10 nmol/L浓度,按酶连接体系在室温连接30 min。酶连接体系如下:5×ligation buffer 4 μL,线性化U6载体(5 ng/μL)2 μL,ds oligo(10 nmol/L)4 μL,T4 DNA ligase(1 U/μL)1 μL,双蒸水9 μL,共计20 μL。③转化,取1 μL连接反应,与100 μL感受态细胞混合,冰浴20 min,42℃热击1 min,冰浴2 min。加200 μL LB培养液,置于摇床上,37℃100 r/min孵育1 h。取50 μL涂布含AMP琼脂平板,37℃过夜,挑选单克隆菌群接种于500 mL含AMP的LB培养液中,37℃摇菌16 h,按照Axygen DNA小抽试剂盒说明书抽提质粒。

表1 shRNA oligo序列Table 1 Oligo sequence of shRNA
1.2.3 干扰效果筛选-QPCR根据不同的载体分为4组:siRNA-468组、siRNA-571组、siRNA-662组和对照组。每组试验均重复3次。对于U6-ALKBH2-468、U6-ALKBH2-571、U6-ALKBH2-662载体和表达载体共转染HEK293细胞样品,抽提RNA,反转录到cDNA后,用sybr法定量目的基因ABH2的表达水平。反转录:取一灭菌的无酶的eppendorf管,每个样本加入如下组分:RNA 5 μL(1 μg/μL),引物(50 μmol/L oligo dT)0.5 μL,随机引物0.5 μL,10 mmol/L dNTP Mix 1 μL,DEPC-treated water 5 μL,共计12 μL,得到MixⅠ。在12 μL MixⅠ里加入5x First-Strand buffer 4μL,0.1mol/L dTT 2μL,Rnaseout 40 U/μL 1 μL,SuperScriptⅢ反转录酶(200 U/μL)1 μL,得到MixⅡ体系。25℃处理5 min,50℃处理60 min,70℃处理15 min。立即放置到冰上。PCR扩增,引物及序列如下:ALKBH2-F:CTGTCTCCTTCGGTGCCT,ALKBH2-R:TGTTGGTCGGGTGGTTCA,Actin-F:CATTGCCGACAGGATGCAG,Actin-R:CTCGTCATACTCCTGCTTGCTG。PCR体系中各组分的体积:双蒸水12.3 μL,10×PCR缓冲液2.0 μL,Mg2+(50 mmol/L)2.0 μL,dNTPs(10 mmol/L)0.5 μL,上游引物+下游引物(10 μmol/L)各0.5 μL,20×SYBR液,1.0 μL,Taq酶(5 U/μL)0.2 μL,模板cDNA 1.0 μL,共计20 μL。PCR反应条件:95℃保持2 min;95℃保持10 s,60℃保持30 s,70℃保持45 s,循环40次;熔解(70~95℃)。
实时荧光定量核酸扩增检测系统(real-time quantitative PCR detecting system,qPCR)利用荧光基团在不同条件下发出变化的荧光信号,动态即时监测目标基因在循环扩增过程中增量产物的变化,并可实现定量分析。内参基因和靶基因扩增效率相似时,qPCR法测定靶基因相对表达量的公式为R=2-ΔΔCt,即以实验组靶基因的Ct值减去内参基因的Ct值,将上述的结果取2的负幂指数。
1.2.4 选择shRNA-ALKBH2-571构建慢病毒载体将1对oligo退火成双链。然后连接线性化的pL/shRNA/F载体,并转化至感受态细胞stbl3,退火、连接和转化的具体方法如下:①oligo退火:将合成好的oligo用双蒸水溶解成100 μmol/L,互补单链各取5 μL两两混合,按shRNA oligo退火体系(100 μmol/L top strand oligo 5 μL,100 μmol/L bottom strand oligo 5 μL,10×oligo annealing buffer 2 μL,双蒸水8μL,共计20μL)进行退火。然后将oligo混合物在95℃加热5 min,再放置室温自然冷却20 min,形成双链oligo。②连接:将退火的双链oligo继续稀释成10 nmol/L浓度,按酶连接体系在室温连接30 min。酶连接体系如下:5×ligation buffer 4 μL,线性化pL/shRNA/F载体(5 ng/μL)2 μL,ds oligo(10 nmol/L)4μL,T4 DNA ligase(1U/μL)1μL,双蒸水9 μL,共计20 μL。③转化:取1 μL连接反应体系和100μL感受态细胞混合,冰浴20min,42℃热击1 min,冰浴2 min。加200 μL LB培养液,37℃100 r/min孵育1 h。取50 μL涂布含抗性LB平板。
1.2.5 包装慢病毒用构建的慢病毒干扰载体和包装质粒共转染293T细胞,包装病毒,收集病毒原液,超速离心浓缩,并测定滴度。具体如下:①取细胞状态良好的293T细胞,细胞计数后,每个培养皿接种6×106个细胞,37℃,5%CO2的培养箱中培养过夜;第2天转染前移去培养液,换5 mL Opti-MEM培养液;取9μg Packaging Mix和3μg慢病毒表达质粒加入1.5 mL Opti-MEM(经37℃预热)中,轻轻混匀;取36 μL lipofectamine 2000转染试剂加入1.5 mL Opti-MEM中,轻轻混匀,室温放置5 min;轻轻混合质粒溶液和lipofectamine 2000稀释液,置室温20 min;将3 mL质粒脂质体复合物加入到细胞培养皿中,轻轻混匀,37℃、5%CO2的培养箱中孵育6 h后,更换完全培养液DMEM+10%FBS;48 h后收集细胞培养上清,离心半径12.5 cm,3000 r/min离心10min,去除细胞和碎片,并用0.45μm的滤器过滤;将病毒原液在50000×g下超速离心2 h,去除上清,重悬于1 mL DMEM培养液中,分装小管,放置于-80℃保存备用。②慢病毒液滴度测定:将HEK293细胞培养至对数生长期,病毒稀释用培养液为含8 μg/mL polybrene和2%胎牛血清的细胞培养基。第1天,细胞胰酶消化计数后,按照每孔8000细胞接种96孔板,37℃培养过夜,感染时细胞长至30%~50%的融合密度;第2天,将保存于-80℃冰箱中病毒液冰水浴融化,用含有8 μg/mL polybrene和2%FBS的细胞培养液进行梯度稀释。吸去96孔板中的原先的培养基,然后在每孔中加入50 μL慢病毒稀释用培养基,轻轻混匀各管慢病毒稀释液,再各取50 μL慢病毒稀释液加入每孔细胞中,每个稀释度3个重复。放入CO2培养箱中继续培养。第3天,去除含慢病毒的培养基,加入100 μL的完全培养基;第5-6天,在荧光显微镜下观察各孔中荧光细胞数量,病毒滴度为表达荧光的细胞数除以该孔加入的稀释的病毒液相当于原病毒的体积。
1.2.6 鉴定干扰效果vshRNA-ALKBH2-571慢病毒与表达载体共转染肾癌细胞株ACHN,抽提RNA,反转录到cDNA后,用sybr法定量目的基因ABH2的表达水平。具体方法同1.2.3干扰效果筛选。
1.3 统计学分析采用SPSS 13.0软件进行统计分析,定量资料以均数±标准差(x±s)表示,多组均数间的比较采用单因素方差分析,多重比较采用LSD法;2组均数的比较采用两独立样本t检验。以P≤0.05为差异有统计学意义。
2 结果
合成基因及表达载体构建经测序验证正确。shRNA干扰载体序列验证无误。ABH2数据结果显示,对照组、siRNA-468组、siRNA-571组、siRNA-662组ABH2 mRNA相对表达量分别为0.783±0.086、0.369±0.046、0.153±0.026和0.154±0.028。siRNA-571组和siRNA-662组与对照组和siRNA-468组比较,差异有统计学意义(P<0.01)。shRNA对目的基因ABH2的干扰效率为:ShR-571(84.7%)>ShR-662(84.6%)>ShR-468(63.1%)。选择对ABH2干扰效果最佳的ALKBH2-571构建慢病毒载体及包装慢病毒。转染实验48 h后,在荧光显微镜下的可见荧光,证实转染成功,见图1。包装的慢病毒滴度为1.1×108TU/mL。ABH2基因由慢病毒介导的RNAi后的表达丰度:阴性对照组ABH2 mRNA相对表达量为0.785±0.082,siRNA-571组为0.078±0.006,差异有统计学意义(P<0.01),慢病毒PL/shRNA/F-ALKBH2-571对目的基因ABH2的干扰效率为92.2%。
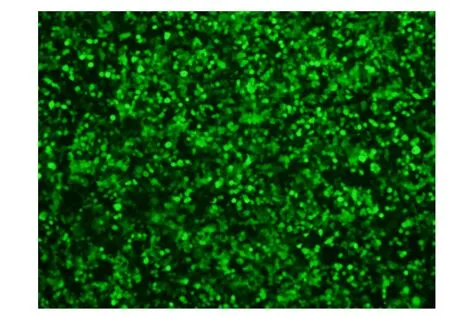
图1 慢病毒转染后荧光显微镜示意图(×100)Figure 1 Microscopic observation of the cells after lentiviral transfection(×100)
3 讨论
ABH2在DNA损伤修复机制具有重要作用[1-4],与人类各种肿瘤的发生发展及治疗领域有密切的关系[5-7]。有研究表明,ABH2基因在人尿路上皮癌细胞株KU7的发展中的作用和功能可能是:抑制黏蛋白的跨膜蛋白MUC1的表达,诱导G1期细胞周期阻滞。此外,抑制ABH2可增加上皮细胞钙黏蛋白和降低波形蛋白表达,从而阻滞上皮间质转化[8]。
RNAi是一项基因沉默技术,在癌症的研究中得到了广泛的应用[9-10]。质粒介导RNAi的局限性在于其效率较低,作用时间较短,且作用弱,不能有效抑制基因表达,稳定性较差。慢病毒载体可转染分裂期及非分裂期细胞,能将目标基因整合至宿主基因组,可应用于肿瘤的分子生物学水平研究和基因治疗[11-13]。与其他病毒载体相比,有较大的稳定性,并且作用持久,感染的细胞范围较广泛[14-15]。因此,应用慢病毒载体介导的RNAi在肿瘤的分子生物学研究领域中,具有很大的价值。
本研究构建了ABH2基因的慢病毒载体,为进一步研究ABH2沉默后相关的泌尿系肿瘤生物学功能的影响,提供稳定、高效,可靠的技术平台。
[1]Fu D,Samson LD.Direct repair of 3,N(4)-ethenocytosine by the human ALKBH2 dioxygenase is blocked by the AAG/MPG glycosylase[J].DNA repair,2012,11(1):46-52.
[2]Chen B,Liu H,Sun X,et al.Mechanistic insight into the recognition of single-stranded and double-stranded DNA substrates by ABH2 and ABH3[J].Mol BioSyst,2010,6(11):2143-2149.
[3]Nay SL,Lee DH,Bates SE,et al.Alkbh2 protects against lethality and mutation in primary mouse embryonic fibroblasts[J].DNA repair,2012,11(5):502-510.
[4]Gilljam KM,Feyzi E,Aas PA,et al.Identification of a novel,widespread,and functionally important PCNA-binding motif[J].J Cell Biol,2009,186(5):645-654.
[5]Gao W,Li L,Xu P,et al.Frequent down-regulation of hABH2 in gastric cancer and its involvement in growth of cancer cells[J].J Gastroenterol Hepatol,2011,26(3):577-584.
[6]Wu S,Xu W,Liu S,et al.Down-regulation of ALKBH2 increases cisplatin sensitivity in H1299 lung cancer cells[J].Acta Pharmacol Sin,2011,32(3):393-398.
[7]Johannessen TC,Prestegarden L,Grudic A,et al.The DNA repair protein ALKBH2 mediates temozolomide resistance in human glioblastoma cells[J].Neuro Oncol,2013,15(3):269-278.
[8]Fujii T,Shimada K,Anai S,et al.ALKBH2,a novel AlkB homologue,contributes to human bladder cancer progression by regulating MUC1 expression[J].Cancer Sci,2013,104(3):321.
[9]Wang Q,Lü Y,Gong Y,et al.Double-stranded Let-7 mimics,potential candidates for cancer gene therapy[J].J Physiol Biochem,2012,68(1):107-119.
[10]胡波,吴苏稼.微小RNA在骨肉瘤中的研究进展[J].医学研究生学报,2013,26(5):524-527.
[11]陈帅,李浩博,李牧,等.靶向树突状细胞的肿瘤疫苗OVA慢病毒载体构建及其体外抗肿瘤效应[J].同济大学学报(医学版),2012,33(1):13-18,23.
[12]陈伟,曹罡,董震,等.人Notch4基因RNAi慢病毒载体的构建及鉴定[J].医学研究生学报,2013,26(2):116-121.
[13]姚伟,李凯,徐挺,等.慢病毒介导的shRNA靶向干扰β-catenin神经母细胞瘤稳定细胞株的建立[J].中华小儿外科杂志,2013,34(4):290-294.
[14]孙懿,曾思聪,卢光琇,等.利用慢病毒载体构建稳定干扰β-catenin的人胚胎干细胞系[J].南方医科大学学报,2012,32(8):1088-1092.
[15]陈立,钟国强,涂荣会,等.Cx43基因shRNA慢病毒载体的构建及其对大鼠心肌细胞Cx43基因的作用[J].山东医药,2013,53(21):1-3.
