我国大豆的生物固氮潜力研究
2014-04-09关大伟岳现录马鸣超
关大伟, 李 力, 岳现录, 马鸣超, 张 武, 李 俊*
(1 中国农科院农业资源与农业区划研究所,北京 100081; 2 黑龙江省农业科学院黑河分院, 黑龙江黑河 164300)
研究植物生物固氮的传统方法主要有差值法、 乙炔还原法和氮素同位素稀释法等,由于方法本身精度有限、 难以持续在野外原位应用或操作不便等,应用范围受到很大限制[7-8]。15N自然丰度法是以非固氮植物作为参照,利用非固氮植物从土壤中吸收的15N丰度高于固氮植物的原理,根据两者的15N自然丰度差异估算出固氮植物的生物固氮率。该方法不仅具备同位素稀释法的优点,而且减少了昂贵的15N标记肥料购置费用和由于施用这种肥料带来的试验误差,逐渐成为应用范围较广的生物固氮定量研究法[9-11]。本研究采用15N自然丰度法,在2011和2012年对我国东北、 黄淮海、 黄土高原和南方大豆产区7个试验点在不施氮肥条件下的大豆生物固氮状况进行了测定,开展了我国大豆主产区生物固氮潜力及其分布规律的研究。
1 材料与方法
1.1 试验点概况
试验于2011年和2012年在我国4个主要大豆产区的7个试验点进行,分别为东北春大豆区黑河、 大庆、 长春和铁岭,黄淮海流域夏大豆区济宁, 黄土高原春大豆区延安和华南四季大豆区南宁。所选7个试验点分别代表了不同气候特征,其中黑河、 大庆、 长春和铁岭分别为寒温带、 中温带、 北温带和温带大陆性季风气候, 济宁为暖温带季风气候, 延安为高原大陆性季风气候,南宁为亚热带季风气候。试验地的位置和土壤基本养分状况见表1,气象资料见表2。

表1 各试验点的位置和土壤养分状况
1.2 试验设计
1.3 样品采集和处理
分别在田间大豆花期和成熟期(大豆叶变黄未脱落时)取样,每次采10株大豆和5株玉米。样品用自来水冲洗干净,将花期大豆样品的根瘤取下并统计根瘤数量,成熟期样品分为植株和籽粒。鲜样于105℃下杀青10 min,85℃烘干至恒重,称重。
1.4 测定项目和方法
植株和籽粒氮含量的测定 将植株和籽粒干样粉碎后,准确称取0.2 g,用H2SO4-H2O2消煮至澄清,用凯氏定氮法测定全氮。
样品δ15N的测定 从成熟期样品和砂培盆栽样品中各取2 g,分别用陶瓷研钵充分研碎,用稳定同位素质谱仪(Thermo-Finnigan MAT 253)测定δ15N值。
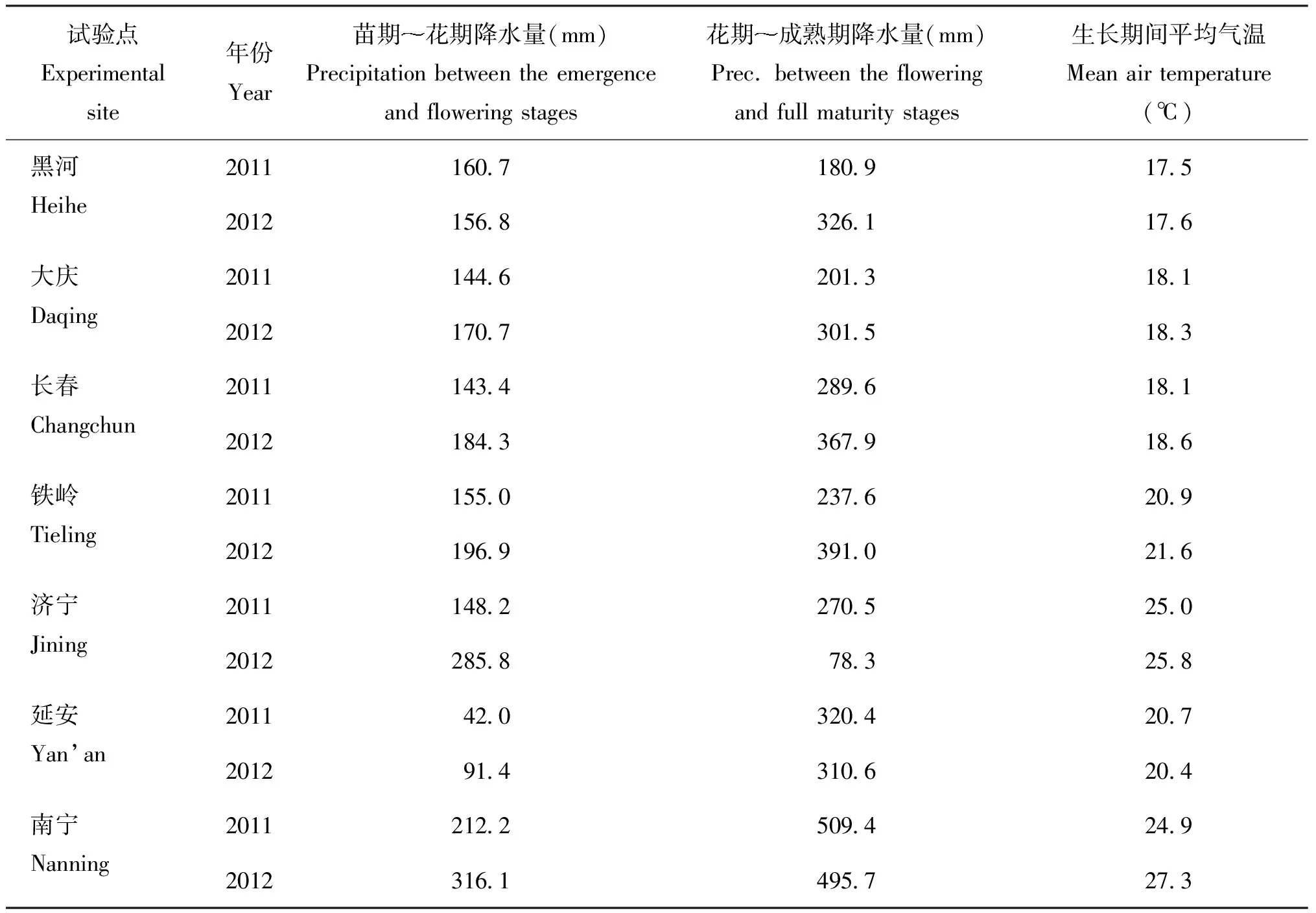
表2 各试验点在大豆生长期的降水与气温数据
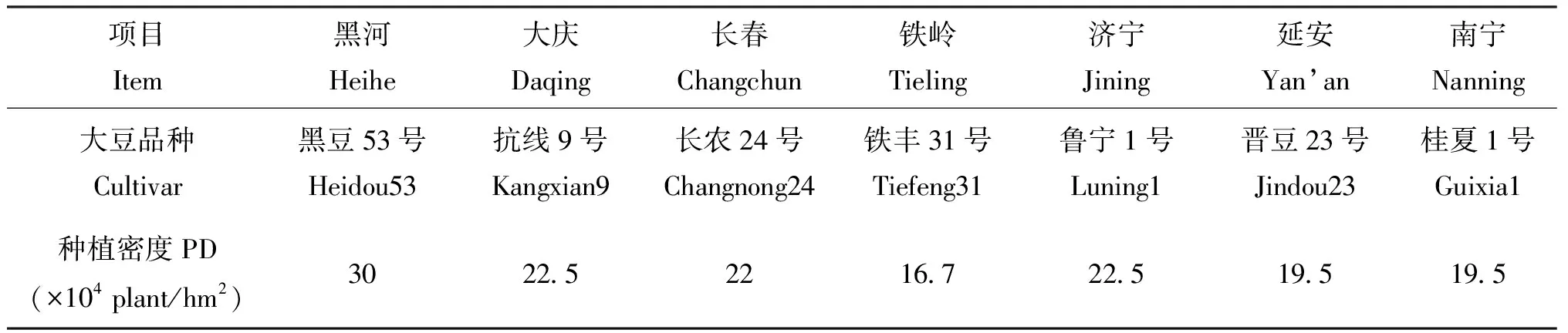
表3 各试验点大豆品种和种植密度
计算方法:
大豆生物固氮效率(% Ndfa)=100× (玉米δ15N-大豆δ15N)/(玉米δ15N-砂培盆栽大豆δ15N)
每公顷大豆固氮量=单株大豆含氮量×生物固氮百分率×种植密度
每公顷籽粒生物固氮量=单株籽粒含氮量×生物固氮百分率×种植密度
试验数据用SPSS 17.0 for Windows进行统计分析。
2 结果与分析
2.1 各试验点生物固氮效率
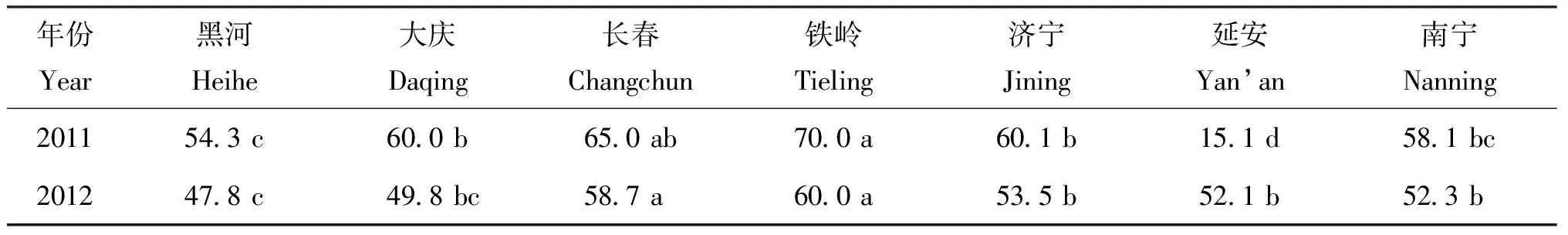
表4 各试验点大豆生物固氮效率(%)
2.2 各试验点大豆生物固氮量
2.3 生物固氮对产量的贡献
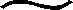
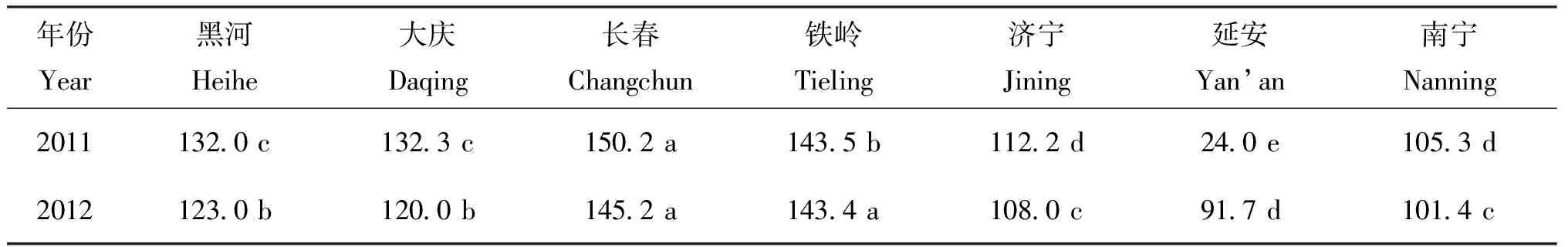
表5 各试验点大豆生物固氮量 (N kg/hm2)
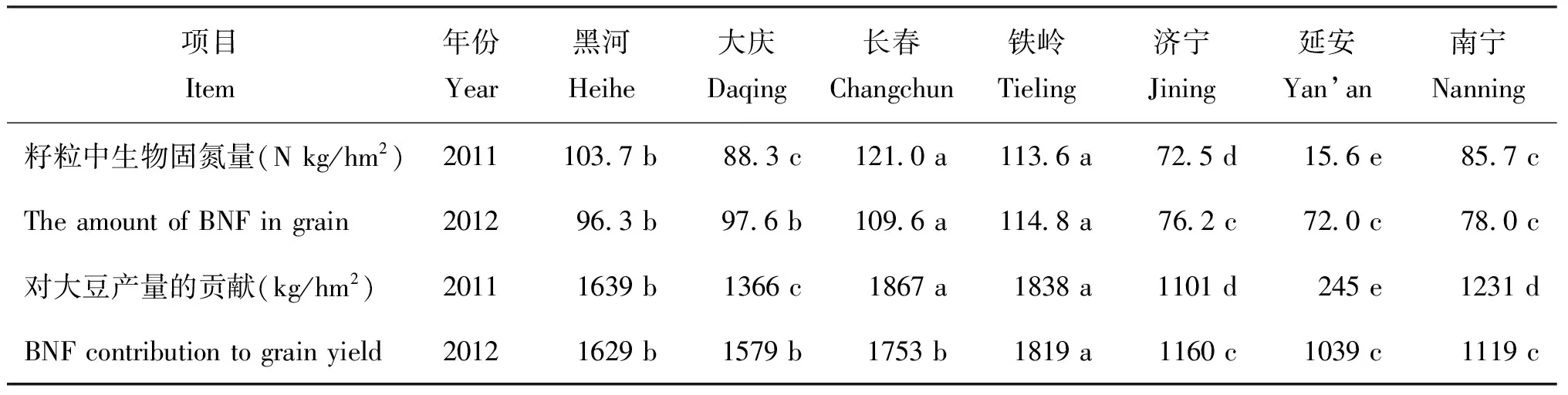
表6 大豆籽粒中的生物固氮量及其对产量的贡献
3 讨论与结论
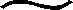
表7 各试验点大豆在花期的根瘤数量和根瘤干重
本研究中生物固氮量和对产量贡献的结果表明,东北的4个试验点最高,其次是济宁和南宁,延安最低,该结果与生物固氮效率的分布规律并不完全一致。通过对影响生物固氮量主要因素的分析,发现主要是各试验点的种植密度的差异造成的。其中黑河试验点的生物固氮量受种植密度的影响最为明显,该试验点生物固氮效率平均比济宁和南宁分别低11%和8%,但种植密度比两个试验点分别高了7.5×104plant/hm2和10.5×104plant/hm2,生物固氮量则平均提高了16 kg/hm2和23 kg/hm2,对产量的贡献约高出504 kg/hm2和459 kg/hm2, 说明大豆群体密度的增加,会弥补生物固氮效率的不足,从而提高单位面积的生物固氮量。但如果一味增加种植密度会使单株叶面积减小[24],光合产物的供应水平也随之下降,从而导致单株的生物固氮量也随之下降[25]。由此可见,构建合理的群体结构是保证大豆生物固氮量的重要因素。本研究各试验点大豆种植密度都根据当地种植习惯设定,是否为最有利于生物固氮的密度水平还有待进一步研究。
受研究条件的限制,本研究设置的试验点数量较少,不能完全反映各个大豆主产区生物固氮的整体状况,但所选试验点均为各大豆产区的主要生产区域,并且所得结果是两年试验的结果,因此对各大豆主产区在实际生产中合理施用氮肥以发挥大豆的固氮潜力具有一定参考价值。
致谢:本文田间试验工作由国家大豆产业技术体系黑河、 大庆、 长春、 铁岭、 济宁、 延安、 南宁试验站协助完成,在此谨向以上各试验站成员致以诚挚的谢意!
参考文献:
[1] 杨红旗, 郝仰坤. 我国大豆产业回顾、 现状与发展对策[J]. 广东农业科学, 2010, (1):188-191.
Yang H Q, Hao Y K. Historical review, current situation and development countermeasure of Chinese soybean[J]. Guangdong Agriculture Sciences, 2010, (1):188-191.
[2] 慈恩, 高明. 生物固氮的研究进展[J]. 中国农学通报, 2004, 20(1):25-28.
Ci E, Gao M.Research progress on biological nitrogen fixation[J]. Chinese Agriculture Sciences Bulletin, 2004, 20(1):25-28.
[3] 方春红.根瘤菌与大豆、 土壤间相互适应性研究[D]. 哈尔滨:东北农业大学硕士论文, 2007.
Fang C H. Studies on adapatability of rhizobium to soybean and siol[D]. Harbin:Ms thesis, Northeast Agrieultural University, 2007.
[4] 宋英博. 不同施氮量对大豆蛋白质和脂肪含量的影响[J]. 黑龙江农业科学, 2010, (7):52-53.
Song Y B. Effect of different nitrogen application on protein and fat content in soybean[J]. Heilongjiang Agriculture Sciences, 2010,(7):52-53.
[5] 姚玉波, 马春梅, 张磊, 等. 施氮水平对大豆吸收利用氮素及产量的影响[J]. 东北农业大学学报, 2009, 40(4):6-10.
Yao Y B, Ma C M, Zhang Letal.Effect of nitrogen levels on absorption and utilization of nitrogen and yield of soybean[J]. Journal of Northeast Agricultural University, 2009, 40(4):6-10.
[6] 王树起, 韩晓增, 乔云发, 等. 施氮对大豆根瘤生长和结瘤固氮的影响[J]. 华北农学报, 2009, 24(2):176-179.
Wang S Q, Han X Z, Qiao Y Fetal. Nodule growth, nodulation and nitrogen fixation in soybean (GlycinemaxL.) as affected by nitrogen application[J]. Acta Agricultural Boreali-Sinica, 2009, 24(2):176-179.
[7] 何道文, 孙辉, 黄雪菊. 利用N-15自然丰度法研究固氮植物生物固氮量[J]. 干旱地区农业研究, 2004, 22(1):132-136.
He D W, Sun H, Huang X J. A review on quantifying biological nitrogen fixation based on N-15 natural abundance method[J]. Agricultural Research in the Arid Areas, 2004, 22(1):132-136.
[8] Unkovich M, Herridge D, Peoples Metal. Measuring plant-associated nitrogen fixation in agricultural systems[M]. Canberra:ACIAR Monograph No. 136, 2008. 258.
[9] Natalie P, Ana P G, Claudia P Jetal.15N natural abundance of biologically fixed N2in soybean is controlled more by theBradyrhizobiumstrain than by the variety of the host plant[J]. Soil Biology & Biochemistry, 2010, 42:1694-1700.
[10] Fernanda C P T, Fernanda R, Norma G R Betal. Quantification of the contribution of biological nitrogen fixation to Cratylia mollis using the15N natural abundance technique in the semi-arid Caatinga region of Brazil[J]. Soil Biology & Biochemistry, 2006, 38:1989-1993.
[11] Ronnie C N, Felix D D. Evaluating N2fixation by food grain legumes in farmers’ fields in three agro-ecological zones of Zambia, using15N natural abundance[J]. Biology and Fertility of Soils, 2010, 46:461-470.
[12] Yu C B, Li Y Y, Li C J. An improved nitrogen difference method for estimating biological nitrogen fixation in legume-based intercropping systems[J]. Biology and Fertility of Soils, 2010, 46:227-235.
[13] Rigaud J, Puppo A. Indole-3-acetic acid catabolism by soybean bacteroids[J]. Journal of General Microbiology, 1975, 88:223-228.
[14] Anita A,Veena J, Nainawatee H S. Eeffet of low temperature and rhiozspheric application of naringenin on pea-rhizobium leguminosarum biovar viciae symbiosis[J]. Journal of Plant Biochemistry and Biotechnology, 1998, 7(l):35-38.
[15] Rice W A, Olsen P E. Root-temperature effects on competition for nodule occupancy between two Rhizobium melilotistrains[J]. Biology and Fertility of Soils, 1988, (6):137-140.
[16] Keerio M I, Chang S Y, Mirjat M Aeta1. The rate of nitrogen fixation in soybean root nodules after heat stress and recovery period[J]. International Journal of Agriculture & Biology, 2001, 3(4):512-514.
[17] 林汉明, 常汝镇, 邵桂花, 等. 中国大豆耐逆研究[M]. 北京:中国农业出版社, 2009.
Lin H M, Chang R Z, Shao G Hetal. Research on tolerance to stresses in Chinese soybean[M].Beijing:China Agriculture Press, 2009.
[18] 姚新春, 师尚礼, 王亚玲. 间歇性干旱对苜蓿根瘤形成的影响[J]. 草地学报, 2007, 15(3):216-220.
Yao X C, Shi S L, Wang Y L. Effect of intermittent drought on nodule formation of alfalfa[J]. Acta Agrestia Sinica, 2007, 15(3):216-220.
[19] 刁治民. 青海豆科植物根瘤及固氮特性研究[J]. 青海草业, 1999, 8(4):10-12.
Diao Z M. Study on the characteristics related to symbiotic nitrogen fixation of legumes in Qinghai[J]. Qinghai Prataculture,1999, 8(4):10-12.
[20] Djekomt A, Planchon C. Water status effect on dinitrogen fixation and pyotosynthesis in soybean[J]. Agronomy Journal, 1991,83:316-322.
[21] Bordeleau L M, Brerost D. Nodulation and nitrogen fixation in extreme environments[J]. Plant and Soil, 1994,161:115-123.
[22] 徐玲玫, 樊蕙, 崔阵, 等. 吉林辽宁两省不同大豆品种自然固氮能力调查[J]. 大豆科学, 1994, 13 (1):38-46.
Xu L M, Fan H, Cui Zetal. Natual N-fixing ability of different soybean cultivars in Jilin and Heilongjiang provinces[J]. Soybean Science, 1994,13 (1):38-46.
[23] 杨琼博. pH值和化合态氮对紫花苜蓿结瘤和固氮效果的影响[M]. 哈尔滨:东北农业大学硕士学位论文, 2007.
Yang Q B. The effect of pH and combined nitrogen on alfalfa bunching and nitrogen fixation[M]. Harbin:Ms thesis, Northeast Agricultural Univercity, 2007.
[24] Shamseldin A, Moawad H. Inhibition of nitrogenase enzyme and completely suppression of nodulation in common bean (PhaseolusvnlgarisL.) at high levels of available nitrogen[J]. American-Eurasian Journal of Agricultural & Environmental Sciences, 2010,1 (1):75-79.
[25] 张敬涛. 密植条件下矮秆大豆合交9525-1生育动态分析[J]. 黑龙江农业科学, 2000, (3):9-11.
Zhang J T. Analysis on the growth situation of short stalk soybean under solid seeded production system[J]. Heilongjiang Agricultural Science, 2000, (3):9-11.
[26] 甘银波, 本佳婉. 不同氮肥管理对毛豆共生固氮及产量的影响[J]. 中国油料作物学报, 1996, 18(l):34-37.
Gan Y B, Ben J W. Effects of N fertilizer managements on N fixation and yield of two vegetable soybeans[J]. Chinese Journal of Oil Crop Sciences, 1996, 18(l):34-37.
