严重乙型肝炎活动进展为肝衰竭的预后因素分析
2014-04-09曾文铤梁增伟谢栩硕
杨 玲,焦 倩,曾文铤,梁增伟,谢栩硕
我国是乙型肝炎病毒(hepatitis B virus, HBV)感染高流行区,一般人群乙肝表面抗原(HBsAg)流行率为7.18%[1]。慢性乙型肝炎患者可因多种因素出现肝脏炎症活动,大部分肝炎活动预后良好,但严重的肝炎活动可进展为肝衰竭;肝衰竭来势凶险,进展迅速,病死率高。目前肝衰竭预警预测和确定病情的评估指标尚不完善,存在一定的缺陷。本研究分析慢性乙型肝炎患者中出现肝炎活动的病例,探讨影响严重肝炎活动预后的因素,筛选出预测进展为肝衰竭的临床和病毒学指标。
1 对象与方法
1.1研究对象 连续收集南方医院及广州医学院第一附属医院于2008年1月至2009年6月住院治疗的严重肝炎活动患者。严重肝炎活动定义为文献报道[3]:慢性乙型病毒性肝炎基础上,本次发病时血清丙氨酸转氨酶(ALT) ≥ 600 U/L,总胆红素(TB) ≥51.3 μmol/L及40% <凝血酶原时间活动度(PTA)≤50%[2]。排除标准:合并其他肝炎病毒及人类免疫缺陷病毒感染;肝硬化;肝癌;严重代谢性肝病或自身免疫性肝病者;药物性肝炎;长期免疫抑制剂治疗者,包括器官移植后患者;妊娠。另外排除化疗药物或免疫抑制剂使用导致的肝炎活动,排除核苷类似物停药导致的肝炎活动。
严重肝炎活动进展为肝衰竭的诊断标准,参照2006年我国的《肝衰竭诊疗指南》[3]:出现以下表现者:①极度乏力,有明显的消化道症状。②黄疸迅速加深,TB ≥正常值上限10倍或每日上升≥17.1 μmol/L。③PTA≤40%并排除其他原因者。
收集患者的临床指标:包括ALT、谷草转氨酶(AST)、TB、PTA、白蛋白(ALB)、白细胞(WBC)、血小板(PLT)、肌酐(Cr)和HBV DNA定量。收集血清,鉴定BCP(A1762T/G1764A)变异、PC(G1896A)变异及HBV基因型。
1.2HBV BCP和PC变异检测 扩增方法如下:取HBV DNA 2 μL,用引物Is2-2(5′-CATGGAGACCAC CGT GAACGC-3′)和P35(5′-TGATAAGATAGGGGCATTTG-3′)扩增HBV PreC/C区。反应总体积为20 μL;扩增条件为94 ℃预变性1 min;然后94 ℃变性25 s,55 ℃退火25 s,72 ℃延伸50 s,共循环35圈;最后72 ℃再延伸5 min。取第1轮PCR产物2 μL,用引物P9和P35进行半巢式PCR扩增。反应总体积为20 μL;扩增条件为94 ℃预变性1 min;然后94 ℃变性20 s,55 ℃退火25 s,72 ℃ 延伸40 s,共循环35圈;最后72 ℃再延伸5 min。取第2轮PCR产物3 μL,用1%的琼脂糖凝胶进行电泳,紫外灯下观察。序列测定取扩增成功且产物带明显的样本以引物Is2-2送测序。对于扩增阴性的标本,换用引物P1(5′-TTTTTCACCTCTGCCTAATCA-3′)和P35进行第1轮扩增,用P1和HC24R(5′-CCTGAGTGCTGTATGGTGAGG-3′)进行半巢式第2轮扩增。测序工作由广州英骏公司完成,测序仪为ABI 3730。
1.3HBV基因分型鉴定 用PCR限制性片段长度酶切法(PCR-RFLP)按文献所述进行[8]。取抽提的DNA3 μL, 先用1 对外引物BS1 (5′-CCTG CTGGTGGCTCCAGTTCC-3′)和Pol2 (5′-CGGGCAACGGG GTAAAGGTTC-3′)进行第一 轮PCR 扩增;再用1 对内引物YS1(5′- GCGGGGTTTTTCTT GTT GA-3′)和YS2 (5′-GGGACTCAAGATGTTGTACA-3′)进行第2轮PCR扩增。PCR 产物分别用内切酶StyI和BsrSI进行酶切。两种酶切产物同时在2.5%的琼脂糖凝胶上进行电泳,紫外灯下观察PCR产物酶切情况,根据图谱分型:如果BsrSI可切的,StyI不可切,为B;如果BsrSI不可切的,StyI可切,为C;均切动或均切不动取扩增产物送测序。
1.4统计方法 统计学分析采用SPSS 13.0 软件。运用Logistic回归单因素分析各研究变量与研究结果的关系,并计算优势比(OR)及95%可信区间(CI)。单因素分析有显著统计学意义的变量进行二分类Logistic分析,筛选出相关的危险因素。P<0.05 为有统计学差异。
2 结 果
2.1严重肝炎活动患者的临床及病毒学资料 调查69例严重肝炎活动的患者,其中62例患者既往未接受或不规范短期使用核苷类似物治疗,此次使用拉米夫定(LMD)或恩替卡韦(ETV)治疗,7例患者既往曾使用LMD耐药,此次加用阿德福韦酯(ADV)或代丁治疗。治疗中以内科治疗为主,均未进行肝移植;其中有3例患者进行了2~3次血浆替换治疗,1例存活,2例死亡;1例患者在病程早期应用2天甲强龙冲击治疗。69例患者中,63例男性,6例女性;年龄33岁(20-54) [中位数(最小值-最大值)]。发病时临床资料为:ALT 343 IU/L (18~2481),AST 207 IU/L (41~1359),ALB 33 g/dL (25.2~43.6),TB 224 μmol/dL (39.2~704.0),PTA 40.5%(8~138),Cr74 μmol/dL (49~436),PLT计数 160×1012/L (42~348),WBC计数 6.2×109L-1(2.3~13.4),HBV DNA定量5.4lg copies/mL (3.00~9.11)。40例(40/69, 58%)患者为HBeAg阴性。基因型以B型和C型多见,其中以基因B型为主(46/65, 70.8%);有2例患者为基因D型。68例患者鉴定了PC(G1896A)变异,其中PC变异率为54.4%;52例患者鉴定了BCP(A1762T/G1764A)变异,BCP变异率为42.3%;其中9例患者同时发生BCP和PC变异。
2.2严重肝炎活动进展为肝衰竭的预测因素 通过Logistic回归单因素和多因素分析与严重肝炎活动进展成肝衰竭相关的指标(表1)。单因素分析显示TB>256 μmol/dL、PTA<40%与严重肝炎活动进展为肝衰竭相关。单因素分析中有统计学意义的指标TB及PTA纳入多因素分析,通过多因素分析显示:T >256 μmol/dL (P=0.008)、PTA <40%(P<0.001) 是严重肝炎活动进展为肝衰竭的危险因素。而与进展为肝衰竭相关的其他指标中,HBeAg阴性的优势指数OR为4 826.370,P=0.065;PC变异的优势指数OR=0.033,P=0.090。

表1 严重肝炎活动进展成肝衰竭相关的因素分析
2.3严重肝炎活动患者与结局相关的因素 在69例严重肝炎活动的患者中,有33例(47.8%)患者进展为肝衰竭,均未实施肝移植,有15例(21.7%)患者在住院期间或随访3个月后死亡。分析与预后相关的指标见表2。单因素分析显示与严重肝炎活动预后不良相关的指标包括:TB>256 μmol/dL,PTA<20%。多因素分析显示PTA <20%(P=0.006)是严重肝炎活动患者死亡的危险因素。严重肝炎活动患者中PTA<20%的患者共11例,临床及病毒学资料见表3。发病时临床资料为:ALT 601 IU/l (50~1 482),TB 452 μmol/dL (122.7~591.9),ALB 30.9 g/dL (25.4~37.1)。基因B型为主(8/11),6例(6/11)患者为HBeAg阴性。6例(6/11)患者发生PC(G1896A)变异,6例(6/9)发生BCP变异,其中3例患者同时发生BCP和PC变异。9例(9/11)患者死亡。
3 讨 论
每年有超过30%的慢性乙型肝炎患者出现肝炎活动[4],其中部分严重肝炎活动进展为肝衰竭;评估严重肝炎活动进展成肝衰竭的风险对于早期治疗和干预非常重要。本研究通过调查由严重肝炎活动快速进展为肝衰竭的临床和病毒学指标,筛选预测进展为肝衰竭的指标。研究中所收集的严重肝炎活动的病例,根据临床指标显示TB中位数224 μmol/dL、PTA中位数40.5%,提示患者的病情均较重,因此进展成肝衰竭的风险高,这与以往的研究中选择慢性乙型肝炎患者作为对照不同,所以能更好的提供进展成肝衰竭的预测因素。
在严重肝炎活动进展为肝衰竭的指标中,多因素分析显示TB>256 μmol/dL、PTA<40%是严重肝炎活动预后不良的因素,与进展为肝衰竭相关。日本Yoshiba[5]筛选出的早期诊断肝衰竭的判别公式中,同样也显示TB的水平与肝衰竭的发生率呈正相关。本研究进一步筛选与严重肝炎活动预后相关的指标,显示凝血功能的进一步恶化(PTA<20%)与患者的死亡相关。而作为评价终末期肝病存活率的MELD评分中[6-7]也包含反应凝血功能的指标:国际标准化比率(INR)。根据2008年亚太肝病学会慢加急性肝功能衰竭专家组意见将血清总胆红素(TB≥85 μmol/dL)及凝血障碍(PTA<40%)作为诊断肝衰竭的必要条件[8];故血清TB及PTA可作为临床上判断严重肝炎活动患者病情及预后的重要指标。
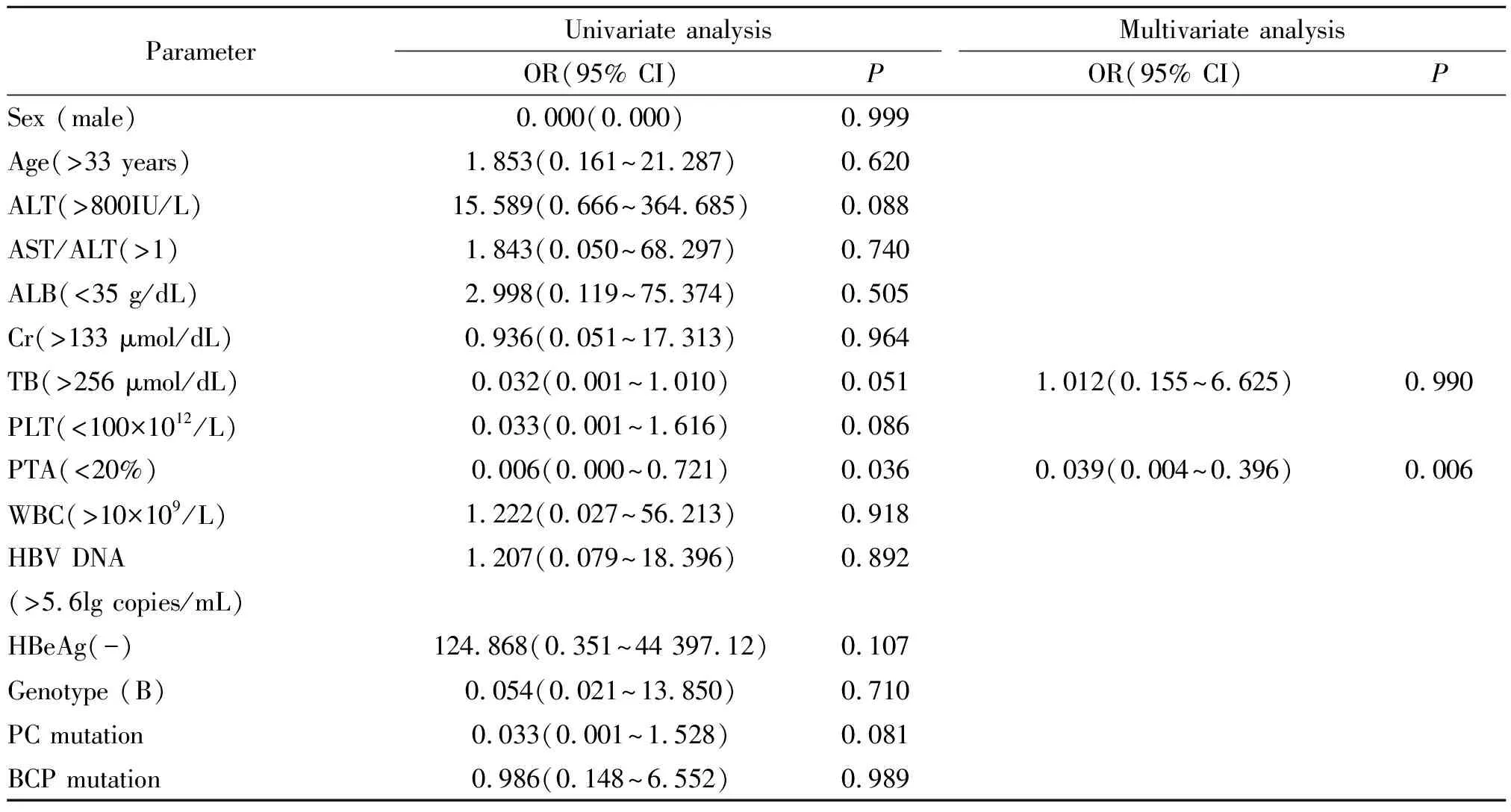
表2 严重肝炎活动患者与预后相关的因素分析
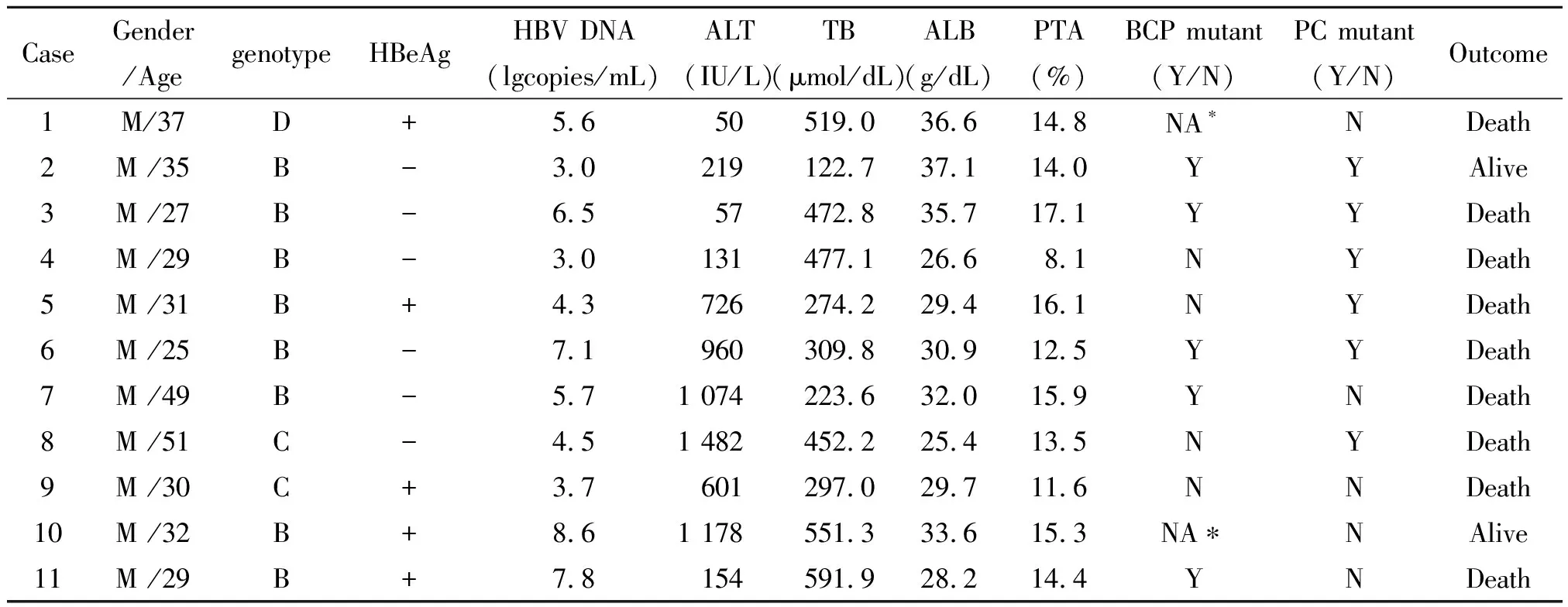
表3 严重肝炎活动患者中PTA<20%的患者资料
在严重肝炎活动发展为肝衰竭的其他预测指标中,HBeAg阴性(OR 4826.370,P=0.065)、PC变异(OR 0.033,P=0.090)表现与病情的恶化有一定相关性。在所调查的严重肝炎活动患者HBeAg阴性率高达58%;且发生PC变异的患者也明显增多,PC变异率(37/68, 54.4%)与同期所收集的44例慢性乙型病毒性肝炎患者(8/44,18.2%)[9]比较有统计学差异(P<0.001)。且基因B型的比率也较同期收集的慢性乙型肝炎患者增高[70.8%(46/65) vs. 50%(22/44);P=0.002],而基因B型更易发生PC变异[11]。PC发生变异后,在前C末端产生终止密码子,使HBeAg不能合成,导致HBeAg阴性。HBeAg作为耐受原,通过使Th1辅助细胞耗竭来抑制Th1细胞发动CTL攻击感染肝细胞的能力;而当HBeAg分泌的减少后,机体免疫耐受的状态被打破,使受感染的肝细胞更容易受到攻击;从而出现肝细胞坏死,临床上表现为肝炎发作[10],严重者进展成肝衰竭。
BCP变异未显示与预后高的相关性(OR 0.986,P=0.989),考虑在本研究中所调查的人群中基因C型的比例少19.2%(19/65),而BCP变异更易发生在基因C型的患者中所致[11]。但调查显示BCP变异率也高达42.3%,且在11例PTA<20%的患者共6例(6/9)发生BCP变异,所以在以后的研究中,通过扩大样本量,可以能更好反映BCP变异与预后的关系。
综上所述,由此显示总胆红素升高及凝血功能障碍在预测HBV相关的严重肝炎活动进展为肝衰竭中有显著的意义。而HBeAg阴性引起免疫耐受被打破,机体免疫状态发生改变,可能作为导致肝炎发作的原因之一。
参考文献:
[1]Liang X, Bi S, Yang W, et al. Epidemiological serosurvey of hepatitis B in China--declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2009, 27(47): 6550-6557. DOI: 10.1016/j.vaccine.2009.08.048
[2]Ozasa A, Tanaka Y, Orito E, et al. Influence of genotypes and precore mutations on fulminant or chronic outcome of acute hepatitis B virus infection[J]. Hepatology, 2006, 44(2): 326-334.DOI:10.1002/hep.21249
[3]Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Diseases and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Diagnostic and treatment guidelines for liver failure[J]. Chin J Hepatol, 2006, 14(9): 643-646. (in Chinese)
中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南[J].中华肝脏病杂志, 2006, 14(9): 643-646.
[4]Wong VW, Wong GL, Yiu KK, et al. Entecavir treatment in patients with severe acute exacerbation of chronic hepatitis B[J]. J Hepatol, 2011, 54(2): 236-242. DOI: 10.1016/j.jhep.2010.06.043
[5]Yoshiba M, Sekiyama K, Inoue K, et al. Accurate prediction of fulminant hepatic failure in severe acute viral hepatitis: multicenter study[J]. J Gastroenterol, 2002, 37(11): 916-921. DOI: 10.1016/S0022-5223(99)70472-1
[6]Kamath PS, Kim WR. The model for end-stage liver disease (MELD)[J]. Hepatology, 2007, 45(3): 797-805. DOI: 10.1002/hep.21563
[7]Tripodi A, Chantarangkul V, Primignani M, et al. The international normalized ratio calibrated for cirrhosis (INR(liver)) normalizes prothrombin time results for model for end-stage liver disease calculation[J]. Hepatology, 2007, 46(2): 520-527. DOI: 10.1002/hep.21732
[8]Satin SK, Kumar A, Almeida JA, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL)[J]. Hepatol Int, 2009, 3(1): 269-282. DOI: 10.1007/s12072-008-9106-x
[9]Yang L, Ma S, Hu X, et al. Presence of valine at position 27 of the hepatitis B virus core gene is associated with severe liver inflammation in Chinese patients[J]. J Med Virol, 2011, 83(2):218-224. DOI: 10.1002/jmv.21944.
[10]Hou J, Lin Y, Waters J, et al. Detection and significance of a G1862T variant of hepatitis B virus in Chinese patients with fulminant hepatitis[J]. J Gen Virol, 2002, 83(9): 2291-2298.
[11]Yuen MF, Sablon E, Yuan HJ, et al. Significance of hepatitis B genotype in acute exacerbation, HBeAg seroconversion, cirrhosis-related complications, and hepatocellular carcinoma[J]. Hepatology, 2003, 37(3): 562-567. DOI: 10.1053/jhep.2003.50098
