真核翻译起始因子4E
2014-04-08潘琦崔国峰袁绍辉毕郑刚
潘琦 崔国峰袁绍辉 毕郑刚
(哈尔滨医科大学附属第一医院骨科,哈尔滨 150001)
真核翻译起始因子4E
潘琦 崔国峰*袁绍辉 毕郑刚**
(哈尔滨医科大学附属第一医院骨科,哈尔滨 150001)
真核翻译起始因子 4E(eukaryotic translation initiation factor 4E,eIF4E)在肿瘤形成和进展过程中起重要作用。目前,直接或间接针对eIF4E的治疗药物的研究已取得很大进展。深入了解 eIF4E 的功能及其在翻译起始阶段调节肿瘤形成的作用,为更好地研制新型有效的抗肿瘤药物提供理论依据。
1 eIF4E与翻译调控
在核糖体的参与下合成成熟mRNA序列的过程是高度调控的,需要游离40S核糖体亚基、mRNA及真核翻译起始因子 4F(eIF4F)翻译起始复合物的共同作用。eIF4F 是一个三聚体复合物,包括:① 真核翻 译起始因 子 4E(eIF4E),mRNA 5'端帽结合 蛋 白;② 真核翻译起始因子 4A(eIF4A),RNA 解螺旋酶;③ 真核翻译起始因子 4G(eIF4G),是一个支架分子。大多数真核mRNAs通过帽依赖性机制进行翻译,在翻 译 过 程 中 ,eIF4E 识 别 mRNA 的 5'端 帽 结 构[1]。eIF4E受到转录在内的多个水平的调节,包括丝氨酸209(S209)的磷酸化以及 eIF4E 翻译抑制蛋白(eIF4E binding ptoteins,4EBPs)的抑制作用(图 1)。当缺氧、DNA损伤和致癌刺激发生时,通过快速激活eIF4E调节翻译。
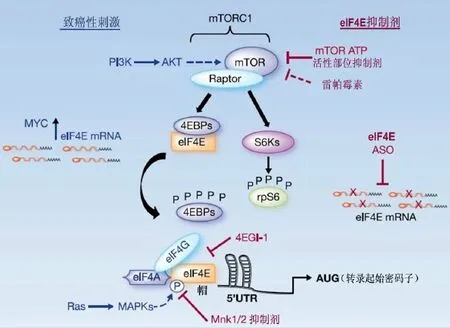
图 1 4EBP/eIF4E 信号传导示意图[5]
eIF4E 翻译 抑制 蛋 白 1-3(4EBP1-3)与 eIF4G 竞争性结合 eIF4E。低磷酸化状态时,4EBPs通过抑制eIF4G 与 mRNA 5'端帽结构的结合,从 而 限制 eIF4F复合体的形成(图1)。当发生有丝分裂时,在生长因子和细胞因子的刺激下,4EBPs磷酸化丝氨酸/苏氨酸残基,导致构象改变,释放 eIF4E,结合 eIF4G。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)作为初级激酶磷酸化 4EBPs,导致 eIF4E与4EBPs分离。
S209 磷酸化eIF4E在肿瘤发生过程中起至关重要的作用,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)和 丝 氨 酸/苏氨 酸激 酶等 信号整合激酶(signal-integrating kinase,Mnk)相互作用(Erk1/2 和 p38 MAPKs 的底物)催化 eIF4E 磷酸化[2]。磷酸化eIF4E的作用具有上下依赖性。稳定状态下,在细胞生长过程中,Mnk1/2基因敲除小鼠未表现出任何明显的缺陷[3]。然而,磷酸化的 S209 在体外可激活 eIF4E,在体内可增强致癌基因MYC的活性,促进肿瘤发生[4]。上述研究证实,如果在癌变过程中出现内源性 eIF4E S209 磷酸化,那么 eIF4E 的突变体将会过度表达。此时,eIF4E 磷酸化在正常组织中并无明显的功能,但可提高翻译速率,有利于肿瘤形成。
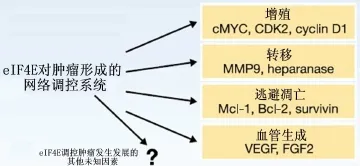
图 2 eIF4E 参与肿瘤形成过程的示意图[5]
eIF4E 与 eIF4F 复合体诱导致癌基因转化的确切机制尚存争议。然而,eIF4E 与 eIF4F 复合体通过增强部分mRNAs小分子团的转录参与肿瘤的形成过程,如细胞增殖、逃避凋亡、血管形成和转移[6]。这些mRNAs小分子团包括 cMYC(MYC 家族中的一员),细胞周期蛋白 D1(cyclin D1),细胞周期蛋白依赖性激酶 2(cyclin-dependent kinase 2,CDK2);Mcl-1,Bcl-2和生存素(survivin);血管内皮生长因子(vascular endothelial growth factor,VEGF),成纤维细胞生长因子 2(fibroblast growth factor 2,FGF2);基质金属蛋白酶 9(matrix metalloproteinase 9,MMP9),乙 酰 肝 素 酶(heparanase)(图 2)。其转录产物是富含 G/C 以及长5'UTR 的发夹结构,需要 eIF4A 解螺旋酶的作用才能结合核糖体40S亚基。这些mRNAs缺乏转录能力,并且需要依赖更多的eIF4E才能增强转录并严格调控蛋白质表达,因此亦被称为“弱”mRNA。当存在致癌性刺激时,通过增强 eIF4E 的活性,增加 eIF4F 复合体的形成和增强 eIF4A 解螺旋酶的活性,这些“弱”mRNA的转录增强,从而提高转录速率。其结果是mRNAs小分子团有选择性的激活,以促进肿瘤的发生发展(图2)。许多目标产物均与细胞内eIF4E的过度表达有关,然而,只有一部分目标产物在接近生理状态下的体内肿瘤模型中得到证实,所以与eIF4E相关的目标产物在肿瘤形成和发展过程中的确切作用机制尚不明确。eIF4E 相关的目标产物在不同的组织类型中表达可能不同,增加了eIF4E调控转录、促进肿瘤形成的复杂性。
2 eIF4E 在肿瘤发生发展中的作用
体内和体外实验已经证实,eIF4E在肿瘤发生发展中起重要作用。过度表达的eIF4E足以诱导转化成纤维细胞和上皮细胞[7]。eIF4E 在体内过度表达,增加癌症易感性;eIF4E转基因小鼠可发展成为淋巴瘤 、恶 性 血 管 内 皮 细 胞 瘤 、肺 癌 和 肝 癌[8]。 此 外 ,eIF4E的过度表达可以克服致癌基因MYC诱导的细胞凋亡,表明 eIF4E 具有内在的致癌活性,可以克服MYC 诱 导 产 生 的 细 胞 凋 亡[8,9]。 人 类 乳 腺 癌 中 发 现eIF4E 过度表达[10]。此外,eIF4E 的表达水平是诊断头颈部肿瘤和判断其预后的生物标志物[11]。
尽管细胞内eIF4E 活性增加本身就具有致癌性,但常见的信号传导通路(在人类癌症中发生严重的突变或扩增)可直接影响eIF4E的活性。例如,cMYC和MMP9的过度表达可促进eIF4E的过度表达,进而鼻 咽癌细胞 生长[12]。通 过 mTOR 抑制 rpS6(mTOR 下游区的另一个受体)的磷酸化不能降低肿瘤的发生率,因此,在 mTOR 下游区,4EBP1/eIF4E 在肿瘤形成中 起主要作用[13]。 在 神经祖细胞中,激 活致癌基因Ras(Mnk激酶上游区的调节基因)和PKB信号通路可诱导形成多形性胶质母细胞瘤(glioblastoma multiforme,GBM)[14]。 然 而,eIF4E 过 度激活可 否 直接作用于下游区的致癌基因 MYC和 Ras,从而促进肿瘤进展仍尚不明确。体内试验研究表明,通过作用于下游区的致癌基因PKB,可阻止eIF4E的过度活化,抑制肿瘤细胞的生长[13]。eIF4E 是一个重要的致癌基因,并且靶向调节癌基因的转录,反常调节MYC、PI3K/PKB/mTOR 和 Ras 的 过 度表 达(图 1)。 因 此 ,eIF4E是治疗人类癌症的新靶点。
3 eIF4E 在人类癌症中的临床意义
在多种常见的肿瘤中出现eIF4E的过度表达,如恶性肿瘤、前列腺癌、乳腺癌以及胃、结肠、肺、皮肤和造血系统的肿瘤。eIF4E 的表达增加与疾病的严重程度密切相关[15-20]。此外,在乳腺癌和前列腺癌中观察到,eIF4E总的升高水平和过度磷酸化的4EBP1可促进 eIF4E 与 eIF4G 的结合,增强帽依赖性翻译[15,16]。在大多数人类恶性肿瘤中可出现反常的eIF4E激活,因而 eIF4E 的升高水平可作为生物学标志物预测病情进展、总的生存期和治疗后复发情况。在人类乳腺癌患者中观察到,新辅助化疗后,eIF4E的水平降低,无病生存率得到改善[21]。在无淋巴结转移的乳腺癌 患者中 ,eIF4E 的 表达增高 ,复发 的 危险性 增加 2倍,死亡的危险性增加 4 倍[17]。在雌激素受体(ER)、孕 激 素 受 体(PR)和人表皮生长因子 受 体 2(HER2)阴性的乳腺癌患者中出现高水平的 eIF4E 以及磷酸化的 4EBP1,乳腺癌复发的几率明显增加[22,23]。在前列腺癌患者中,eIF4E 的表达升高以及4EBP1的磷酸化增加,患者的预后较差[15]。上述研究表明,eIF4E 的表达水平以及4EBP1的磷酸化水平可间接判断临床肿瘤患者的预后。此外,这些生物性标志物也可预测eIF4E 靶向治疗患者的治疗效果。由于缺乏足够的匹配组织标本,eIF4E的临床研究受到限制。虽然一些研究表明,在转移的标本中发现高水平的 eIF4E,但目前尚无连续测定同一患者从诊断到转移整个过程中组织中的eIF4E表达情况的报道,而这将有助于进一步了解转移过程中的转录调控作用以及确定eIF4E靶向治疗转移灶的效果。
4 临床转化进展
4.1 mTOR ATP 活性部位抑制剂
mTOR靶向治疗是一种抑制eIF4E过度激活的治疗方法,因为4EBPs是mTOR激酶的直接底物(图1)。mTOR是一种蛋白质激酶,当激活时可形成两个不同的多聚体激酶:mTORC1和mTORC2。mTORC1 的作用底物是 4EBPs和 S6Ks,mTORC2主要在 S473部位磷酸化PKB。第一代mTOR异构抑制剂如雷帕霉素、RAD001 和 CCI-779 治疗许多人类癌症的效果并不显著,尽管在实验中已证实其确切的疗效。存在这种差异的主要原因是由于应用磷酸化激活S6Ks和 rpS6,使mTOR发挥主要的抑制作用。在几乎所有类型的细胞中,雷帕霉素是一种强效的S6Ks磷酸化抑制剂。由此得出第一代mTOR抑制剂抑制S6激酶和rpS6的磷酸化可抑制所有 mTOR激酶的功能。而最近有研究表明,雷帕霉素和其相关的类似物抑制mTOR下游区的靶向部位,特别是4EBP1的磷酸化存在 不 一 致 性[13,24]。 在 PKB 诱 导 的 淋 巴 瘤 中 ,磷 酸 化4EBP1是肿瘤形成的必要环节,而 rpS6的磷酸化是可有可无的[13]。因此,持续激活致癌基因 mTOR 下游区的 4EBP1/eIF4E 可能是临床上雷帕霉素及其相关类似物治疗失败的主要原因。
为了解更多的mTOR抑制剂,目前报道了一系列 mTORC1 和 mTORC2 ATP 活 性 部 位 抑 制 剂 ,如PP242、Torin1、WYE-132、Ku-0063794、Palomid 529和 AZD8055[25-30]。 所 有 这 些 化 合 物 在 催 化 mTOR 的同时,与ATP竞争性结合mTOR的催化区。与mTOR异构抑制剂雷帕霉素不同,这些化合物主要抑制S6Ks磷酸化,其中 PP242可有效的阻止4EBP1、rpS6和PKB的磷酸化。在小鼠和人的细胞中,这些化合物 与 雷 帕 霉 素 相 比 能 够 显 著 地 发 挥 抗 增 殖 作 用[25]。此外,在小鼠胚胎成纤维细胞中发现 PP242 和 Torin1具有抗增殖作用,通过作用于不稳定的mTORC2复合 物 ,使 S473 部 位 的 PKB 无 法 磷 酸 化[25,26]。 因 此 ,mTOR ATP活性部位抑制剂的抗肿瘤作用是通过抑制 4EBP1/eIF4E 实现的,从而减少帽依赖性翻译。然而,在其他细胞中,这些研究结果不排除抑制S6Ks和PKB磷酸化后有助于mTOR ATP 活性部位抑制剂发挥有效的抗肿瘤作用的可能性。
多种新研发的ATP活性部位抑制剂预计在未来几 年 将用 于Ⅰ 期临 床试 验。 目前 PP242 和 INK128(NCT01058707,NCT01118689)已用于晚期实体瘤以及多发骨髓瘤患者的Ⅰ期临床试验。AZD2014(NCT01026402)的安全性、耐受性和药代动力学也正处于研究中。Palomid 529(NCT01033721)以尝试用 于 年 龄 相 关 性 黄 斑 变 性 的 患 者 。 双 重 PI3K/ mTOR ATP 模 拟 抑 制 剂(BEZ235,PF-04691502,XL765)目前正处于临床调查阶段。然而,由于PI3K激活多个目标,这些双重抑制剂则完全依赖于抑制eIF4E 的过度激活,所以疗效并不确切。此外,作为双激酶抑制剂,也有可能是针对mTOR而起到抗癌作用,并且相关的毒性降低。
4.2 eIF4E-eIF4G抑制剂4EGI-1
eIF4E 的背侧表 面 是 eIF4G 的 结合部位(图 1)。eIF4G 与 eIF4E 结合后通过 eIF4A 和 eIF3-40S 核糖体亚基共同作用,增加帽依赖性翻译。靶向调节eIF4E-eIF4G 蛋白质间的相互作用是抑制帽依赖性翻译的一个作用机制。eIF4G 有一个 Y(X)4LF序列(其中 X是可变的,F 是疏水性的),与eIF4E背侧表面保守的疏水残基结合[31]。研究表明,突变的 Y(X)4LF 序列阻止 eIF4F 复合体的形成。由于 eIF4G 与 eIF4E 背侧表面保守的疏水残基结合,针对这些相互作用的化学 抑 制 剂 可 防 止 eIF4F 复 合 体 的 形成 ,从 而 降 低eIF4E过度激活后出现的异常蛋白质合成。
通过绑定免疫荧光肽,以抑制 Y(X)4LF 序列与eIF4E的结合,使用高流通量荧光偏振法发现候选化合物。微摩尔浓度的 4EGI-1 能够抑制 eIF4F 复合体的 形 成。 由 于 eIF4G 和 4EBP1 都 具 有 Y(X)4LF 序列 ,推测 4EGI-1 也有 可 能抑制 4EBP1/eIF4E 复 合物的形成,而实际上 4EGI-1 仅抑制 eIF4E 与 eIF4G 间的相互作用。4EGI-1 是具有细胞毒性的抑制细胞生长剂,跨多个细胞系抑制细胞增殖,与未转化细胞相比 ,显 著 克 隆 生 长 已 转 化 的 细 胞[32,33]。 目 前 ,4EGI-1化合物作为一种研究性新药尚未正式应用于临床。
迄今为止,尚无足够证据表明不能中断或抑制其它蛋白质和蛋白质之间的相互作用,由此可引发出更多致癌途径抑制剂发挥抗肿瘤作用。最近,这一发现得到研究结果的证实,通过 eIF4G/eIF4E 复合物独立作用机制以及蛋白酶介导的降解抗凋亡基因C-FLIP,4EGI-1 可以诱导细胞凋亡[34]。此外,微摩尔的 4EGI-1 即可降低细胞的增殖和诱导细胞凋亡,使该化合物小剂量应用于临床成为可能。
4.3 eIF4E ASOs
在多种人类恶性肿瘤中出现了eIF4E的过度表达 并具有 一定的 致 癌性 ,ASOs直 接 作用于 eIF4E mRNA已得到广泛的研究,并试图作为一种抗癌剂应用于临床。ASOs靶向识别和杂交mRNA并触发核糖核酸酶 H(RNase H)介导的 RNA 破坏。第一代ASOs由于缺乏核酸酶(nuclease)抗药性,导致其在体内的半衰期相对较短,疗效显著减低。而第二代ASOs的疗效、核酸酶抗药性及组织半衰期显著提高。ASOs降低eIF4E的表达水平,在纳摩尔浓度的情况下即可对人类肿瘤细胞株产生细胞毒性作用[15,35]。在肿瘤异种移植小鼠模型中采用 5、12.5 和 25 mg/kg的 eIF4E ASOs每周 3 次治疗的结果显示,移植肿瘤生长显著,且无明显的体重降低和肝毒性[35]。目前,eIF4E ASOs LY2275796(NCT00903708)剂量递增的Ⅰ期临床试验正在进行。上述发现将有助于进一步理解 eIF4E 的生理功能和致癌作用。特别需要指出的 是,在 eIF4E ASOs 治疗 的 异种移 植 小鼠中 发 现,eIF4E 的降低水平>50%,表明低水平的 eIF4E 在正常组织中的耐受性,而具有高水平eIF4E的肿瘤细胞可能对eIF4E抑制剂特别敏感。
4.4 抑制eIF4E磷酸化:Mnk 激酶抑制剂
从理论上讲,抑制eIF4E磷酸化将是抗肿瘤的一个新途径。然而,实验研究表明化学抑制剂如 eIF4E S209和Mnk1/2的疗效有限。例如,靶向调节突变的eIF4E S209 部 位 可 显 著 抑 制 小 鼠 胚 胎 成 纤 维 细 胞(NIH3T3)中 eIF4E 的转化,但靶向抑制剂 Mnk1/2 是否也有同样的疗效尚不明确[36]。此外,Mnk 激酶抑制剂 CGP57380 在 人 类(chronic myelogenous leukemia, CML)的治疗中已显示出有限的抗增殖作用。然而,当其和伊马替尼(imatinib)联合使用时,确实提高抗增殖和抗凋亡作用[37]。虽然有多种 Mnk 激酶抑制剂,但目前尚无任何临床数据表明其在人类癌症治疗中的疗效。
4.5 靶向调节eIF4E5'端帽结构
用于抗病毒治疗的利巴韦林(Ribavirin)是一种鸟苷核糖核苷类似物,通过与 5'端 7-甲基鸟嘌呤帽结构 竞 争 性 结 合 内 源 性 eIF4E 而 发 挥 部 分 抗 肿 瘤 作用。在急性粒细胞白血病(acute myelogenous leukemia,AML)和以鳞状细胞癌为细胞基础的动物模型中发现,利巴韦林减少 eIF4F 复合体的形成[38]。一项采用剂量递增的利巴韦林治疗11例AML的Ⅰ期临床试验研究结果显示,1例完全缓解,2例部分缓解,4例病情稳定[39]。目前,利巴韦林已用于转移性乳腺癌和 M4/M5 混 合 型 AML 患 者 的 Ⅰ 、Ⅱ 期 临 床 试 验(NCT01056757,NCT01056523)。尽管这些研究显示利巴韦林在人类癌症中的显著疗效,但利巴韦林的具体作用机制和作为帽结构竞争性结合内源性eIF4E 而发挥抗肿瘤作用是两个独立的问题[40-42]。如果其主要通过抑制帽依赖性翻译而发挥抗肿瘤作用,那么疗效是不确定的。
5 未来的研究趋势和注意事项
eIF4E 与翻译起始是抗癌治疗的新靶点。除已经提到过的靶向抑制剂外,研究显示,其他不同点的抑 制 剂 如 Silvesterol通 过 抑 制 eIF4A RNA 解 旋 酶 而发挥抗肿瘤作用[43]。未来的临床实验研究应着重于设立前瞻性随机对照研究分析患者eIF4E的总水平、4EBP1的磷酸化水平以及eIF4E的磷酸化水平。
综上所述,虽然多个基因抑制eIF4E的活性(图1),但 eIF4E 介导的肿瘤形成和发生发展的确切机制仍知之甚少。肿瘤的发生发展过程可能是与 eIF4E 相关的多个靶向调节相互作用的结果,这取决于肿瘤的类型、分级和是否存在转移。因此,eIF4E mRNAs致癌活性抑制剂将成为未来治疗肿瘤的新靶点,而eIF4E将作为新的生物标志物,用于判断预后和评估抗癌治疗的疗效。随着 mTOR ATP 活性部位抑制剂 、eIF4E-eIF4G 抑 制剂 4EGI-1 和 eIF4E ASO 抑制eIF4E 磷酸化:Mnk 激酶抑制剂和靶向调节 eIF4E 5'端帽结构等新药的研发,将为恶性肿瘤的治疗开辟广阔的前景。
[1]Hernández G,Miron M,Han H,et al.Mextli is a novel eukaryotic translation initiation factor 4E-binding protein that promotes translation in drosophila melanogaster.Mol Cell Biol,2013,33(15):2854-2864.
[2]Shveygert M,Kaiser C,Bradrick SS,et al.Regulation of eukaryotic initiation factor 4E(eIF4E)phosphorylation by mitogen-activated protein kinase occurs through modulation of Mnk1-eIF4G interaction.Mol Cell Biol,2010,30(21): 5160-5167.
[3]Ueda T,Watanabe-Fukunaga R,Fukuyama H,et al.Mnk2 and Mnk1 are essential for constitutive and inducible phosphorylation of eukaryotic initiation factor 4E but not for cell growth or development.Mol Cell Biol,2004,24(15): 6539-6549.
[4]Wendel HG,Silva RL,Malina A,et al.Dissecting eIF4E action in tumorigenesis.Genes Dev,2007,21(24):3232-3237.
[5]Hsieh AC,Ruggero D.Targeting eukaryotic translation initiation factor 4E(eIF4E)in cancer.Clin Cancer Res,2010,16 (20):4914-4920.
[6]Silvera D,Formenti SC,Schneider RJ.Translational control in cancer.Nat Rev Cancer,2010,10(4):254-266.
[7]Avdulov S,Li S,Michalek V,et al.Activation of translation complex eIF4F is essential for the genesis and maintenance of the malignant phenotype in human mammary epithelial cells.Cancer Cell,2004,5(6):553-563.
[8]Ruggero D,Montanaro L,Ma L,et al.The translation factor eIF-4E promotes tumor formation and cooperates with c-Myc in lymphomagenesis.Nat Med,2004,10(5):484-486.
[9]Wendel HG,De Stanchina E,Fridman JS,et al.Survival signalling by Akt and eIF4E in oncogenesis and cancer therapy.Nature,2004,428(6980):332-337.
[10]Pettersson F,Yau C,Dobocan MC,et al.Ribavirin treatment effects on breast cancers overexpressing eIF4E,a biomarker with prognostic specificity for luminal B-type breast cancer.Clin Cancer Res,2011,17(9):2874-2884.
[11]Gao W,Li JZ,Chan JY,et al.mTOR Pathway and mTOR Inhibitors in Head and Neck Cancer.ISRN Otolaryngol, 2012,2012:953089.
[12]Wu M,Liu Y,Di X,et al.EIF4E over-expresses and enhances cell proliferation and cell cycle progression in nasopharyngeal carcinoma.Med Oncol,2013,30(1):400.
[13]Hsieh AC,Costa M,Zollo O,et al.Genetic dissection of the oncogenic mTOR pathway reveals druggable addiction to translational control via 4EBP-eIF4E.Cancer Cell,2010, 17(3):249-261.
[14]Rajasekhar VK,Viale A,Socci ND,et al.Oncogenic Ras and Akt signaling contribute to glioblastoma formation by differential recruitment of existing mRNAs to polysomes. Mol Cell,2003,12(4):889-901.
[15]Graff JR,Konicek BW,Lynch RL,et al.eIF4E activation is commonly elevated in advanced human prostate cancers and significantly related to reduced patient survival.Cancer Res,2009,69(9):3866-6873.
[16]Coleman LJ,Peter MB,Teall TJ,et al.Combined analysis of eIF4E and 4E-binding protein expression predicts breast cancer survival and estimates eIF4E activity.Br J Cancer, 2009,100(9):1393-1399.
[17]Holm N,Byrnes K,Johnson L,et al.A prospective trial on initiation factor 4E(eIF4E)overexpression and cancer recurrence in nodenegative breast cancer.Ann Surg Oncol, 2008,15(11):3207-3215.
[18]Chen CN,Hsieh FJ,Cheng YM,et al.Expression of eukaryotic initiation factor 4E in gastric adenocarcinoma and its association with clinical outcome.J Surg Oncol,2004,86 (1):22-27.
[19]Wang R,Geng J,Wang JH,et al.Overexpression of eukaryotic initiation factor 4E(eIF4E)and its clinical significance in lung adenocarcinoma.Lung Cancer,2009,66(2):237-244.
[20]Salehi Z,Mashayekhi F,Shahosseini F.Significance of eIF4E expression in skin squamous cell carcinoma.Cell Biol Int,2007,31(11):1400-1404.
[21]Hiller DJ,Chu Q,Meschonat C,et al.Predictive value of eIF4E reduction after neoadjuvant therapy in breast cancer. J Surg Res,2009,156(2):265-269.
[22]Flowers A,Chu QD,Panu L,et al.Eukaryotic initiation factor 4E overexpression in triple-negative breast cancer predicts a worse outcome.Surgery,2009,146(2):220-226.
[23]Rojo F,Najera L,Lirola J,et al.4E-binding protein 1,a cell signaling hallmark in breast cancer that correlates with pathologic grade and prognosis.Clin Cancer Res,2007,13 (1):81-89.
[24]Choo AY,Yoon SO,Kim SG,et al.Rapamycin differentially inhibits S6Ks and 4E-BP1 to mediate cell-type-specific repression of mRNA translation.Proc Natl Acad Sci USA, 2008,105(45):17414-17419.
[25]Feldman ME,Apsel B,Uotila A,et al.Active-site inhibitors of mTOR target rapamycin-resistant outputs of mTORC1 and mTORC2.PLoS Biol,2009,7(2):e38.
[26]Thoreen CC,Kang SA,Chang JW,et al.An ATP-competi-tive mTOR inhibitor reveals rapamycin-insensitive functions of mTORC1.J Biol Chem,2009,284(12):8023-8032.
[27]Yu K,Shi C,Toral-Barza L,et al.Beyond rapalog therapy: preclinical pharmacology and antitumor activity of WYE-125132,an ATPcompetitive and specific inhibitor of mTORC1 and mTORC2.Cancer Res,2010,70(2):621-631.
[28]Garcia-Martinez JM,Moran J,Clarke RG,et al.Ku-0063794 is a specific inhibitor of the mammalian target of rapamycin(mTOR).Biochem J,2009,421(1):29-42.
[29]Xue Q,Hopkins B,Perruzzi C,et al.Palomid 529,a novel small-molecule drug,is a TORC1/TORC2 inhibitor that reduces tumor growth,tumor angiogenesis,and vascular permeability.Cancer Res,2008,68(22):9551-9557.
[30]Chresta CM,Davies BR,Hickson I,et al.AZD8055 is a potent,selective,and orally bioavailable ATP-competitive mammalian target of rapamycin kinase inhibitor with in vitro and in vivo antitumor activity.Cancer Res,2010,70(1): 288-298.
[31]Marcotrigiano J,Gingras AC,Sonenberg N,et al.Capdependent translation initiation in eukaryotes is regulated by a molecular mimic of eIF4G.Mol Cell,1999,3(6):707-716.
[32]Moerke NJ,Aktas H,Chen H,et al.Small-molecule inhibition of the interaction between the translation initiation factors eIF4E and eIF4G.Cell,2007,128(2):257-267.
[33]Tamburini J,Green AS,Bardet V,et al.Protein synthesis is resistant to rapamycin and constitutes a promising therapeutic target in acute myeloid leukemia.Blood,2009,114(8): 1618-1627.
[34]Fan S,Li Y,Yue P,et al.The eIF4E/eIF4G interaction inhibitor 4EGI-1 augments TRAIL-mediated apoptosis through c-FLIP Down-regulation and DR5 induction independent of inhibition of cap-dependent protein translation.Neoplasia, 2010,12(4):346-356.
[35]Graff JR,Konicek BW,Vincent TM,et al.Therapeutic suppression of translation initiation factor eIF4E expression reduces tumor growth without toxicity.J Clin Invest,2007, 117(9):2638-2648.
[36]Topisirovic I,Ruiz-Gutierrez M,Borden KL.Phosphorylation of the eukaryotic translation initiation factor eIF4E contributes to its transformation and mRNA transport activities.Cancer Res,2004,64(23):8639-8642.
[37]Zhang M,Fu W,Prabhu S,et al.Inhibition of polysome assembly enhances imatinib activity against chronic myelogenous leukemia and overcomes imatinib resistance.Mol Cell Biol,2008,28(20):6496-6509.
[38]Kentsis A,Topisirovic I,Culjkovic B,et al.Ribavirin suppresses eIF4E-mediated oncogenic transformation by physical mimicry of the 7-methyl guanosine mRNA cap.Proc Natl Acad Sci U S A,2004,101(52):18105-18110.
[39]Assouline S,Culjkovic B,Cocolakis E,et al.Molecular targeting of the oncogene eIF4E in acute myeloid leukemia (AML):a proof-ofprinciple clinical trial with ribavirin. Blood,2009,114(2):257-260.
[40]Westman B,Beeren L,Grudzien E,et al.The antiviral drug ribavirin does not mimic the 7-methylguanosine moiety of the mRNA cap structure in vitro.RNA,2005,11(10):1505-1513.
[41]Yan Y,Svitkin Y,Lee JM,et al.Ribavirin is not a functional mimic of the 7-methyl guanosine mRNA cap.RNA, 2005,11(8):1238-1244.
[42]Kentsis A,Volpon L,Topisirovic I,et al.Further evidence that ribavirin interacts with eIF4E.RNA,2005,11(12): 1762-1766.
[43]Cencic R,Carrier M,Galicia-Vazquez G,et al.Antitumor activity and mechanism of action of the cyclopenta[b]benzofuran,silvestrol.PLoS ONE,2009,4(4):e5223.
*共同第一作者
**通信作者:毕郑刚,E-mail:bizhenggang@54dr.com
