利用酱油废水生产微生物絮凝剂及其絮凝条件优化
2014-04-04李瑶瑶彭登科董新姣
李瑶瑶,彭登科,董新姣
(温州大学生命与环境科学学院,浙江 温州325035)
0 引言
微生物絮凝剂(MBF),是由微生物产生的可使液体中不易沉降的固体悬浮颗粒、菌体细胞及胶体颗粒等凝聚沉淀的特殊高分子物质,主要成分有糖蛋白、胞外多糖、蛋白质、纤维素和核酸等。微生物絮凝剂具有易生物降解,适用范围广,热稳定性强,用量小,无二次污染等优点,与传统的无机与有机高分子絮凝剂相比具有更广泛的应用前景。由于MBF不仅克服了无机和有机絮凝剂在使用安全和环境污染方面的问题,且易于实现工业化生产,所以MBF取代大部分传统的无机高分子和合成有机高分子絮凝剂将成为一种趋势[1~5]。但微生物絮凝剂目前存在生产条件较复杂、成本偏高等不足之处,其研究尚处于实验室阶段。如何降低微生物絮凝剂成本,成为当今研究的热点。国内外学者也曾利用淀粉废水、味精废水和豆制品废水作为廉价替代培养基进行微生物絮凝菌的培养,但研究报道还不多[6~8]。
本研究以高效微生物絮凝剂产生菌WN-2为研究对象,采用酱油废水为培养基,利用高岭土悬浮液对所产微生物絮凝剂进行絮凝率测定,考察了各种条件如外加碳源、氮源、无机盐、培养时间、pH值等因素对絮凝率的影响,优化了培养条件,以期为高效微生物的利用提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种 微生物絮凝剂产生菌由本实验室从温州调味品有限公司活性污泥分离、筛选得到。
1.1.2 培养基 发酵培养基 葡萄糖20.0 g,磷酸二氢钾2.0 g,磷酸氢二钾5.0 g,硫酸铵0.2 g,氯化钠0.1 g,尿素0.5 g,酵母膏0.5 g,硫酸镁0.2 g,琼脂15~20 g,蒸馏水1 000 mL,pH=7.5~8.5。
保藏培养基:牛肉膏5.0 g,蛋白胨10.0 g,氯化钠5.0 g,琼脂15~20 g,蒸馏水1 000 mL,pH =7.0~7.2。
酱油废水培养基取自海螺集团生产酱油后所产生的酱油废水。COD值为89 398.72 mg/L,NHN为90.2 mg/L,TN为102.8 mg/L,TP为3.7 mg/L,pH=5.27,其为车间的冲冼水和生产老抽时产生的废糖蜜水混合在一起,主要成分为多糖,因此COD含量高。经抽滤后,用于菌株的廉价培养。
1.1.3 高岭土悬浊液 在100 mL量筒中加入80 mL蒸馏水,0.4 g高岭土(化学纯,平均粒度4.5 μm),5 mL 1%CaCl2溶液,2 mL上清液待测样品,再加蒸馏水至100 mL,制成4 g/L的高岭土悬浊液(每次测定絮凝率时当场配制)。
1.2 方法
1.2.1 絮凝率的测定 絮凝效果用絮凝率来表征。在100 mL量筒中加入80 mL蒸馏水,0.4 g高岭土(化学纯,平均粒度4.5 μm),5 mL 1% CaCl2溶液,2 mL上清液待测样品(取0.5 mL接种到50 mL发酵培养基中,35℃,160 r/min恒温振荡培养72 h后,将所得的培养液在10 000 r/min下离心15 min,得上清液),再加蒸馏水至100 mL,调节pH值至7.0,然后倒入150 mL烧杯,放在磁力搅拌器上快速搅拌1 min,慢速搅拌3 min,静置10 min,以吸管吸取一定深度的上清液于紫外可见分光光度计550 nm处测定吸光度,同时以不加含絮凝剂的上清液作对照实验并用以下公式计算其絮凝率:

式中,A为对照上清液在550 nm处的吸光度,B为样品上清液在550 nm处的吸光度。
1.2.2 不同废水浓度对絮凝率的影响 将酱油废水稀释为原水的1/2、1/4、1/8后,将WN-2菌投入到培养基中,置于160 r/min,30℃条件下培养,分别测定其絮凝率和COD,考察不同废水浓度对絮凝率的影响。
1.2.3 微生物絮凝剂产生菌培养条件的优化试验 采用单因素优化实验,分别外加碳源、氮源、无机盐、改变培养基中初始pH、培养时间、培养转速、培养温度选出絮凝菌在各种单因子改变时最优条件。
不同外加碳源:分别加入各种碳源、葡萄糖、蔗糖、淀粉、果糖,质量浓度为2 g/L,接种后置于160 r/min,30℃条件下培养,分别测定其絮凝率,考察不同外加碳源对絮凝率的影响。
不同外加氮源:分别加入各种氮源、硝酸钾、氯化铵、牛肉膏、蛋白胨,质量浓度为3 g/L,接种后置于160 r/min,30℃条件下培养,分别测定其絮凝率,考察不同外加氮源对絮凝率的影响。
不同外加无机盐:分别加入各种无机盐、磷酸氢二钾、硫酸镁、氯化钠、氯化钙,质量浓度为0.2 g/L,接种后置于160 r/min,30℃条件下培养,分别测其絮凝率,考察不同外加无机盐对絮凝率的影响。
初始pH的选择:pH值分别调至4.0、5.0、6.0、7.0、8.0、9.0、10.0,接种后置于160 r/min,30℃条件下培养,分别测定其絮凝率,考察不同培养基初始pH值对絮凝率的影响。
培养转速的选择:调节摇床转速分别为120 r/min、140 r/min、160 r/min、180 r/min、200 r/min、220 r/min,接种后置于160 r/min,30℃条件下培养,分别测定其絮凝率,考察不同摇床转速对絮凝率的影响。
培养时间的选择:接种后置于160 r/min,30℃条件下培养,分别培养0 h、12 h、24 h、36 h、48 h、60 h后,测定絮凝率,考察不同培养时间对絮凝率的影响,确定最佳培养时间。
2 结果与分析
2.1 不同废水浓度对絮凝率的影响
将酱油废水进行不同浓度稀释,考察不同废水浓度对絮凝率的影响其结果见表1。

表1 酱油废水浓度对絮凝率的影响
由表1可见,最合适的配方为将酱油废水稀释为原来的1/4。酱油废水本身的COD浓度太高,如原水的样品和将原水稀释为1/2的样品,絮凝率分别为0%和43.90%。这是因为由于COD太高时,微生物的生长受一定的抑制,而且培养基的浓度过高,废水中的杂质也影响絮凝效果;但将酱油废水稀释为原来的1/8时,因为COD的浓度太低,此时培养基中的碳源不足,菌生长量仅为4 031 mg/L,影响絮凝效果,絮凝率仅为48.91%。最合适的配方为将酱油废水稀释为原来的1/4,此时培养基的COD为23148 mg/L,絮凝率为77.44%,相比前2种废水,由于其营养丰富,只需原液浓度的1/4,即可满足菌生长的要求。而酱油废水中COD之所以高,是因为车间的冲冼水和生产老抽时产生的废糖蜜水混合在一起,主要成分为多糖,因此COD含量高。其中COD的测定重铬酸钾法。
2.2 絮凝剂产生菌培养条件的优化试验
2.2.1 不同外加碳源对絮凝率的影响 不同外加碳源对絮凝率的影响,结果如表2。

表2 不同碳源对絮凝率的影响
由表2可知,没有外加碳源,直接利用酱油废水作为培养基时,絮凝率为82.0%,加入葡萄糖,蔗糖和果糖均能促进絮凝剂产生菌菌体生长和絮凝剂合成,加入葡萄糖时的絮凝率最高,絮凝率为84.3%。但综合总体数据看,外加碳源后,对絮凝率的提高不明显,可能的原因是酱油废水含有丰富的碳源,其中碳源的量足以满足菌株的生长,因此可不必外加碳源。
2.2.2 不同外加氮源对絮凝率的影响 不同外加氮源对絮凝率的影响,结果见表3。

表3 不同氮源对絮凝率的影响
由表3可知,在没有外加氮源的情况下,絮凝率为82.0%;外加硝酸钾、氯化铵、牛肉膏、蛋白胨,絮凝率分别为82.1%、78.3%、83.1%、82.8%。从絮凝率来看,各种外加氮源条件下对絮凝率的提高不大,由此说明该酱油废水含有较多的氮源,已满足菌株的生长需求,可不必外加氮源。
2.2.3 不同外加无机盐对絮凝率的影响 不同外加无机盐对絮凝率的影响,结果见表4。
由表4可知,在不外加无机盐的时絮凝率为82.0%,外加磷酸氢二钾、硫酸镁、氯化钠、氯化钙时,絮凝率分别为83.4%、81.3%、84.2%、87.1%,说明外加无机盐对酱油废水的絮凝率都有所增加,且在添加氯化钙的情况下,对酱油废水的絮凝率增加较多。
2.2.4 不同培养基初始pH值对絮凝率的影响pH值对微生物的生长和代谢具有很大的影响,太高或太低的pH值都不利于细菌的生长和絮凝剂的产生。一方面pH值过低或过高都会引起微生物表面电荷的改变,从而不利于细胞对营养物质的吸收;另一方面过高或过低的pH值使蛋白质、核酸等生物大分子所带电荷发生变化,从而影响其生物活性。不同培养基初始pH值对絮凝率的影响,结果见图1。由图1可知,初始pH为6.0~8.0范围内具有较高的絮凝率,pH为7.0时最高絮凝率达81.1%。

图1 不同初始pH对絮凝率的影响
2.2.5 不同培养温度对絮凝率的影响 不同培养温度对絮凝率的影响,结果见图2。由图2可知,当培养温度小于30℃时,WN-2菌所产絮凝剂的絮凝率随温度的升高而增强,当培养温度30℃时絮凝率最高,絮凝率为80.2%。继续升高培养温度,絮凝率随温度升高而下降。这是由于微生物生命活动和物质代谢都与温度密切相关,温度过高或过低都会影响细胞内酶的活性,从而影响絮凝剂的絮凝率。

图2 不同温度对絮凝率的影响
2.2.6 不同摇床转速对絮凝率的影响 不同摇床转速对絮凝率的影响,结果见图3。由图3可知,摇床转速在整个范围内对絮凝率影响并不大,当摇床转速小于160 r/min时,随着摇床转速增加絮凝率增大,当转速达到160 r/min之后,絮凝率趋缓而下降,但仍具有较高的絮凝率,最佳摇床转速为160 r/min。
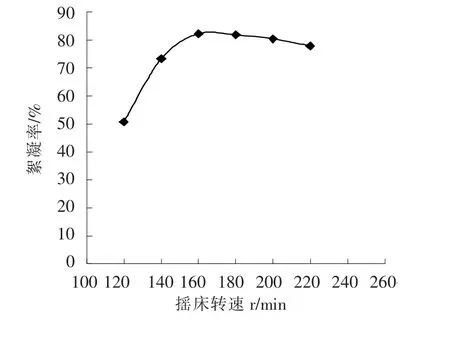
图3 转速对絮凝率的影响
2.2.7 不同培养时间对絮凝率的影响 微生物絮凝剂的生产与菌株培养时间有密切关系,不同培养时间下,菌株表现出不同的絮凝率,结果见图4。由图4可知,WN-2在培养时间36 h达到最高絮凝率80.6%。在刚接种到发酵培养液的一段时间内,由于菌株由生长的迟缓期到对数期,其生长代谢逐渐旺盛,絮凝率也随之提高,WN-2在培养时间24 h后,絮凝率趋于平缓并开始下降,可能是由于体系中解絮凝率酶的产生或生长后期营养物质的耗尽所致[9]。

图4 培养时间对絮凝率的影响
2.2.8 最佳培养条件下的絮凝率 将以上单因素实验所获得WN-2菌株的最佳絮凝条件进行组合,在最佳条件下将WN-2菌接入酱油废水培养基内并对高岭土悬浊液进行絮凝实验,测得其絮凝率为93.6%,由此可见,在最佳的絮凝条件下,菌株WN-2具有较强的絮凝能力。

表5 微生物产絮凝剂的最优培养条件
3 结论
(1)通过单因素条件试验得出WN-2对高岭土悬浊液的最佳絮凝条件为:最佳外加无机盐为氯化钙,浓度为0.2 g/L;最佳培养时间为36 h;最佳pH为7.0;最佳培养温度为30℃;最佳摇床转速为160 r/min。在最佳培养条件下,测得其絮凝率为93.6%。
(2)酱油废水中,外加氮源和外加碳源对微生物产絮凝剂的絮凝率影响均不大,表明该废水中含有较为丰富的碳源和氮源,可以满足微生物的生长需求,实验结果表明利用酱油废水作为替代培养基可以实行废物的资源化利用。
[1] 张悦周,吴耀国,胡思海,等.微生物絮凝剂的研究与应用进展[J].化工进展,2008,27(3):340-347.
[2] Yim J H,Kim S J,Ahn S H,et al.Characterization of a novel bioocculant,p-KG03,from a marine dinoagellate,Gyrodinium impudicum KG03[J].Bioresource Technology,2007,98(1):361-367.
[3] Liu W J,Yuan H L,Yang J S,et al.Characterization of bioflocculants from biologically aerated filter backwashed sludge and its application in dying wastewater treatment[J].Bioresource Technology,2009,100:2629-2632.
[4] 钟文文.微生物絮凝剂产生菌的筛选及其培养条件优化的研究[J].环境工程学报,2007,1(8):140-144.
[5] Ho Y C,Norli I,Abbas F M,et al.Characterization of biopolymeric flocculant(pectin)and organic synthetic flocculant(PAM):A comparative study on treatment and optimization in kaolin suspension[J].Bioresource Technology,2010,101:1166-1174.
[6] 毛艳丽,王远红,刘瑞群.利用糖蜜废水生产微生物絮凝剂及其絮凝条件优化[J].中国给水排水,2008,24(23):20-28.
[7] 刘国祥,尹 华,彭 辉,等.豆腐废水廉价培养制备微生物絮凝剂的研究[J].环境学报,2006,6(1): 103-106.
[8] 刘 晖,周康群,胡勇有,等.青霉菌HHE-P7利用桔水培养微生物絮凝剂的研究[J].水处理技术,2005,31(2):51-54.
[9] Zhang W,Xiong R C,Wei G.Biological flocculation treatment on distillery wastewater and recirculation of wastewater[J].Journal of Hazardous Materials,2009,172:1252-1257.
