矿山酸性水中浸矿细菌的筛选及除铁效果
2014-04-03陆洪省刘月月赵晓舒王亚舒
陆洪省 刘月月 赵晓舒 王亚舒
(山东科技大学化学与环境工程学院,山东青岛266590)
我国许多煤矿,尤其是多年的老矿井,其煤层所处地质构造多富含矿物质,在矿井水长期的溶蚀过程中,通过一系列的生物化学反应生成酸性矿井水。酸性矿井水的酸度值较低,一般pH值在2~5之间,利用酸性矿井水中中温嗜酸菌对贫矿、尾矿中的多种金属硫化物进行浸矿处理是目前研究的热点之一[1-6]。
细菌浸矿是利用细菌与矿石中的金属化合物发生物化作用,将其中的金属从矿石中溶脱出来的过程。细菌浸矿集采矿、选矿和冶金于一身,具有能耗少、成本低、流程简单和无污染等特点。目前,细菌浸矿中应用较多的中温嗜酸菌有氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)、氧化硫硫杆菌(Acidi-thiobacillus thiooxidans)以及氧化亚铁钩端螺旋菌(Leptospirillum ferrooxidans)等,对成团泛菌在浸矿中应用的研究在国内未见报道[9-12]。
本研究是从兖州煤矿酸性矿井水中分离、筛选到1株具有产酸能力的浸矿(铁矿)细菌,属成团泛菌,并对分离得到的菌株外部形态、生长特性、除铁效率以及系统分类等进行了分析,以期为细菌冶金新菌种的发现和低品位矿石的综合利用提供参考依据。
1 实验材料与方法
1.1 培养基
9 K液体培养基[13]。A液:(NH4)2SO43.0 g/L,K2HPO40.5 g/L,KCl 0.1 g/L,MgSO4·7H2O 0.5 g/L,Ca(NO3)20.01 g/L,去离子水溶解,调pH值2.0,121℃灭菌20 min;B液:FeSO4·7H2O 44.78 g/ L,去离子水溶解,调pH值至2.0,用0.22μm孔径的滤膜过滤除菌。
9 K固体培养基配制。在A液中加入15 g/L的琼脂,121℃灭菌20 min,冷却至70℃左右与B液混合待用。A液、B液的组成及配制方法同液体培养基配制。
9 K半固体培养基配置。在A液中加入3 g/L的琼脂,其配制方法及其他成分组成同9K固体培养基。
1.2 菌株的分离和培养
将10 mL兖州煤矿酸性矿井水加入到盛有150 mL 9K液体培养基的三角瓶中,恒温振荡培养(30℃,150 r/min)15 d,培养至培养液的颜色呈红棕色。取0.03 mL培养液划线培养于9K固体培养基上,30℃培养,挑取单菌落接入9K液体培养基中恒温振荡培养(30℃,150 r/min),再划线平板固体培养,重复上述操作3次,将纯化菌株保存于9K半固体培养基中,待用。
1.3 温度对细菌生长以及培养过程中pH的影响
将处于对数增长期的菌株培养液5 mL接种于100 mL的9K液体培养基中,分别置于25℃、30℃和35℃条件下振荡培养(150 r/min)9 d,利用血球计数板分别对细菌计数,确定最适生长温度,同时测定培养液中pH值。
1.4 温度对细菌氧化率的影响
将处于对数增长期的菌株培养液5 mL接种于100 mL的9K液体培养基中,作为对照。同时将5 mL去离子水接入到100 mL的9K液体培养基中,分别对其进行恒温振荡培养(30℃,150 r/min),每隔72 h对培养液中二价铁含量进行测定,通过培养液中二价铁含量变化评价菌株的氧化效率,二价铁含量测定采用重铬酸钾滴定法[14-15]。
Fe2+氧化率计算公式:
Fe2+氧化率(%)=(C0-Ct)/C0×100%.
其中,C0、Ct分别为溶液中Fe2+的初始浓度和最终浓度,g/L。
1.5 菌株DNA的提取、PCR扩增以及系统发育分析
1.5.1 细菌DNA提取方法
采用柱式细菌基因组抽提试剂盒(UNIQ-10)对菌株进行DNA提取,提取方法按试剂盒说明书。
1.5.2 PCR扩增引物
PCR扩增引物采用细菌16S rDNA通用引物,引物序列为:7F,5'-CAGAGTTTGATCCTGGCT-3'; 1540R,5'-AGGAGGTGATCCAGCCGCA-3'。
1.5.3 PCR反应条件
反应体系(25μL):2.5μL 5×Buffer(with Mg2+),0.5μL模板DNA,各0.5μL 7F(10μmol)和1540R(10μmol),1μL dNTP(各2.5 mmol),超纯水定容至25μL。PCR反应条件:98℃预变性3 min;98℃变性25 s,55℃退火25 s,72℃延伸1 min,30个循环,再72℃延伸10 min。上海生工生物工程公司对菌株16S rDNA测序。
将测得的16S rDNA序列发送到DDBJ(DNA Data Bank of Japan,http:∥www.ddbj.nig.ac.jp/)数据库中的Blast中进行相似性比对,利用CustalX2.1和Mega5(Molecular Evolutionary Genetics Analysis)软件创建系统树,创建方法为邻接法(Neighbor-Joining)。
2 试验结果与讨论
2.1 菌株的分离及形态特征
细菌培养液经划线培养于9K固体平板上,经5~6 d培养后,肉眼观察到平板上有菌落隆起,菌落颜色最初为黄色,随着培养时间的延长,菌落逐渐过渡到铁锈红色。显微镜观察菌株为杆状,革兰氏染色为阴性。
2.2 温度对细菌生长影响测定
生长在酸性矿井水环境中的细菌大多为嗜酸中温菌,生长温度范围一般为25~35℃[16-17]。分别采用25、30和35℃条件对菌株进行振荡培养,在培养过程中利用血球计数板方法计数,结果见图1。
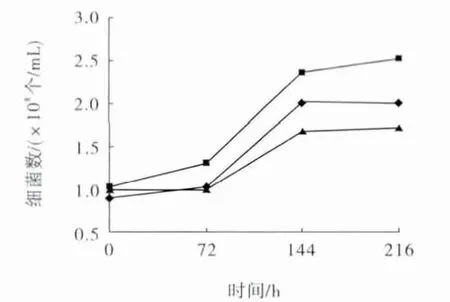
图1 温度对SKDYJ-1菌株生长的影响Fig.1 Effect of temperature on grow th of SKDYJ-1strain
从图1可以看出,30℃培养条件下的细菌数目明显高于25℃和35℃,当温度过高或过低时,细菌的生长以及繁殖缓慢甚至受到抑制。培养9 d时细菌数目基本处于稳定状态,细菌数目分别为2.0×108个/mL(25℃),2.5×108个/mL(30℃),1.7×108个/mL(35℃)。
2.3 温度对细菌培养过程中pH的影响测定
细菌在生物浸矿过程中除了将Fe2+氧化成Fe3+外,还将低价硫氧化成高价硫,形成硫酸而导致周围环境pH发生变化。在25℃、30℃和35℃条件下培养,每隔72 h测定培养液pH值,结果见图2。

图2 温度对菌株SKDYJ-1培养过程中pH的影响Fig.2 Effect of temperature on pH value during the culture process of SKDYJ-1strain
由图2可以看出,随着培养时间的延长,培养液中的pH均呈现下降趋势。25℃、30℃和35℃培养条件下,培养液中pH值从2.6分别下降到1.9、2.52和2.34。30℃和35℃培养条件下pH下降趋势相似且明显高于25℃条件下的培养,在30℃条件下,最终发酵液pH值最低,说明该温度条件下菌株产酸最多。因此,菌株最适合的生长温度为30℃,并且有利于酸的产生。
2.4 温度对菌株氧化活性的影响测定结果
细菌的浸矿作用之一是将Fe2+氧化成Fe3+[18],另一作用是通过产生酸性物质维持生存环境为酸性,因此,细菌对Fe2+的氧化效率直接影响到浸矿效果。在25℃、30℃和35℃3种温度下振荡培养,每隔72 h测定菌株对Fe2+的氧化效果,结果见图3。

图3 不同温度条件下菌株SKDYJ-1的Fe2+氧化率Fig.3 Fe2+oxidation rate of strain SKDYJ-1 under different tem peratures
从图3可以看出,30℃、35℃以及25℃培养条件下菌株对二价铁的最大氧化率分别为 6.52%、5.59%和2.79%,30℃培养条件下的氧化率明显高于35℃和25℃条件,这可能与菌株在30℃培养条件产酸量最多有关。
2.5 系统发育分析
对该菌株DNA进行PCR扩增,得到1 434 bp的16S rDNA基因序列,将该序列发送到DDBJ(DNA data bank of Japan)数据库进行相似性比对,结果发现该菌株与成团泛菌P.agglomerans P1SAA(FJ611818)的同源性最高,达98%。选择与菌株同源性较高的24个菌株的16S rDNA基因序列创建系统发育树,见图4。
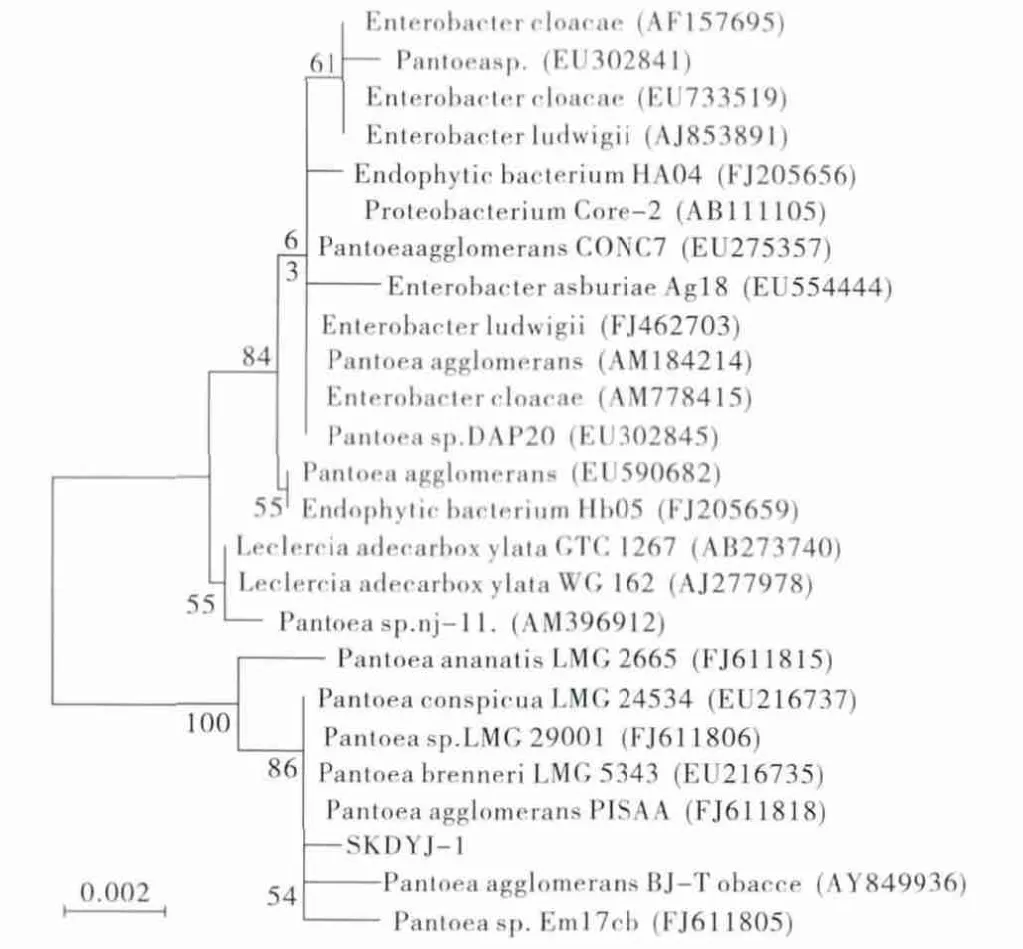
图4 菌株SKDYJ-1的16S rDNA的系统发育树(采用方法为紧邻法)Fig.4 16S rDNA phylogenetic tree of Strain SKDYJ-1 w ith the nearest neighbor method
由图4结果发现,系统树分为两个大类群,且菌株处于Pantoea组成的群中,与P.agglomerans P1SAA (FJ611818)亲缘关系最近。综合菌株生理生长性质以及系统发育分析,确定该菌株属于成团泛菌属,并最终命名为Pantoea sp.SKDYJ-1。
3 结论
(1)分离得到的菌株SKDYJ-1杆状,革兰氏染色为阴性,最适宜生长温度为30℃。
(2)在25℃、30℃和35℃3种温度下,对菌株SKDYJ-1振荡培养,测定其对Fe2+的氧化率分别为2.79%,6.52%和5.59%,该菌株具有较高的浸矿能力,且在30℃培养条件下氧化能力最强。
(3)通过对菌株SKDYJ-1 DNA的提取,16S rDNA序列测定以及系统发育位置的分析,确定该菌株属于成团泛菌属。
[1] 王 磊,李泽琴,姜 磊.酸性矿山废水的危害与防治对策研究[J].环境科学与管理,2009,34(10):82-84.
Wang Lei,Li Zeqin,Jiang Lei.Acidic mine waste water hazards and countermeasures research[J].Environmental Science and Management,2009,34(10):82-84.
[2] 尹国勋,王 宇,许 华,等.煤矿酸性矿井水的形成及主要处理技术[J].环境科学与管理,2008,33(9):100-102.
Yin Guoxun,Wang Yu,Xu Hua,etal.The formationmechanism and major treatment technology of acidic mine water[J].Environmental Science and Management,2008,33(9):100-102.
[3] 孙 海,刘 宁.煤矿环境污染问题研究[J].矿产保护与利用,2000,4(2):9-13.
Sun Hai,Liu Ning.Environment Pollution in CoalMine and Countermeasures to Cure it[J].Conservation and Utilization of Mineral Resources,2000,4(2):9-13.
[4] 胡立峰.煤矿酸性矿井水成因及其处理方法[J].煤田地质与勘探,2003,33(8):64-66.
Hu Lifeng.The generation of acidmine drainage and disposalmethod[J].Coal Geology and Exploration,2003,33(8):64-66.
[5] 丛志远,赵峰华,郑晓燕.煤矿酸性矿井水研究进展[J].煤炭环境保护,2002,16(5):8-11.
Cong Zhiyuan,Zhao Fenghua,Zheng Xiaoyan.Progress in the research of acid mine drainage[J].Coal Mine Environmental Protection,2002,16(5):8-11.
[6] 黄世龙,王学军.强酸性矿井水的综合治理[J].山西煤炭,2001,21(4):26-28.
Huang Shilong,Wang Xuejun.Comprehensive handling of strong acid mine water[J].Shanxi Coal,2001,21(4):26-28.
[7] Bartlett R W.Biooxidation heap pretreatment of sulfide refractory gold ore[J].Mineral Processing and Extractive Metallurgy Review,1996,16(2):89-124.
[8] Smith R W,Misra M.Recent developments in the bioprocessing of minerals[J].Mineral Processing and Extractive Metallurgy Review,1993,12(1):37-60.
[9] 刘雅琴,杨 丽,李国英,等.成团泛菌引起的棉花烂铃病对棉花产量因子和品质的影响[J].植物保护,2008,34(5):103-106.
Liu Yaqin,Yang Li,Li Guoying,et al.Effects of cotton boll rot caused by Pantoea agglomerans on cotton traits and yield[J].Plant Protection,2008,34(5):103-106.
[10] 曹慧英,张力群,朱振东,等.成团泛菌对玉米自交系PS056致病性基因yhfK的克隆[J].中国农业科学,2011,44(2):299-306.
Cao Huiying,Zhang Liqun,Zhu Zhendong,et al.Cloning of a pathogenicity gene yhfK from Pantoea agglomerans onmaize inbred line PS056[J].Scientia Agricultura Sinica,2011,44(2):299-306.
[11] 杨劲峰.成团泛菌产微生物絮凝剂处理石料废水的研究[J].河北化工,2013,36(2):60-62.
Yang Jinfeng.Study on treatmentof stonewastewater usingmicrobial flocculant produced by Pantoea agglomerans[J].Hebei Huagong,2013,36(2):60-62.
[12] 吴春媛,李芳柏,周顺桂,等.成团泛菌MFC-3的分离鉴定及其腐殖质/Fe(Ⅲ)呼吸特性研究[J].环境科学,2010,31(1): 237-242.
Wu Chunyuan,Li Fangbai,Zhou Shungui,et al.Isolation and characterization of a facultative anaerobe Pantoea agglomerans MFC-3 and its humic substance and Fe(Ⅲ)-respiring activity.Enviromental Science,2010,31(1):237-242.
[13] 张在海,邱冠周,胡岳华,等.氧化亚铁硫杆菌的菌落分离研究[J].矿产综合利用,2001(1):19-23.
Zhang Zaihai,Qiu Guanzhou,Hu Yuehua,etal.The investigation of the colony isolation of Thiobacillus ferrooxidans[J].Multipurpose Utilization of Mineral Resources,2001(1):19-23.
[14] Boon M,SniderM,Hansford G S.The oxidation kineticsof zinc sulphide with Thiobacillus ferrooxidans[J].Hydrometallurgy,1998,48(12):171-186.
[15] 任浏祎,覃文庆,王 军,等.黄铜矿细菌浸出过程中的多因素影响[J].矿冶工程,2008,28(4):61-65.
Ren Liuyi,Qin Wenqing,Wang Jun,et al.Study on several complicated factors effect in bacterial leaching of chalcopyrite[J].Mining and Metallurgical Engineering,2008,28(4):61-65.
[16] Jack Barrett,HughesM N,Karavaiko G L.Metal Extraction by Bacterial Oxidation of Minerals[M].Chichester England:Ellis Horwood Iimited,1993.
[17] 姚国成,阮仁满,温健康.生物冶金常用浸矿菌种及改良育种的基本方法[J].金属矿山,2002(11):26-29.
Yao Guocheng,Ruan Renman,Wen Jiankang.Ore leaching bacterin commonly used in biologicalmetallurgy and basic methods of their culture improvement[J].Metal Mine,2002(11):26-29.
[18] 方兆珩,柯家骏.生物浸出低品位镍铜硫化矿[J].有色金属:冶炼部分,2002(4):2-8.
Fang Zhaoheng,Ke Jiajun.Bioleaching of low-grade Ni Cu sulfide ore[J].Nonferrous Metal,2002(4):2-8.
